서 론
아질산염은 염지육제품을 제조할 때에 필수로 첨가하는 염지제로써 육제품에 염지 특유의 풍미와 색깔을 발생시키고, 항산화 활성을 증가시키며, 부패균과 병원성 미생물의 생장을 억제하여 유통기한을 연장시킨다(Wórjciak et al., 2014). 하지만 아질산염은 amine 또는 amide와 반응해 발암성을 가진 N-nitroso 화합물을 생성할 수 있기 때문에 소비자들은 아질산염의 인체 유해성에 대해 우려하고 있는 실정이다(De Mey et al., 2017). 이로 인해 시금치, 샐러리, 레드비트, 토마토, 산딸기 등의 식물성 추출물에서 아질산염을 대체할 수 있는 첨가물용 소재를 찾고자 하는 연구들이 계속 진행되고 있다(Bedale et al., 2016).
치자나무(Gardenia jasminoides Ellis)는 꼭두서니과(Rubiaceae) 치자속(Gardenia)에 속하고 상록활엽의 특징을 가진 관상용 나무로써 전세계적으로 아열대 및 열대 지역에 분포해 있으며, 주로 산비탈과 길가에서 생장한다(Yu et al., 2012). 치자(Gardenia jasminoides)는 이러한 치자나무의 열매이며, 중국에서는 전통적으로 항염증, 해열, 담즙 분비, 이뇨를 위한 약재로 이용돼 왔다(Tseng et al., 1995). 치자의 주요 생리활성 성분은 iridoid glycoside로 항산화, 항암, 항염증, 항비만, 항혈전 효과를 가지고 있다(Suzuki et al., 2001; Liu et al., 2007; Liu et al., 2009; Wang et al., 2010; Kim et al., 2012).
치자 추출물은 자유라디칼을 소거하고 금속이온을 환원시키는 능력이 뛰어나 식품을 제조시 첨가할 경우 지방산화를 억제해 저장성을 증진시킨다고 보고됐다(Kim, 2006). 또한 특유의 수용성 색소 성분을 함유하고 있어 음료, 주류, 과자, 사탕, 빵, 요리를 위한 천연 색소로도 활용되고 있다(Selim et al., 2000; Watanabe and Terabe, 2000). 하지만 현재까지 육가공 분야에서는 치자 추출물을 첨가물 소재로 활용된 바 없을 뿐만 아니라, 아질산나트륨 대체제로 활용된 연구도 거의 보고된 바 없는 실정이다. 따라서 본 연구는 치자 추출물의 아질산염 대체 가능성을 조사하기 위해 치자 추출물의 첨가가 닭고기 패티의 품질특성에 미치는 영향을 구명하고자 실시했다.
재료 및 방법
치자 추출물 제조
치자 추출물 제조를 위해 국산 치자(Gardenia jasminoides)를 시중으로부터 구입해 가정용 믹서형 분쇄기로 분말화시키고, 표준체(Standard Testing Sieve No. 35, Chunggye Co., Seoul, Korea)를 이용해 500 μm 이하의 입자로 거른 후 70% ethanol과 1:10의 비율로 혼합했다. 준비된 혼합물은 40°C에서 5시간 동안 초음파(8510 model, Branson Ultrasonics Corp., Danbury, CT, USA) 처리한 후 filter paper No. 5 (Advantec MFS, Inc., Tokyo, Kanto, Japan)로 여과했다. 이후 rotary vacuum evaporator (N-1000, Eyela Tokyo Rikakikai Co., Ltd., Tokyo, Kanto, Japan)를 이용해 40°C에서 감압농축한 다음 닭고기 패티의 제조 전까지 4°C에서 보관했다.
닭고기 패티 제조 및 실험설계
지역 육가공업체로부터 국산 닭고기 가슴육과 다리육을 구입해 6 mm와 4 mm plate (MS-12S Meat Chopper, Hankook Fujee Industries Co., Ltd., Suwon, Gyeonggi-do, Korea)로 순차적으로 분쇄한 후 가슴육과 다리육을 1:1의 비율로 혼합했다. 이후 분쇄육을 1 kg씩 5개 처리구로 나누고, 각각 치자 추출물 및 아질산나트륨 무첨가구(대조구, C), 아질산나트륨 200 ppm (T1), 치자 추출물 0.5% 및 아질산나트륨 150 ppm 첨가구(T2), 치자 추출물 1.0% 및 아질산나트륨 100 ppm (T3), 치자 추출물 1.5% (T4)로 제조했으며, 모든 처리구들에는 공통적으로 NaCl 1%를 첨가했다. 준비된 혼합물은 petri dish (φ50 × 12 mm, SPL Life Sciences Co., Ltd., Pocheon, Gyeonggi-do, Korea)를 이용해 패티(20개/그룹)로 성형하고, 식품포장용 선상 저밀도 폴리에틸렌 랩(Cleanwrap Co., Ltd., Gimhae, Gyeongsangnam-do, Korea)으로 포장한 후 4°C에서 9일간 저장했다. 시료의 품질특성 분석은 저장 0, 3, 6, 9일째에 처리구당 5개씩 실시했다.
pH
pH는 시료 3 g과 증류수 27 mL를 Warring blender (PH91, SMT Co., Ltd., Tokyo, Kanto, Japan)로 2,800 × g에서 30초간 혼합한 다음 pH meter (SevenEasy pH, Mettler-Toledo GmbH, Greifensee, Zürich, Switzerland)로 측정했다.
TBARS 함량
TBARS (2-thiobarbituric acid reactive substances) 함량은 Sinnhuber and Yu(1977)의 방법을 이용하여 실시했다. 시료 0.5 g에 항산화제(3% butylated hydroxytoluene, 3% butylated hydroxyanisole, 40% Tween20, 54% propylene glycol) 200 μL, 1% TBA in 0.3% NaOH 3 mL 및 2.5% TCA in 36 mM HCl 17 mL를 순차적으로 첨가하고, 100°C에서 30분간 가열한 후 얼음물에 10분간 냉각했다. 이후 상등액 5 mL와 chloroform 2 mL를 원심분리용 tube에 옮기고, 20°C, 2,550 × g (GS-6R Centrifuge, Beckman Instruments, Inc., Palo Alto, CA, USA)에서 30분간 원심분리한 다음 상층액의 OD를 532 nm (UV-mini-1240, Shimazu Corp., Kyoto, Kansai, Japan)에서 측정했다. 최종 결과는 mg malonaldehyde (MDA)/kg meat로 산출했으며, blank는 증류수(0.5 mL)를 시료와 동일한 실험과정으로 처리해 준비했다.
과산화물가
과산화물가(Peroxide value)는 Shantha and Decker(1994)의 방법을 이용해 실시했다. 시료 0.4 g과 10 % BHT 50 μL, chloroform-methanol (2:1) 5 mL를 Ultra-Turrax (T25 Basic, Ika Werke GmbH and Co., KG., Staufen, Baden-Württemberg, Germany)로 1,296 × g에서 15초간 균질하고, filter paper No. 1 (Whatman International Ltd., Maidstone, Kent, England)으로 여과한 후 chloroform-methanol (2:1) 5 mL를 첨가했다. 여액 10 mL와 3차 증류수 2 mL를 2초간 vortex-mixing한 후 2°C, 2,550 × g (GS-6R Centrifuge, Beckman Instruments, Inc., USA)에서 3분간 원심분리했다. 이후 하층액 3 mL를 다른 tube에 옮기고, chloroform-methanol (2:1) 1.9 mL, ammonium thiocyanate 25 μL, iron (Ⅱ) chloride 25 μL를 첨가한 다음 20분 후에 500 nm (UV-mini-1240, Shimazu Corp., Japan)에서 OD를 측정했다. 최종결과는 시료 1 kg당 milliequivalent (MEV) peroxide로 산출했다.
표면육색
시료 표면의 CIE(2004) L* (명도, lightness), a* (적색도, redness) 및 b* (황색도, yellowness)는 chroma meter (CR-310, Konica Minolta Optics, Inc., Osaka, Kansai, Japan)를 이용하여 측정했다. Chroma meter는 사용 직전에 white calibration plate (CR-A43, Konica Minolta Sensing, Inc., Japan; light source: illuminant C; Y=93.6, x=0.3134, y=0.3194)로 보정했다.
보수력
보수력(Water-holding capacity)은 Hofmann et al. (1982)에 의해 개발된 filter paper press법을 통해 실시했다. 시료 0.3 g을 Whatman filter paper NO. 2 위에 정량하고, plexi-glass plate를 이용해 filter paper 윗면과 아랫면을 동시에 5분간 압착했다. 이후 digital planimeter (Super planix-α, Tamaya Technics Inc., Tokyo, Kanto, Japan)를 이용해 filter paper 중앙에 압착돼 있는 시료의 면적과 시료 외부에 젖어있는 수분의 면적을 측정했다. 최종결과는 시료 외부에 젖어있는 수분의 면적에 대한 시료 면적의 백분율(%)로 산출했다.
통계분석
본 연구의 모든 결과들은 SPSS (2009, PASW Statistics for Windows, Version 18.0) program의 analysis of variance를 이용해 분산분석을 실시했다. 각각의 저장기간별 서로 다른 처리구 및 각각의 처리구별 서로 다른 저장기간의 평균값들간에 유의적 차이는 5% 수준에서 Duncan’s multiple range test를 통해 검증했다.
결과 및 고찰
pH
아질산나트륨의 대체제로 치자 추출물의 첨가가 닭고기 패티의 4°C 저장 중 pH에 미치는 영향은 Fig. 1과 같다. 모든 저장기간 동안 T2 (치자 추출물 0.5% + 아질산나트륨 150 ppm 첨가구), T3 (치자 추출물 1.0% + 아질산나트륨 100 ppm 첨가구) 및 T4 (치자 추출물 1.5% 첨가구)의 pH가 대조구(C)와 T1 (아질산나트륨 200 ppm 첨가구)에 비해 유의적으로 낮은 수치를 보여 주었다(p < 0.05). 또한 치자 추출물의 첨가 수준이 증가할수록 닭고기 패티의 pH가 감소해 모든 저장기간 동안 T2 < T3 < T4 순으로 유의적으로 낮게 나타났다(p < 0.05). 각각의 첨가구별로 저장기간에 따른 pH의 변화를 살펴보면, T1, T2, T3 및 T4의 pH가 저장 9일째에 유의적으로 증가했다(p < 0.05). 하지만 대조구의 경우 저장 3일째에 pH가 유의적으로 증가했다(p < 0.05). 이러한 결과는 식물성 추출물을 소시지에 첨가했을 때 pH가 감소했다는 Aquilani et al. (2018)의 보고와 동일했다. 또한 본 연구에서 치자 추출물의 첨가에 의해 닭고기 패티의 pH가 감소한 이유는 치자 추출물에 3,4-dihroxybenzoic acid와 같은 유기산이 함유돼 있기 때문이다(Yim et al., 1999).
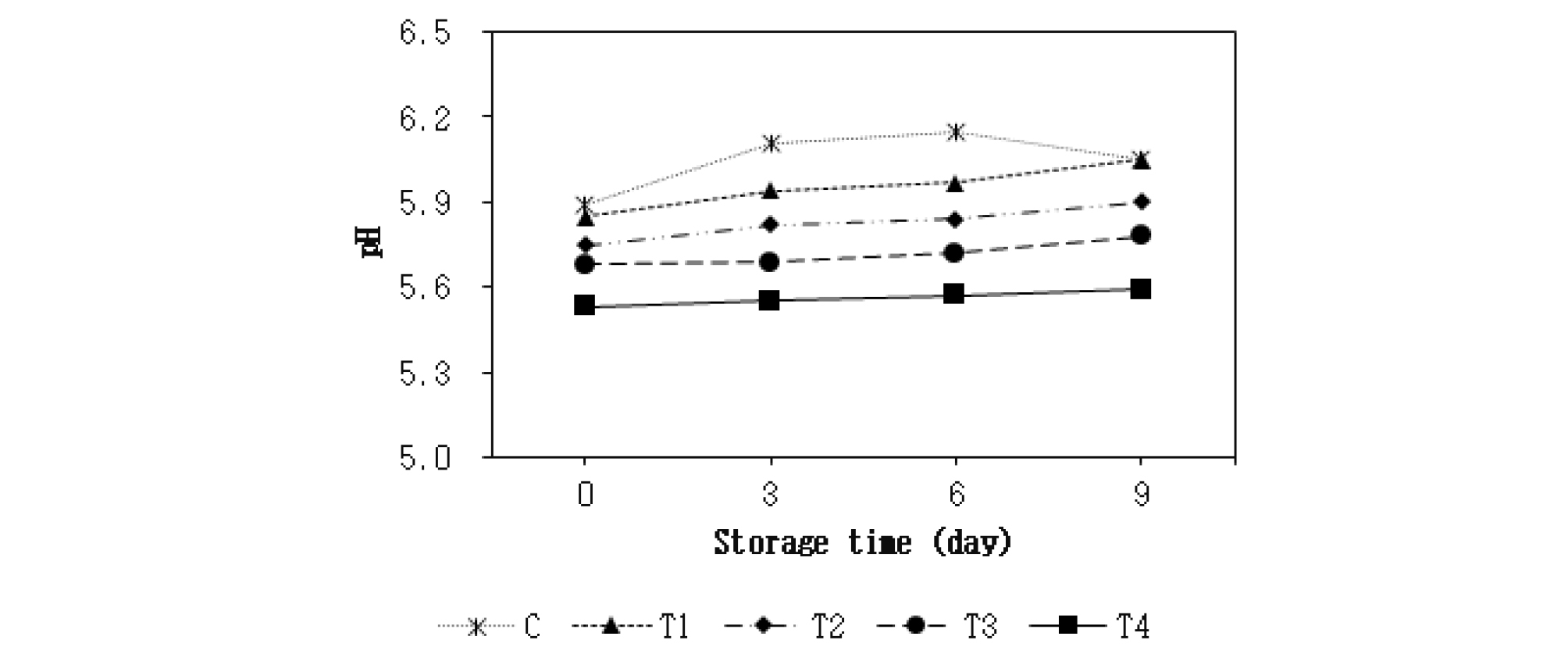
Fig. 1.
Effect of substitution of nitrite with Gardenia jasminoides extract (GJE) on pH value of chicken meat patty during storage at 4°C. Data are indicated as means (n = 5). C : control, no GJE or sodium nitrite (SN); T1 : 200 ppm SN; T2 : 0.5% GJE and 150 ppm SN; T3 : 1.0% GJE and 100 ppm SN; T4 : 1.5% GJE.
지방산화
아질산나트륨의 대체제로 치자 추출물의 첨가가 닭고기 패티의 4°C 저장 중 지방산화에 미치는 영향은 Fig. 2와 같다. TBARS 함량(Fig. 2)은 저장 3일째부터 치자 추출물 첨가구들(T2, T3 및 T4)이 대조구와 아질산나트륨 단독 첨가구(T1)보다 유의적으로 높은 수치를 나타냈으며(p < 0.05), 치자 추출물 단독 첨가구(T4)의 TBARS 함량은 치자 추출물 및 아질산나트륨 복합 첨가구들(T2 및 T3)에 비해 유의적으로 높은 수치를 보여 주었다(p < 0.05). 또한 대조구의 경우 저장 6일째부터 아질산나트륨 단독 첨가구(T1)보다 유의적으로 높은 TBARS 함량을 보여 주었다(p < 0.05). 각각의 첨가구별로 저장기간에 따른 TBARS 함량의 변화는 저장기간 동안 모든 처리구들에서 유의적으로 증가했다(p < 0.05). 과산화물가(Fig. 2)는 치자 추출물 단독 첨가구(T4)가 저장 6일째부터 아질산나트륨 단독 첨가구(T1)보다 유의적으로 높은 수치를 보여 주었으며(p < 0.05), 이후 저장 9일에는 치자 추출물 및 아질산나트륨 복합 첨가구들(T2 및 T3)보다 유의적으로 높은 과산화물가를 나타냈다(p < 0.05). 각각의 첨가구별로 저장기간에 따른 과산화물가의 변화를 보면, 모든 처리구들에서 저장 6일째부터 유의적으로 증가했다(p < 0.05). 치자 추출물의 항산화 효과는 여러 in vitro 실험들에서 보고된 바 있으며(Jeong et al., 2008; Jin et al., 2017; Park et al., 2018), Oh and Choe(2019)는 치자 추출물을 첨가한 약과를 30°C에서 56일간 저장했을 때 지방산화가 억제됐다고 보고했다. 하지만 본 연구에서는 선행연구들과 상반되게 치자 추출물의 첨가로 인해 닭고기 패티의 지방산화가 증가된 이유는 치자 추출물의 강력한 항산화 효과가 오히려 지방산화를 촉진시켰기 때문으로 판단된다. 이에 대한 근거로 Hayes et al. (2009)의 연구가 뒷받침해 준다. 이들은 식물성 추출물을 돼지고기의 산화촉진 모델시스템에 첨가했을 때 오히려 산화가 촉진됐다고 본 연구와 동일하게 보고했으며, 이러한 이유는 식물성 추출물의 강력한 환원력이 펜톤 반응(Fenton reaction; Miller, 1996)을 통해 생성된 3가 철원자를 2가로 더 빨리 환원시킴으로써 오히려 더 많은 자유라디칼을 생성시키기 때문이라고 설명했다.
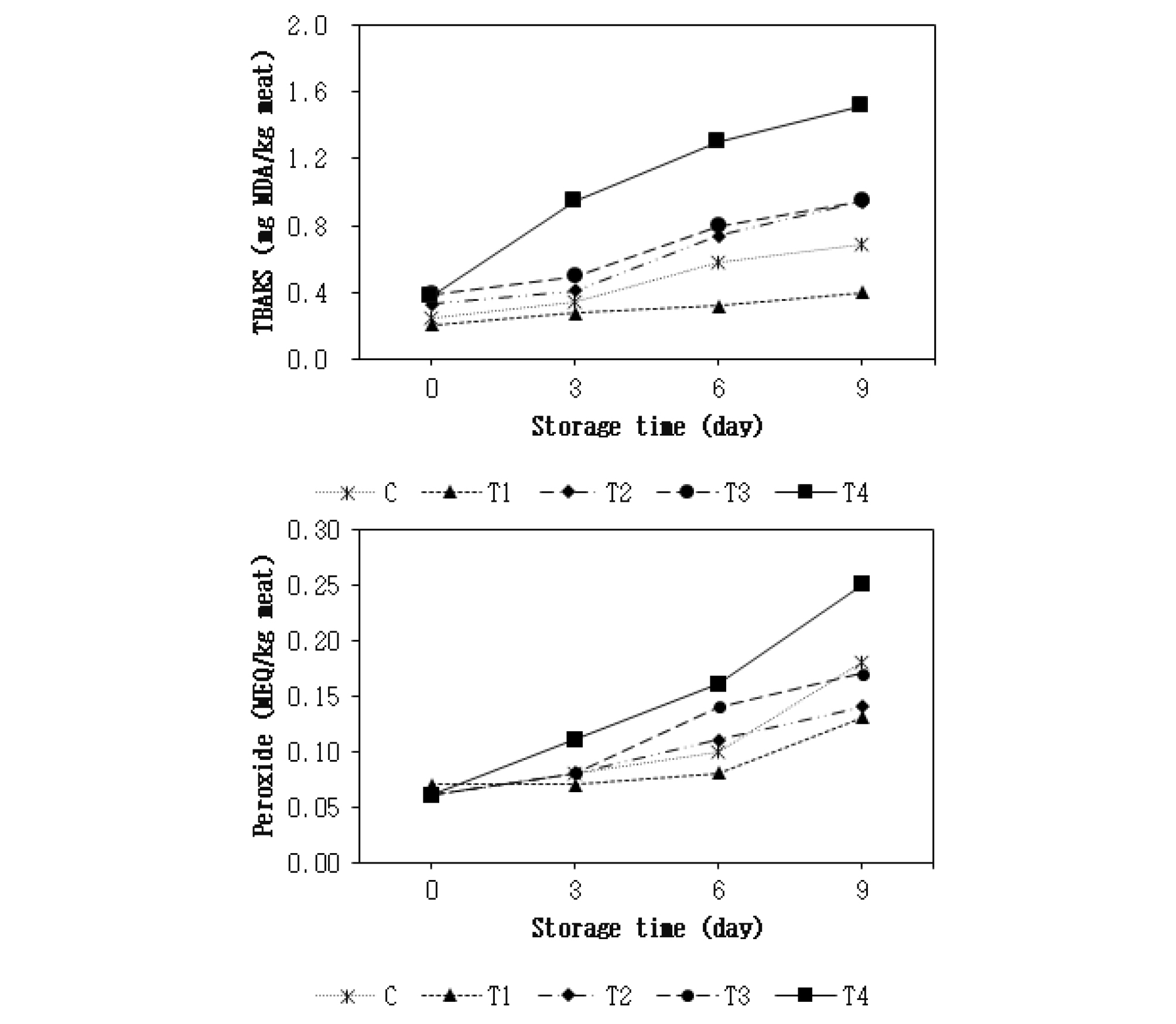
Fig. 2.
Effect of substitution of nitrite with Gardenia jasminoides extract (GJE) on lipid oxidation of chicken meat patty during storage at 4°C. Data are indicated as means (n = 5). C : control, no GJE or sodium nitrite (SN); T1 : 200 ppm SN; T2 : 0.5% GJE and 150 ppm SN; T3 : 1.0% GJE and 100 ppm SN; T4 : 1.5% GJE. MDA : malondialdehyde; MEQ : milliequivalent.
표면육색
아질산나트륨의 대체제로 치자 추출물의 첨가가 닭고기 패티의 4°C 저장 중 표면육색에 미치는 영향은 Table 1과 같다. L* 값(명도)은 치자 추출물 1.0% 및 아질산나트륨 100 ppm 첨가구(T3)와 치자 추출물 단독 첨가구(T4)가 모든 저장기간 동안 대조구(C)와 아질산나트륨 단독 첨가구(T1)보다 유의적으로 낮았다(p < 0.05). 각각의 첨가구별로 저장기간에 따른 L* 값의 변화를 살펴보면, 치자 추출물 단독 첨가구(T4), 치자 추출물 1.0% 및 아질산나트륨 100 ppm 첨가구(T3)와 대조구(C)가 각각 저장 3, 6, 9일째에 유의적으로 증가했다(p < 0.05). a* 값(적색도)은 치자 추출물 1.0% 및 아질산나트륨 100 ppm 첨가구(T3)와 치자 추출물 단독 첨가구(T4)가 모든 저장기간 동안 대조구(C), 아질산나트륨 단독 첨가구(T1) 및 치자 추출물 0.5% 및 아질산나트륨 150 ppm 첨가구(T2)보다 유의적으로 높았다(p < 0.05). 각각의 첨가구별로 저장기간에 따른 a* 값의 변화를 보면, 치자 추출물 단독 첨가구(T4)가 각각 저장 6일째부터 유의적으로 감소한 것으로 나타났다(p < 0.05). b* 값(황색도)은 치자 추출물 첨가구들(T2, T3 및 T4)이 모든 저장기간 동안 대조구(C)와 아질산나트륨 단독 첨가구(T1)보다 유의적으로 높은 수치를 나타냈다(p < 0.05). 각각의 첨가구별로 저장기간에 따른 b* 값의 변화는 치자 추출물 단독 첨가구(T4)가 각각 저장 6일째부터 유의적으로 감소했다(p < 0.05). 본 연구는 치자 추출물을 쌀밥에 첨가했을 때 L* 값은 감소했으나 a* 및 b* 값은 증가했다는 Choo(2002)의 보고와 동일했다. 이러한 이유는 치자 추출물에는 적색을 띄는 iridoid glucoside가 함유돼 있기 때문이다(Shin, 2007).
Table 1. Effect of substitution of nitrite with Gardenia jasminoides extract (GJE) on surface color of chicken meat patty during storage at 4°C
A-DMean ± SD (n=5) in the same column with different superscripts are significantly different (p < 0.05).
1)C : control, no GJE or sodium nitrite (SN); T1 : 200 ppm SN; T2 : 0.5% GJE + 150 ppm SN; T3 : 1.0% GJE + 100 ppm SN; T4 : 1.5% GJE.
2)L* : lightness; a* : redness; b* : yellowness.
보수력
아질산나트륨의 대체제로 치자 추출물의 첨가가 닭고기 패티의 4°C 저장 중 보수력에 미치는 영향은 Table 2와 같다. 저장 6일째에 치자 추출물 첨가구들(T2, T3 및 T4)의 보수력이 아질산나트륨 단독 첨가구(T1)보다 유의적으로 낮은 수치를 보여 주었으나(p < 0.05), 저장 9일째에는 모든 첨가구들간에 유의적인 차이를 나타내지 않았다(p>0.05). 각각의 첨가구별로 저장기간에 따른 보수력의 변화는 치자 추출물 1.0% 및 아질산나트륨 100 pp 첨가구(T3)와 치자 추출물 1.5% 첨가구(T4)가 저장 6일째부터 유의적으로 감소했다(p < 0.05). 또한 대조구(C), 아질산나트륨 단독 첨가구(T1)와 치자 추출물 0.5% 및 아질산나트륨 150 pp 첨가구(T2)의 보수력은 저장 9일째에 유의적으로 감소한 것으로 나타났다(p < 0.05). 고기에서 수분을 보유하는 능력은 고기를 구성하는 단백질과 관련 있다(Duun and Rustad 2007). 고기의 저장기간 동안 발생하는 단백질산화는 고기의 보수력을 떨어뜨리며(Olsson et al., 2007), 고기의 단백질산화는 지방산화로 인해 발생될 뿐만 아니라 촉진된다(Xiong, 2000). 따라서 본 연구에서 치자 추출물 1.0% 및 아질산나트륨 100 pp 첨가구(T3)와 치자 추출물 1.5% 첨가구(T4)의 보수력이 다른 첨가구들에 비해 떨어진 이유는 지방산화가 더 빨리 촉진됐기 때문인 것으로 판단된다.
Table 2. Effect of substitution of nitrite with Gardenia jasminoides extract (GJE) on water-holding capacity (WHC) of chicken meat patty during storage at 4°C
A-BMean ± SD (n=5) in the same column with different superscripts are significantly different (p < 0.05).
1)C : control, no GJE or sodium nitrite (SN); T1 : 200 ppm SN; T2 : 0.5% GJE + 150 ppm SN; T3 : 1.0% GJE + 100 ppm SN; T4 : 1.5% GJE.
요 약
본 연구는 아질산염 대체제로 치자 추출물의 첨가가 닭고기 패티의 품질특성에 미치는 영향을 구명하고자 실시했다. 닭고기 패티는 치자 추출물 및 아질산나트륨 첨가 수준에 따라 5개 처리구(n=5; 대조구 : 치자 추출물 및 아질산나트륨 무첨가구; T1 : 아질산나트륨 200 ppm 첨가구; T2 : 치자 추출물 0.5% + 아질산나트륨 150 ppm 첨가구; T3 : 치자 추출물 1.0% + 아질산나트륨 100 ppm 첨가구; T4 : 치자 추출물 1.5% 첨가구)로 제조한 후 4°C에서 9일간 저장했다. pH는 치자 추출물 첨가 수준이 증가함에 따라 유의적으로 감소했다(p < 0.05). TBARS 함량은 치자 추출물 첨가 수준이 높은 그룹들에서 유의적으로 증가했고(p < 0.05), 특히, 저장 3일째부터 T4의 TBARS 함량이 가장 높았다(p < 0.05). 과산화물가는 저장 9일째에 T4가 T1, T2 및 T3보다 높았다(p < 0.05). 표면육색은 T3와 T4가 대조구, T1보다 낮은 L* 값과 높은 a* 및 b* 값을 보였다(p < 0.05). 보수력은 저장기간 동안 T3 및 T4에서 다른 첨가구들에 비해 빨리 감소했다(p < 0.05). 따라서 아질산염 대체로 첨가한 치자 추출물은 닭고기 패티의 지방산화안정성과 보수력을 떨어뜨렸으나, 적색을 향상시켰다.




