서 론
재료 및 분석
아스파라거스 병 조사 및 분리
DNA 추출, PCR 및 병원균 동정
살균제에 대한 균사 생장 억제효과
결과 및 고찰
줄기썩음병 발생 및 동정
균사 생장에 대한 살균제
요 약
서 론
아스파라거스(Asparagus officinalis L.)는 백합과에 속하는 다년생 숙근성 채소로, 정식 후 2년째 부터 수확이 가능하고 4-5년 후 성숙원이 되며 한번 심으면 10년 이상 재배가 가능한 경제작물이다(Seo et al., 2018). 아스파라거스는 봄에 맹아되는 순을 식용으로 사용하는데, rutin, saponin, caffeic 산, ferulic 산 등의 성분을 함유하고 있어 콜레스테롤 감소, 암 발생 억제, 활성산소 제거, 항산화 등 건강에 유익한 효능을 가지고 있다(Seo et al., 2018; Son et al., 2016; Yoo et al., 2016). 최근 소비자의 식생활 변화와 기능성 채소에 대한 관심 증대로 인해 국내 아스파라거스 소비량이 급증하고 있는 추세이다. 아스파라거스는 전국적으로 약 60 ha 이상의 면적에서 재배되고 있는데, 그 중에서 강원도 지역이 2017년 기준으로 양구, 춘천, 화천, 인제를 중심으로 약 37.4 ha 정도가 재배되어 국내 최대면적으로 성장하였다(Seong et al., 2012; Seo et al., 2018).
전 세계적으로 보고된 주요 아스파라거스 병으로 Puccinia asparagi에 의한 녹병(rust), Phytophthora megaspermae에 의한 역병(phytophthora root rot), Fusarium oxysporum에 의한 줄기썩음병(crown and root rot), Stemphylium vesicarium에 의한 자색반점병(purple spot), Botrytis cinerea에 의한 잿빛곰팡이병(Gray mold), Colletotrichum sp. 에 의한 탄저병(anthracnose) 등이 있는데 이 중 국내에 보고된 균은 줄기썩음병, 잿빛곰팡이병, 탄저병 등이 있다(Blok and Bollen, 1995; Cheah et al., 2003; Navrozidis et al., 2018; Vujanovic et al., 2003). 국내 아스파라거스 재배면적이 크게 늘고 생산량도 크게 늘었지만 아직까지 이러한 균들을 방제하기 위한 살균제가 등록되어 있지 않다. 또한 살균제에 의한 균사 생장 억제 실험도 거의 되지 않아 외국에서 사용되는 살균제를 농가에 추천하여 주로 사용하고 있는 실정이다.
아스파라거스 줄기썩음병 crown and root rot은 주로 F. oxysporum과 F. proliferatum이 species complex를 이루어 우점종으로 병을 일으킨다고 알려져 있다. 하지만 지역에 따라 F. redolens와 F. solani가 우점하여 병을 일으킨다는 것도 보고되고 있다(Elmer, 1997; Borrego-Benjumea et al., 2015). 줄기썩음병은 생육 초기단계 아스파라거스에서 피해가 큰데, 감염된 아스파라거스의 줄기가 썩고 지상부는 노랗게 변해가며 결국 시들어 죽게되어 생산량에 큰 피해를 입힌다(Damicone et al., 2017). 아스파라거스 줄기썩음병을 방제하기 위해 많은 연구가 진행되었는데, 아스파라거스에 직접 살균제를 살포하거나, 아스파라거스 종자를 베노밀 등의 살균제로 소독하거나, 아스파라거스 구근을 살균제에 침지하는 등의 방법이 효과가 있다는 결과가 있다(Elmer, 2015; Falloon et al., 1989; Manning and Vardaro, 1977; Reid et al., 2002). 국내에서도 강진과 화순지역에서 2014년, 2015년에 줄기썩음병이 보고된 기록이 있는데(Myung, 2016), 아직까지 방제연구는 미미한 상황이다. 본 연구에서는 강원도 지역의 아스파라거스 재배지를 조사하여 F. oxysporum에 의한 아스파라거스 줄기썩음병이 문제시 된다는 것을 확인하였다. 또한 아스파라거스 재배지로부터 F. oxysporum을 분리하였고, 시중에 Fusarium 균 방제용으로 판매되고 있는 살균제를 이용하여 균사생장 억제실험을 수행하였다.
재료 및 분석
아스파라거스 병 조사 및 분리
2018년 6-7월 강원도 춘천시와 양구군의 아스파라거스 재배지에서, 높이 60 cm 정도의 생육 초기단계에서 줄기썩음병 병징을 보이는 아스파라거스 이병체를 조사하였다(Fig. 1). 병에 걸린 아스파라거스의 줄기를 실온에서 24시간 동안 말린 후, 5 mm 정도의 크기로 작게 잘라내었다. 표면 살균한 줄기조각을 ampicillin (100 µg/mL)이 첨가된 potato dextrose agar (PDA) (27 g of MB cell potato dextrose broth; 15 g of SIGMA agar; 1000 mL distilled water) 배지에 접종하였고, 25°C에서 3일간 배양하였다. 이병조직에서 발생한 균사를 멸균한 팁을 이용하여 새로운 PDA 배지에 접종 하였고, 25°C에서 3일간 배양하여 포자가 형성되게 한 뒤 단포자 분리 하여 실험에 사용하였다. 분리한 균주들은 각각 포자현탁액을 만들어 50% glycerol에 1:1로 섞은 후 -75°C deep freezer 에 보관하여 사용하였다.
DNA 추출, PCR 및 병원균 동정
분리한 균 동정을 위해 PDA 배지에서 3일간 균을 배양하였고, 10-20 mg 정도의 균사를 긁어내어 drilling method (Chi et al., 2009)를 이용하여 DNA를 추출하였다. 추출한 DNA는 EF-1a-1 (5' ATGGGTAAGGAAGACAAGAC '3)와 EF-1a-2 (5' GGAAGTACCAGTGATCATGTT 3') primers를 사용하여 translation elongation factor 1 alpha (EF-1 alpha) 유전자 지역을 중합효소연쇄반응(polymerase chain reaction,PCR)을 통해 증폭하였고, 그 산물을 서울대학교 농생명과학공동기기원(nicem)에 보내어 DNA 염기서열을 확인하였다(Amatulli et al., 2010; Choi et al., 2009). 확인된 염기서열은 NCBI (http://www.ncbi.nlm.nih.gov)의 BLASTN 프로그램에 검색하여 유사도가 높은 종들의 염기서열을 찾아내었고, MEGA 5.2 프로그램을 사용하여 neighbor-joining 방법에 따라 phylogenetic tree를 그려 분석하였다(Saitou and Nei, 1987; Shin et al., 2014).
살균제에 대한 균사 생장 억제효과
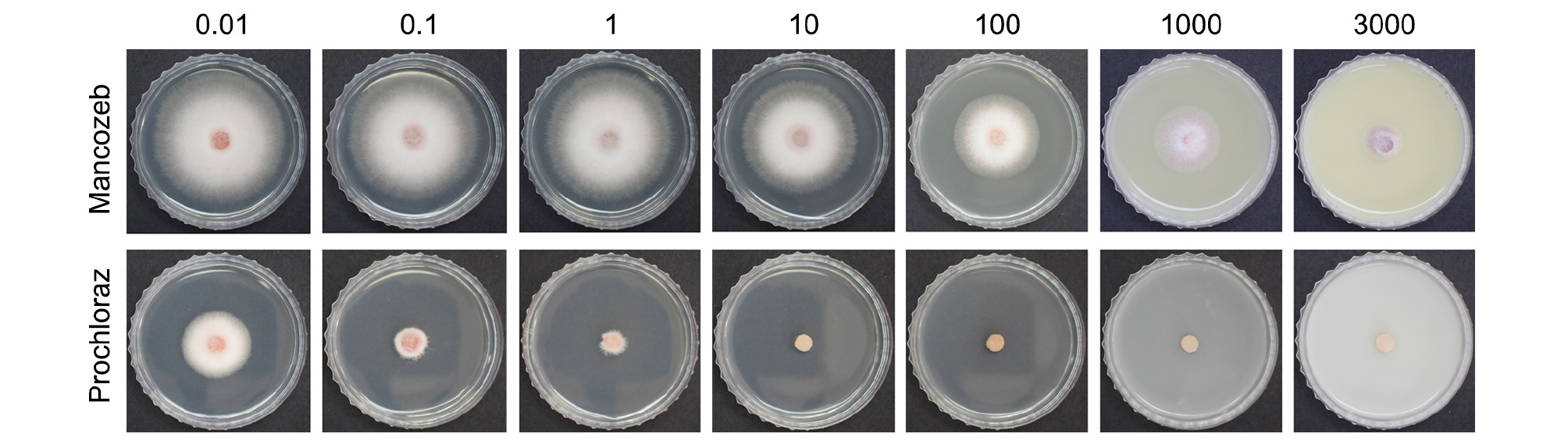
춘천 지역에서 분리된 균 중에서 F. oxysporum KWFO-1과 F. oxysporum KWFO-2를, 양구 지역에서 분리된 균 중에서 F. oxysporum KWFO-10, F. oxysporum KWFO-11을 선발하여 25°C에서 4일간 PDA배지에서 배양하였다. 살균제는 국외에서 아스파라거스 줄기썩음병 방제에 효과가 있었거나, 다른 작물의 Fusarium 방제에 등록되어 있는 6가지를 선발하였다(Table 1). 멸균한 PDA를 65°C 정도까지 식히고, 식힌 배지에 살균제를 섞어서 농도가 3000 µg/mL, 1000 µg/mL, 100 µg/mL, 10 µg/mL, 1 µg/mL, 0.1, 0.01 µg/mL이 되도록 희석하고 페트리접시에 부어 살균제 배지를 만들었다. Cork-borer를 이용하여 배양한 균의 균총 선단부를 직경 5 mm 크기로 잘라 살균제 배지 중앙에 접종하였다. 접종 후 25°C에서 4일간 배양한 뒤 각 균주들의 자라난 균사의 직경을 측정하고, 아래 식 (1)과 같이 균사 생장 억제율을 계산하여 4개 균의 평균을 내었다. 실험은 총 3 반복으로 실시하였으며, 통계분석은 Duncan multiple range test를 이용하였다.
Table 1. Fungicides used in this study
결과 및 고찰
줄기썩음병 발생 및 동정
춘천과 양구 지역의 아스파라거스 재배지를 조사한 결과, 춘천에서는 약 1,000개의 아스파라거스 중 124개의 아스파라거스가(12.4%), 양구군에서는 약 1,000개의 아스파라거스 중 107개의 아스파라거스가 줄기가 썩고 지상부가 노랗게 말라가며 시드는 병징을 보이는 줄기썩음병에 걸려 있음을 확인하였다(Fig. 1). 푸사리움균의 동정 방법은 현미경을 통한 형태 분석, 병원균의 독소 분석, PCR 기법을 활용하여 internal transcribed spacer (ITS)와 EF-1 alpha 를 증폭하여 염기서열을 분석하는 방법 등이 있다(Hong et al., 2010; Singha et al., 2016). 이 중 EF-1 alpha 지역은 Fusarium species를 동정하는데 주로 사용된다. 이 연구에서는 ITS 지역과 EF-1 alpha 지역의 염기서열을 분석하였고, EF-1 alpha 지역의 염기서열을 이용하여 phylogenetic tree를 그렸다(Fig. 2). Phylogenetic tree를 그려서 확인해 본 결과, 춘천에서 분리된 9개의 균주와 양구에서 분리된 5개의 균주가 F. oxysporum과 가장 가까운 유연관계에 있었고, 양구에서 분리된 1개의 균주가 F. proliferatum과 가장 가까운 유연관계에 있음을 확인할 수 있었다(Table 2). 아스파라거스의 줄기썩음병을 일으키는 대표적인 병원균은 F. oxysporum과 F. proliferatum이 알려져 있으며 F. redolens, F. solani도 관여한다고 알려져 있다(Borrego-Benjumea et al.,2014; Damicone et al.,1982; Elmer, 2015). Borrego-Benjumea et al. 2014는 캐나다 Southwestern Ontario 지역의 아스파라거스 필드에서 줄기썩음병을 조사하고 병원균을 분리하였고 분리되는 병원균이 F. oxysporum (65.5%), F. proliferatum (18.3%), F. solani (6.4%), F. acuminatum (6.4%), F. redolens (3.2%)인 것을 확인하였다. 본 연구의 실험결과와, 다른 논문의 실험결과들을 종합하여 볼 때, F. oxysporum이 국내 아스파라거스 줄기썩음병의 주요 원인균 중 하나임을 확인할 수 있었다.
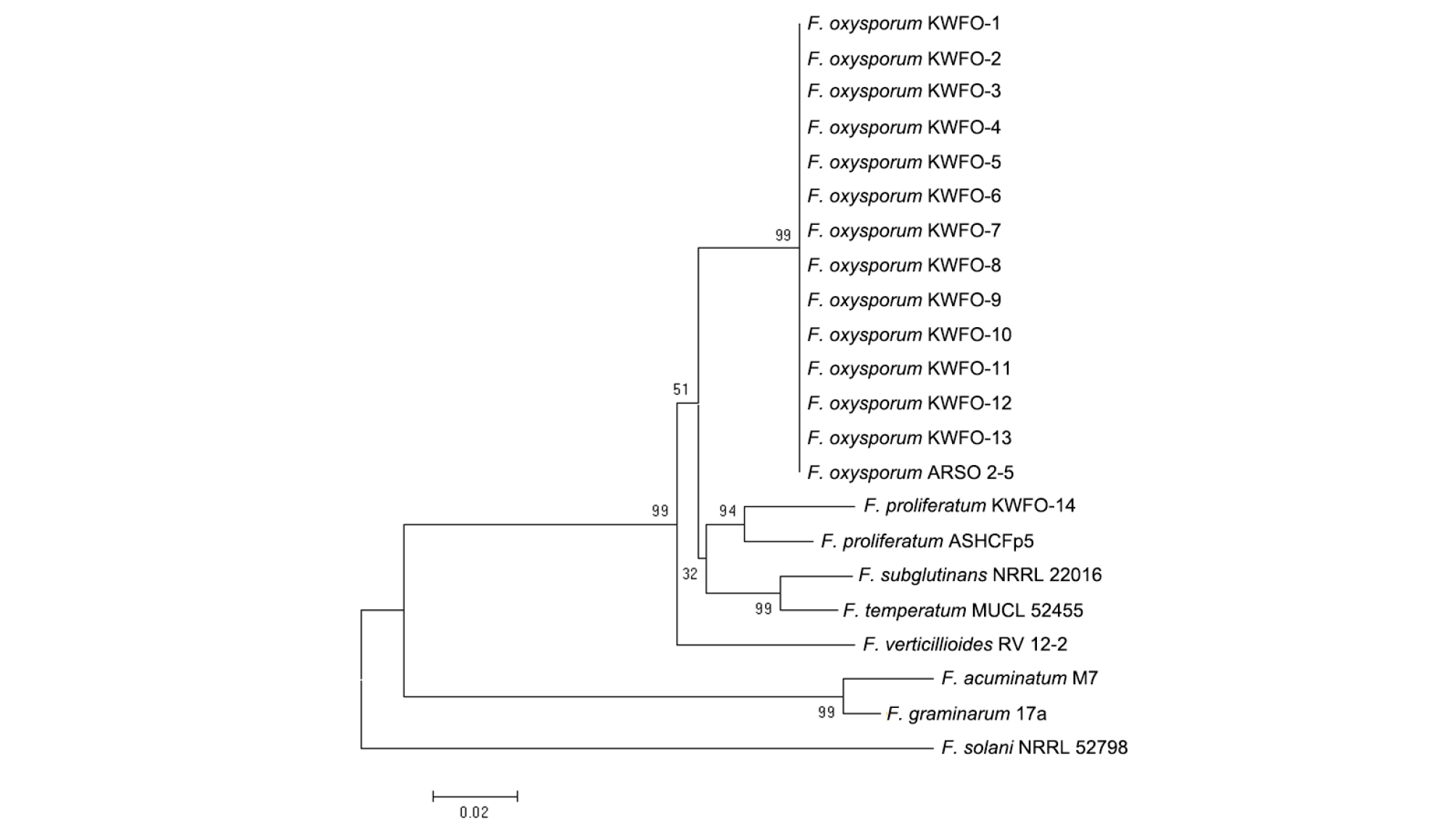
Fig. 2.
Phylogenetic tree generated using the neighbor-joining method based on a comparison of EF-1α sequences from Fusarium isolates used in this study together with the reference sequences of EF-1. The branch lengths are proportional to the number of amino acid substitutions, which are indicated by a scale bar below the tree. The numbers at the nodes are the bootstrap values calculated from 1,000 replicates.
Table 2. Isolated fungal strains from asparagus in Gangwon province in 2018
균사 생장에 대한 살균제
선발한 6개 약제를 이용하여 F. oxysporum KWFO-1, F. oxysporum KWFO-2, F. oxysporum KWFO-10, F. oxysporum KWFO-11 의 균사 생장에 대한 약제 테스트를 수행하였다(Fig. 3). 실험 결과 prochloraz 는 0.01 µg/mL의 농도에서 약 62%의 균사생장 억제율을 보여주었고, 0.1 µg/mL의 농도에서 90% 이상의 균사생장 억제율을 보여, 저농도에서 가장 높은 균사생장 억제율을 보였다(Fig. 4). 1 µg/mL의 농도에서 propiconozle, azoxystrobin, kresoxim-methyl은 균사생장 억제율이 50%가 넘었지만, mancozeb와 thiophanate-methyl은 1 µg/mL에서 각각 8%, 11%의 억제율을 보여주어 상대적으로 효과가 낮았다. 100 µg/mL의 농도에서는 thiophanate-methyl, propiconazole, prochloraz는 균사생장 억제율이 90%를 넘었고, mancozeb, azoxystrobin, kresoxim-methyl은 각각 43%, 68%, 74%의 억제율을 보였다. Azoxystrobin과 kresoxim-methly은 0.1 µg/mL의 농도에서 각각 31%, 37%의 균사생장 억제율을, 1000 µg/mL의 농도에서는 70%, 77%의 억제율을 보여 농도별로 서로 비슷한 효과를 나타내었다.
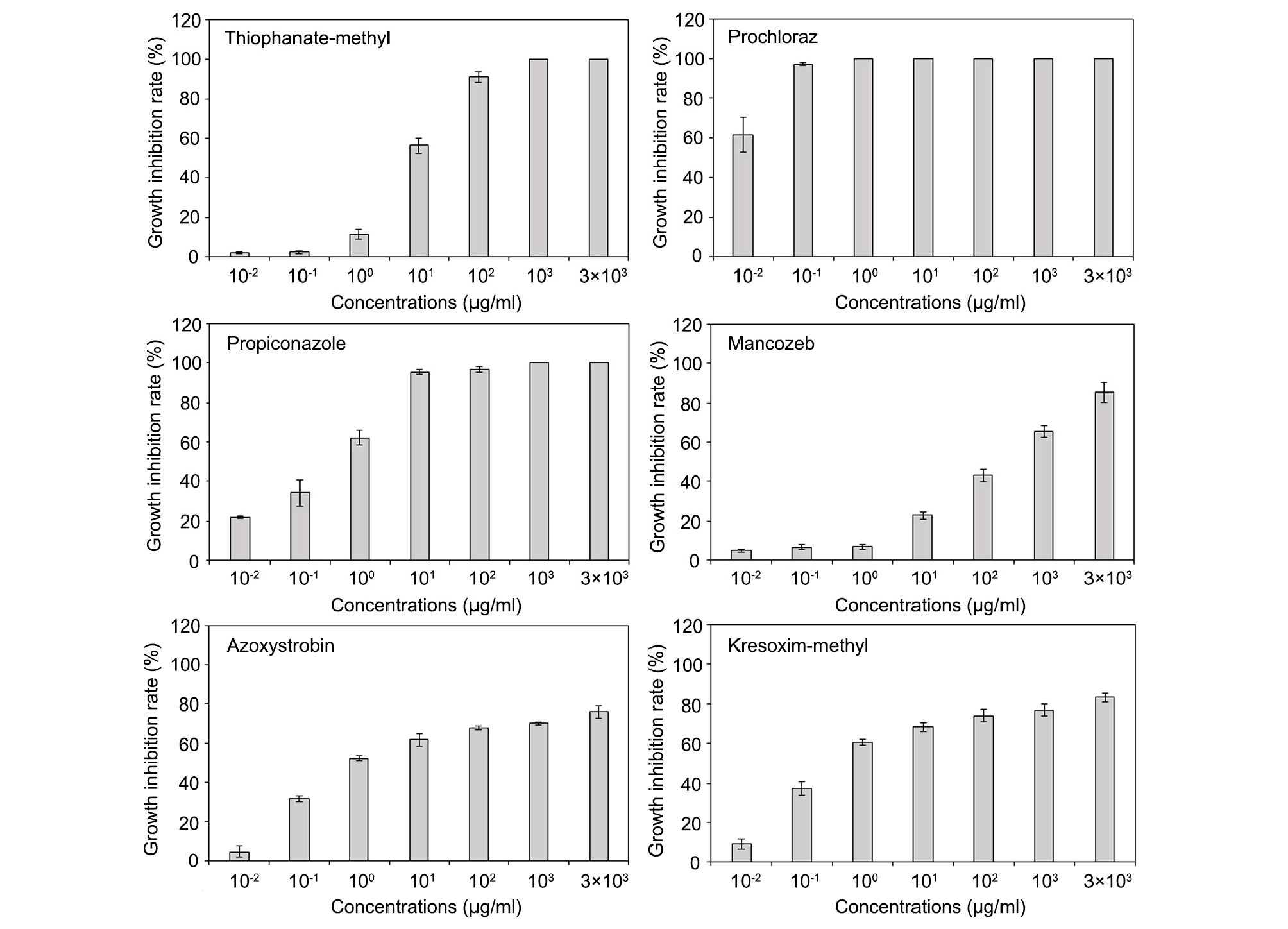
Fig. 4.
Effect of six fungicides on the inhibition of mycelial growth of Fusarium oxysporum. F. oxysporum KWFO-1, KWFO-2, KWFO-10, and KWFO-11 were incubated on fungicide-amended PDA plates. Linear growth of the mycelia was measured, and the inhibition rate was compared with those in the absence of fungicide. This figure shows the average inhibitions rate of four strains.
Prochloraz와 propiconazole은 dimethylation inhibitors (DMIs) 그룹에 속하는 살균제로 곰팡이의 ergosterol 생합성을 억제하여 방제 효과를 갖는 살균제로 알려져 있다(Hagan et al., 1991; Yin et al., 2009;). 여러 연구결과들에서 DMI 살균제들이 Fusarium 균 억제에 효과가 있음이 밝혀져 있는데, prochloraz가 바나나와 토마토에서의 Fusarium 시들음병에 큰 효과가 있음이 보고되었고(Nel et al., 2007; Song et al., 2004), Shin et al. (2014)는 prochloraz가 옥수수에 감염하여 줄기썩음병을 일으키는 F. subglutinans와 F. temperatum 균의 균사생장 억제에 효과가 있음을 보고하였다. 또한 Di Lenna and Foletto (1990)는 prochloraz를 아스파라거스 필드에 처리하였을 때, 아스파라거스 줄기썩음병 억제에 효과가 있음을 보고하였다. 본 실험결과도 사용한 약제 중 prochloraz와 propiconazole이 F. oxysporum KWFO-1의 균사 생장억제에 큰 효과를 보여주었는데, 이러한 결과와 이전 다른 연구결과들을 종합하여 볼 때 아스파라거스 방제에 있어 이 두 종의 살균제가 효과적인 약제라 사료된다. Azoxystrobin과 kresoxim-methyl은 strobilurin 살균제로 미토콘드리아에 작용하여 호흡을 저해하고 ATP 생성을 정지시켜 에너지 결핍을 초래하여 살균를 나타낸다(Ma, 2006). 이 두 살균제 역시 Fusarium 균 방제에 효과가 있음이 보고되고 있는데, Gullino et al. (2002)는 카네이션을 재배할 때 azoxystrobin을 토양관주 하면 Fusarium wilt를 일으키는 F. oxysporum 방제에 효과가 있음을 보고하였다. 이 두 농약은 본 실험에서도 1 µg/mL의 농도에서 F. oxysporum KWFO-1의 균사생장 억제율이 50%가 넘는 등 prochloraz와 propiconazole에 이어 균사생장 억제에 효과가 있음을 확인하였다.
요 약
본 실험을 통해 강원도 지역에서 생육 초기 아스파라거스에 문제시 되고 있는 줄기썩음병이 F. oxysporum에 의해 일어난다는 것을 확인하였다. 국내에 아직 아스파라거스 줄기썩음병을 방제하기 위해 등록된 살균제가 없고, 살균제 약제실험 또한 거의 진행되지 않은 상태이기 때문에, 6가지 살균제를 선발하여 기내에서 균사생장 억제 테스트를 진행하고 효과가 있는 살균제를 확인하였다. 그 결과 실험에 사용한 6가지 약제 중 DMI 살균제인 prochloraz와 propiconazole가 가장 높은 균사생장 억제 효과를 보였으며, strobilurin 살균제인 azoxystrobin과 kresoxim-methyl이 그 다음의 균사생장 억제율을 보여주었다. Mancozeb는 상대적으로 낮은 균사생장 억제율을 보여주었다. 이러한 실험 결과는 국내 아스파라거스 줄기썩음병을 방제하기 위한 기초자료로 사용할 수 있을 것으로 사료된다.