서 론
재료 및 방법
시험 물질 및 제조방법
세포 배양
세포 생존율(cell viability) 측정
Nitric oxide(NO) 생성량 측정
Cytokines(TNF-α, IL-1β, IL-6) 분비량 측정
Phagocytosis 활성 측정
통계처리
결과 및 고찰
세포 생존율(cell viability)에 미치는 영향
Nitric oxide(NO) 생성에 미치는 영향
사이토카인(cytokines) 생성에 미치는 영향
Phagocytosis 활성에 미치는 영향
요약 및 결론
서 론
급격한 환경변화와 무분별한 산업발전을 비롯한 자연적, 인위적 요인으로 인해 미세 및 초미세 먼지 발생이 증가하였고, 이로 인하여 세계적으로 호흡기 관련 면역 질환 환자는 기하급수적으로 늘어나고 있다.
특히 유엔환경계획(United Nations Environment Program, UNEP) 및 세계보건 기구(World Health Organization, WHO)보고에 따르면 대기오염은 뇌졸증, 심장병, 폐암, 급성 호흡기질환(천식 포함)의 직간접적인 원인이 되고 있다. 또한 면역력이 약한 아동 및 고령의 노인들은 더 치명적이며 매년 700만명 이상의 사람이 대기오염에 의해 조기 사망을 초래하였다(UNEP, 2014). 그러나, 현재까지 증가하는 호흡기 관련 질환에 대한 예방과 고효능 치료제는 매우 제한적이다. 이에 최근 연구자들은 호흡기 질환 치료에 있어 발병 후 치료하는 사후적 치료보다는 평상 시 복용을 통해 호흡기의 자가 면역을 강화하여 호흡기 질환의 발생을 억제하고, 부작용이 없으며, 효능이 높은 천연 약용작물을 활용한 연구에 초점을 맞춰 제품 개발에 힘쓰고 있다.
본 연구에 사용된 생약복합추출물(제품명: 청목폐, Cheongmokpye)은 홍삼, 도라지, 더덕 등 20여가지 천연 약용작물 추출물을 배합하여 호흡기(비강, 기관, 기관지, 폐)의 자가면역 강화를 통한 호흡기질환을 예방하기 위한 웰니스(Wellness) 식품으로서 개발되었다. 청목폐의 주요 조성물인 도라지, 더덕, 그리고 홍삼 추출물은 면역 증진과 호흡기 보호능에 대한 많은 보고가 되었으며(Lee et al., 2020; Ryu et al., 2014; Hossen et al., 2016; Shergis et al., 2014), 상엽(Morus alba L.,), 소자(Perilla frutescens (L.) Britt. var. acute (Thunb.) Kudo), 백합(Lonicera japonica Thunberg)등은 호흡기 면역 증강과 기침억제효과가 보고되었다(Jeong et al., 2016; Yin, 2016; Choi, 2014).
호흡기계 면역질환의 대표적인 임상증상으로 급성호흡곤란증후군(Acute respiratory distress syndrome, ARDS), 사이토카인방출증후군(Cytokine release syndrome, CRS), 림프구감소증(Lymphopenia) 등이 있으며, 이들 질환에 가장 밀접하게 관여하는 면역세포로는 점막에 위치한 수지상세포(conventional dendritic cell, cDC)와 폐포대식세포 (alveolar macrophage)가 알려져 있다.
특히, 신체 내 모든 조직에 널리 분포한 대식세포(macrophage)는 탐식작용(phagocytosis)을 통하여 생체 내 병원체 침입과 불필요한 찌거기(debris)를 제거하는 역할을 담당하고(Sun et al., 2020), 사이토카인(cytokine) 및 생리활성물질 생성하여 면역반응을 유도한다(Feghali and Wright, 1997). 대식세포에서 생성하는 대표적 사이토카인과 생리활성물질에는 TNF-α, IL-1β, IL-6, interferon-γ (IFN-γ), NO가 잘 알려져 있으며, 시험 물질의 처리에 의한 사이토카인 및 NO의 변화를 통하여 염증반응 조절 및 면역증강에 대한 효능 검증 연구에 활용되고 있다(Mosser and Edwards, 2008; Shapouri-Moghaddam et al., 2018).
이에 본 연구는 미세먼지, 초미세먼지, 자동차 매연, 스모그 등으로 인한 호흡기에 유해한 환경이 늘어나고 대기오염으로 조기사망자가 급증하는 현실에서 청목폐의 면역 증강 효능을 검증하고, 호흡기 질환의 예방 치료 및 개선 효과를 확인하고자 한다.
재료 및 방법
시험 물질 및 제조방법
주식회사 코리아베스트원이 제조하여 제공한 청목폐 농축액(40 brix 농축액 분말, TC1)와 청목폐 환(환 수용액 분말, TC2)을 시험 물질로 사용하였다.
TC1(생약복합추출물 73 %, 벌꿀 27%)은 배, 도라지, 더덕, 홍삼 등 20여 가지의 약용작물을 24 시간동안 가압, 가열을 통해 추출하고, 여과한 추출액은 벌꿀과 배합하여 40 brix 농축하였다. TC2는 여과된 생약복합추출물(50 %)에 도라지, 더덕, 홍삼, 감초분말(50%)을 배합하여 환으로 제조하였으며, 절삭 및 정제수 첨가 후, 음파 처리하여 액상화 하였다. 액상 상태의 TC1, TC2는 동결건조를 통해 분말 형태로 만들고 정제수에 녹여 실험에 사용하였다.
세포 배양
생쥐에서 유래한 대식세포인 Raw 264.7 세포는 American Type Culture Collection(ATCC)에서 구입하여 사용하였다. Raw 264.7 세포는 Dulbecco’s Modified Eagle’s Medium(DMEM)에 10% fetal bovine serum(FBS, Gibco-BRL), 100 units/mL penicillin과 100 µg/mL streptomycin(Gibco-BRL)을 첨가한 세포 배양액을 사용하여 37℃ 습윤한 CO2 배양기(5% CO2/95% air)에서 배양하였고 세포가 배양 접시의 80% 정도 찼을 때, phosphate buffer saline(PBS, pH 7.4)으로 세포 단층을 씻어낸 후, 세포 배양액을 첨가하여 세포를 떼어내어 계대 배양하며, 배지는 2일마다 교환하였다.
세포 생존율(cell viability) 측정
Raw 264.7 세포의 세포 생존율은 MTT assay 방법으로 측정하였다. Raw 264.7 세포를 1 × 105 cells/well로 24-well plate에 분주하여 24 시간 배양한 후 시험 물질인 TC1, TC2를 다양한 농도(0, 1, 5, 10, 25, 50, 100, 200, 400, 600, 800, 1,000 µg/mL)로 처리한 세포 배양액으로 교환하고, 시험 물질을 처리하여 48 시간 배양한 후 1 mg/mL MTT(Amresco) 용액으로 세포 배양액을 교환하고 2 시간 동안 세포를 추가 배양한 후 살아있는 세포에서 형성된 formazan을 isopropanol로 용출하여 570 nm에서 흡광도를 측정하였다.
Nitric oxide(NO) 생성량 측정
Raw 264.7 세포를 1 × 105 cells/well로 24-well plate에 분주하여 48 시간 배양하고 FBS가 함유되지 않은 무혈청배지(serum-free medium, SFM)으로 교환하여 2시간 동안 혈청기아상태(serum starvation)를 배양한 후, 다양한 농도(0, 1, 10, 100, 400 µg/mL)의 시험 물질 또는 LPS(0.1 µg/mL)를 처리한 무혈청배지로 교환하여 세포를 24 시간 배양한 후, 배양 상등액과 Griess reagent를 동일한 양으로 혼합하여 10 분간 반응시키고 540 nm에서 흡광도를 측정하였다.
Cytokines(TNF-α, IL-1β, IL-6) 분비량 측정
Raw 264.7 세포가 생성 분비한 cytokines를 측정하기 위해 세포를 1 × 105 cells/well로 24-well plate에 분주하여 48 시간 배양한 후 무혈청배지로 교환하여 2 시간 동안 혈청기아상태로 유지한다. 다양한 농도(0, 1, 10, 100, 400 µg/mL)의 시험 물질을 처리한 무혈청배지로 교환하여 24 시간 동안 배양한 후, 세포배양액을 수거하여 5,000 rpm에서 10 분 동안 원심 분리하고 상층액을 취하여 대식세포가 생성 분비한 TNF-α, IL-1β, 및 IL-6 함량을 ELISA kit(R&D Systems)을 사용하여 제조회사가 제시한 방법에 따라 측정하였다.
Phagocytosis 활성 측정
Raw 264.7 세포의 탐식작용은 Phagocytosis assay(zymosan substrate) kit(abcam)을 사용하여 제조회사가 제시한 방법에 따라 측정하였다. Raw 264.7 세포를 96 well에 1 × 105 cells/well로 분주하여 24 시간 배양하고 다양한 농도(0, 1, 10, 100, 400 µg/mL)의 시험 물질을 처리한 무혈청배지로 세포 배양액을 교환하여 24 시간 동안 배양하였다. 이후 phagocytosis Assay kit(Abcam)을 사용하여 제조회사가 제시한 방법에 따라, pre-labeled zymosan 입자를 1 시간 처리하고 substrate를 첨가하여 반응시키고 405 nm에서 흡광도를 측정하였다.
통계처리
모든 분석 수치는 mean ± SEM으로 나타냈으며, 수집된 결과는 GraphPad Prism 7.0(GraphPad software) 프로그램을 이용하여 분석하였다. 시험 물질 투여군과 대조군의 차이를 비교하기 위하여 Student’s t-test 및 one-way analysis variance(ANOVA)를 이용하였고 p < 0.05 이상일 때만 통계적으로 유의성 있는 것으로 판단하였다.
결과 및 고찰
세포 생존율(cell viability)에 미치는 영향
주식회사 코리아베스트원이 제공한 청목폐 농축액(40 brix 농축액 분말, TC1)과 청목폐 환(환 수용액 분말, TC2)을 시험 물질로 사용하여 마우스 대식세포주인 Raw 264.7 세포에서 시험 물질이 세포생존율에 미치는 영향을 조사하기 위해, 시험 물질을 다양한 농도(0, 1, 5, 10, 25, 50, 100, 200, 400, 600, 800, 1,000 µg/mL)로 Raw 264.7 세포에 처리하여 48 시간 배양한 후, MTT assay를 수행하였다. 결과 확인 시, TC1을 고농도(1,000 µg/mL) 처리에도 Raw 264.7 세포의 생존율에는 영향을 나타나지 않았으며(Fig. 1A), TC2의 경우 400 µg/mL 이상의 농도로 처리한 경우 세포 생존율이 대조군(0 µg/mL)에 비해 20% 이상 세포생존율이 유의적으로 감소하였다(Fig. 1B). 위 결과에서 관찰된 TC2처리에 의한 세포생존율의 감소는 400 µg/mL 이하의 농도에서 세포독성 평가기준(정성적 세포 형태학적 변화 및 정량적 평가(세포사멸 30%이하), National Institute of Food and Drug Safety Evaluation (NIFDS), 2020) 미만의 감소이며, 더욱이 세포사멸의 형태학적 특징인 세포질 내 과립 소실과 세포 형태의 변화가 관찰되지 않았다. 이에 TC2(25-200 µg/mL)에서 발견된 세포 생존율의 감소는 시험물질에 의한 세포독성이 아닌 것으로 판단된다.
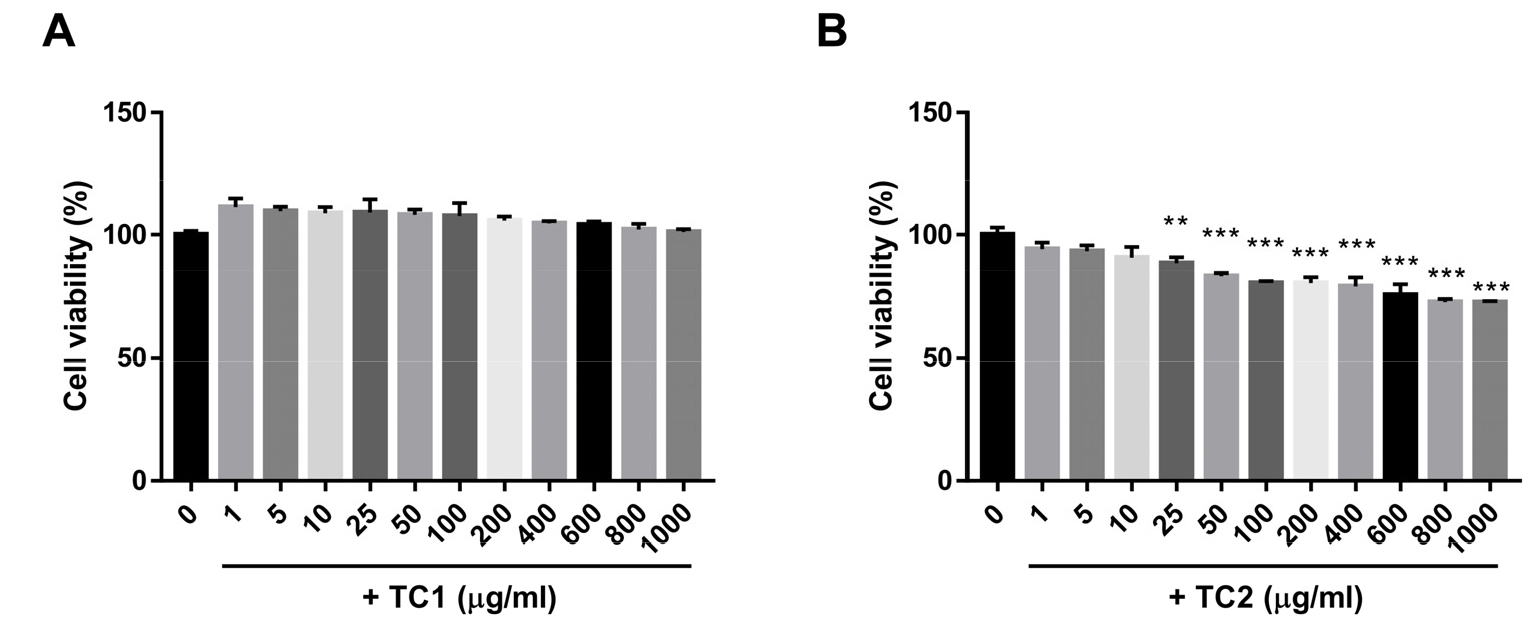
Fig. 1
Effect of Cheongmokpye extract (TC1) and powder (TC2) on cell viability in murine macrophages (RAW 264.7 cells). RAW 264.7 cells were incubated with TC1 and TC2 at the indicated concentrations (1–1000 µg/ml) for 48 h. Cell viability was assessed using the MTT assay. Statistical differences were determined using one-way ANOVA test with Tukey’s post hoc test (n=4, *p < 0.05; **p < 0.01; and ***p < 0.001).
위 결과를 바탕으로 Raw 264.7 세포에서의 TC1과 TC2 처리에 의한 면역 증진 효능 검증을 위한 처리 농도는 0, 1, 10, 100 및 400 µg/mL으로 설정하여 면역증강 효과를 확인하였다.
Nitric oxide(NO) 생성에 미치는 영향
이전 연구를 통해 대식세포는 생체 내 모든 조직에 분포하며 선천적 면역반응을 담당하는 세포로 면역반응 시에는 NO와 다양한 cytokine을 생산하여 감염 초기에 대응하는 생체 방어에 중요한 역할이 보고되었다(Arulselvan et al., 2016; Fujiwara and Kobayashi, 2005). 특히 일반적으로 NO는 혈관의 항상성 유지, 신경전달 등과 같은 생리적으로 중요한 역할을 담당하고 있으며, 과량 생성된 NO는 염증반응을 유도하여 정상세포를 공격하고 세포독성을 갖는 염증 질환의 매개인자로 알려져 있으나, 활성화된 면역세포에서 분비되는 정상적인 NO 생성은 면역신호전달자로서 주변 면역세포를 활성화하여 병원체에 대한 저항성을 증가시킨다(Guzik et al., 2003). 이에 본 연구에서는 Raw 264.7 세포에서 TC1과 TC2 처리에 의한 NO 생성에 미치는 영향을 확인하였다(Fig. 2). 결과 확인 시, TC1을 다양한 농도(1, 10, 100, 400 µg/mL)로 처리한 경우 NO 생성량은 대조군(0 µg/mL) 과 유의적인 차이를 보이지 않았으며 TC2의 처리 또한 Raw 264.7 세포의 NO 생성에 유의적인 영향을 미치지 않음을 확인하였다(Fig. 2A, 2B).
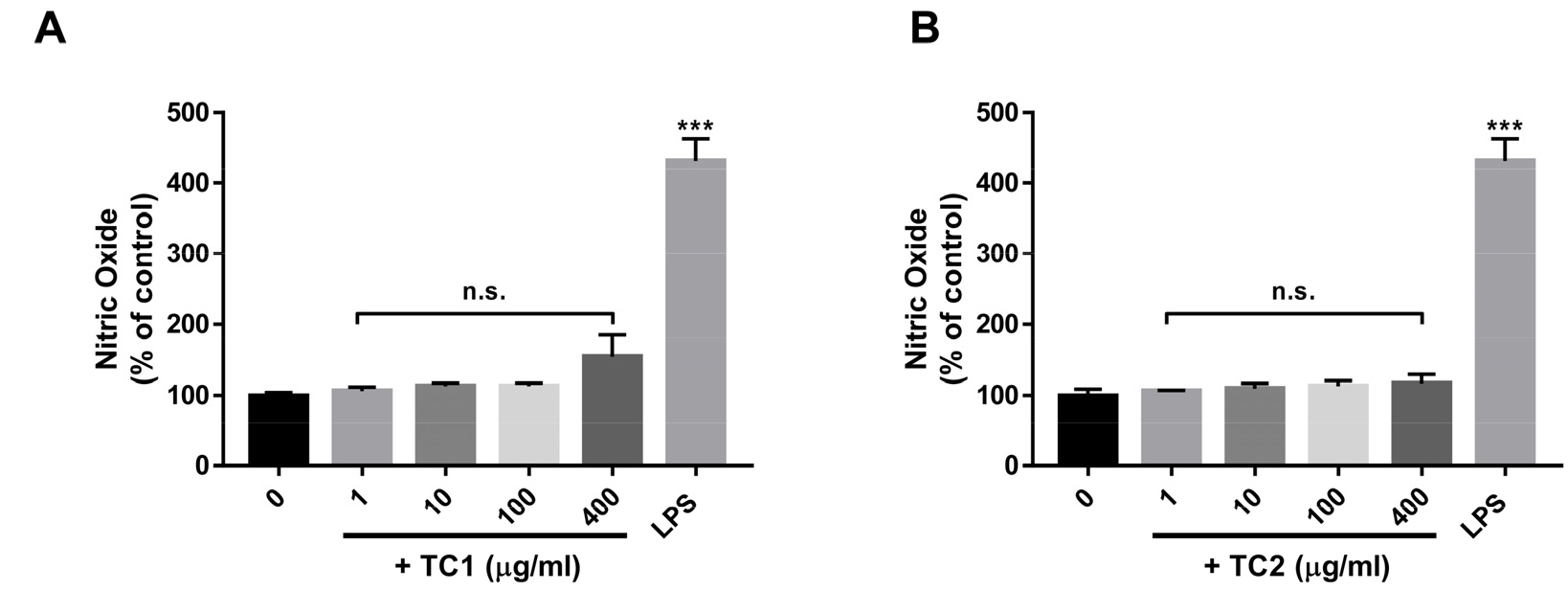
Fig. 2
Effect of Cheongmokpye extract (TC1) and powder (TC2) on nitric oxide (NO) production in RAW 264.7 cells. (A and B) Treatment of TC1 and TC2 at the indicated dose (1–400 µg/ml). After 48 h, the culture medium was collected and assessed for NO production using the Griess reagent. The data shown represent the mean ± SEM. Statistical differences were determined using one-way ANOVA test with Tukey’s post hoc test (n=6, ***p < 0.001; n.s.: not significant).
사이토카인(cytokines) 생성에 미치는 영향
외부의 자극에 의해 활성화된 대식세포는 TNF-α, IL-1β 및 IL-6 등의 여러 사이토카인을 분비하고 생체 내 다양한 면역세포를 활성화하여 적응면역반응을 유도함으로써 염증반응을 활성화시킨다. 또한 정상 범위 내에서의 사이토카인의 생성 증가는 면역 활성이 증진됨을 잘 알려져 있다(Rossol et al., 2011). 이에 TC1, TC2을 처리에 의한 사이토카인의 생성 변화를 확인하고자, Raw 264.7 세포에 다양한 농도(0, 1, 10, 100, 400 µg/mL)의 TC1, TC2을 처리하여 세포를 배양한 후, 수거한 배양액 내의 TNF-α, IL-1β, 및 IL-6의 함량을 측정하였다. 결과 확인 시, Raw 264.7 세포에서 생성 분비된 TNF-α 함량은 TC1을 100, 400 µg/mL로 처리한 경우와 TC2를 10, 100, 400 µg/mL로 처리한 경우 대조군(0 µg/mL) 비해 유의적으로 증가하였다(Fig. 3A, 3D). IL-1β 함량은 TC1와 TC2 처리에 의해 모든 처리농도에서 증가하는 경향을 나타났으며(Fig. 3B, 3E), IL-6 함량은 TC1을 처리 농도가 증가할수록 생성 분비된 유의적으로 증가하였다. 또한 TC2를 1 µg/mL 농도로 처리한 경우, IL-6 함량은 대조군(0 µg/mL)과 유의적인 차이를 나타내지는 않았으나, 10, 100, 및 400 µg/mL 농도로 처리한 경우 대조군(0 µg/mL)에 비해 유의적으로 IL-6 함량이 증가하였다(Fig. 3C, 3F). 위 결과를 통해 대식세포에서 TC1, TC2을 처리에 의해 면역 관련 사이토카인 생성이 증가하였으며, 이 결과는 면역 증진을 유도할 수 있음을 시사한다.
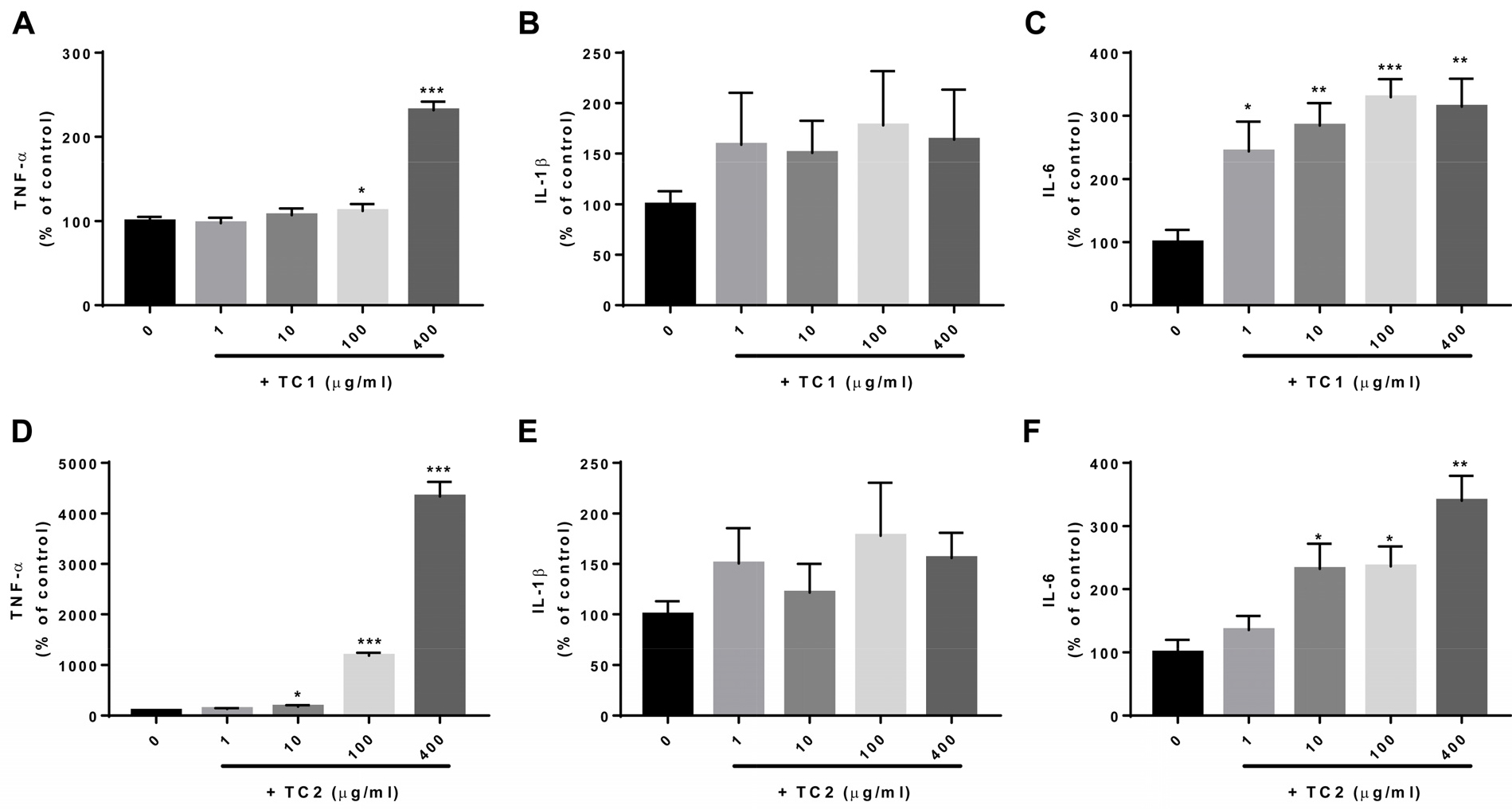
Fig. 3
Effect of Cheongmokpye extract (TC1) and powder (TC2) on tumor necrosis factor (TNF)-α, interleukin (IL)-1β, and IL-6 production in RAW 264.7 cells. Treatment of TC1 and TC2 at the indicated dose (1–400 µg/ml). After 48 h, the culture medium was collected and the levels of TNF-α, IL-1β, and IL-6 production were determined using an ELISA kit. Three independent experiments were performed, and the data shown represent the mean ± SEM. Statistical differences were determined using one-way ANOVA test with Tukey’s post hoc test (n=6, *p < 0.05; **p < 0.01; and ***p < 0.001).
Phagocytosis 활성에 미치는 영향
탐식작용(Phagocytosis)은 선천 면역 방어의 주요 메커니즘 중 하나로써 외부에서 들어온 바이러스나 세균을 면역세포(대식세포, 호중구, 단핵구, 수지상 세포, 호산구)가 섭취하여 이들을 제거하는 작용으로, 항원을 제거하는 면역반응의 한 종류이며, 대식세포는 감염에 대한 면역 반응에서 매우 중요한 역할이 보고되었다(Underhill, 2003; Hirayama et al., 2017). 이에 면역 증진 효능을 보이는 TC1, TC2를 Raw 264.7 세포에 처리하여 phagocytosis 활성 변화를 조사하였다. 결과 확인 시, 대식세포의 탐식 작용을 유도하는 zymosan(Saccharomyces cerevisiae) 처리대조군[(+)/0 µg/mL 군]의 탐식 활성은 zymosan을 처리하지 않은 시험군[(-)/0 µg/mL 군]에 비해 현저히 증가하였고, 이는 대식세포의 탐식작용의 활성화가 관찰되었다. 더욱이 TC1을 다양한 농도로 처리한 경우, 탐식 활성은 zymosan 처리대조군[(+)/0 µg/mL 군]에 비해 증가하였고, 10 µg/mL 농도로 처리한 경우 가장 높은 탐식 활성이 나타났다. 또한 400 µg/mL TC2는 탐식 활성에 유의적인 영향을 미치지 않았으나, 1, 10 및 100 µg/mL 농도로 TC2를 처리하였을 때 탐식 활성은 zymosan 처리대조군[(+)/0 µg/mL 군]에 비해 유의적인 증가가 관찰되었다(Fig. 4A, 4B). 위 결과를 통해 TC1과 TC2에 의한 대식세포의 면역 증진이 유도됨을 확인할 수 있었다.
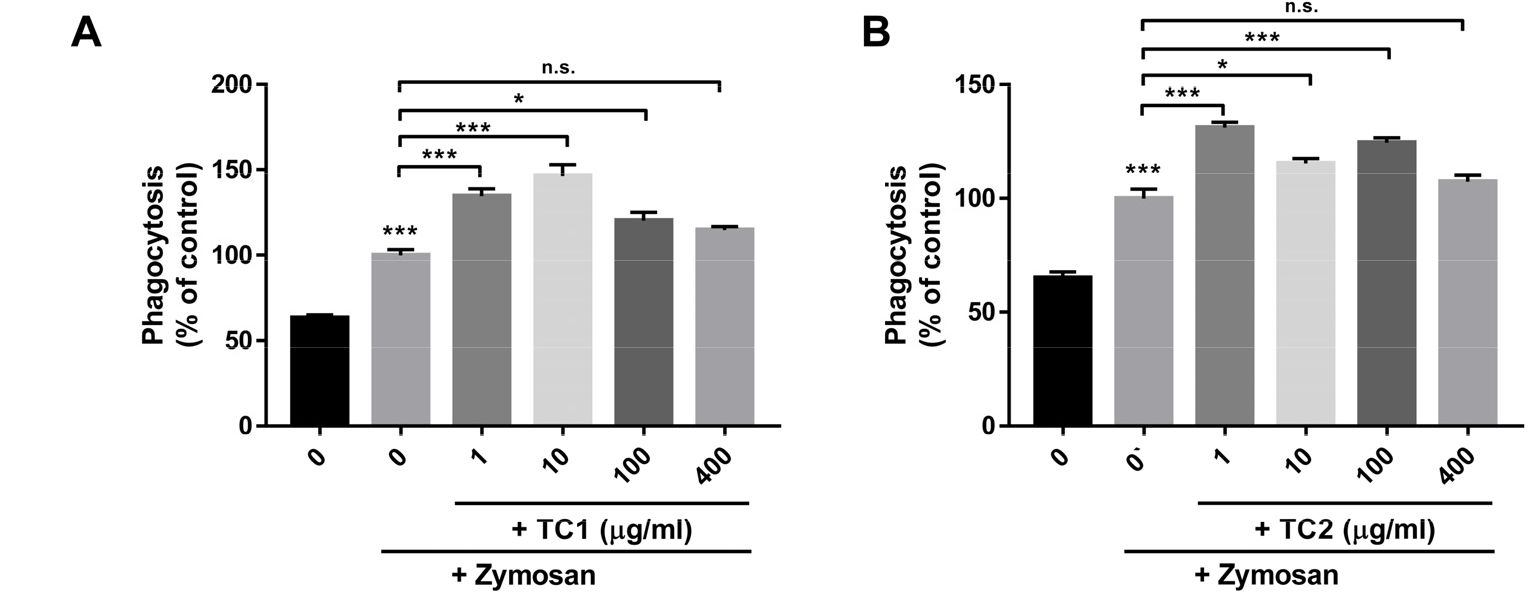
Fig. 4
Effect of Cheongmokpye extract (TC1) and powder (TC2) on phagocytosis in RAW 264.7 cells. Treatment of TC1 and TC2 at the indicated dose (1–400 µg/ml). After 24 h, the cells were incubated with FITC-conjugated zymosan for 1 h at 37 °C. After washing with PBS buffer to remove unbound zymosan, colorimetric analysis was performed using a spectrophotometer. Three independent experiments were performed, and the data shown represent the mean ± SEM. Statistical differences were determined using one-way ANOVA test with Tukey’s post hoc test (n=6, *p < 0.05; ***p < 0.001; and n.s.: not significant).
모든 결과를 종합해 볼 때, 청목폐 추출물 처리에 의한 대식세포주에서의 면역 증진 가능성을 제시하였고, 면역 증진 및 질환치료에 대한 기초자료로서 활용될 것이라 사료된다. 또한, 청목폐 추출물을 활용하여 동물 모델(in vivo model) 및 면역 증진에 대한 특이적 기전을 밝히는 연구를 진행할 예정이다.
요약 및 결론
본 연구는 주식회사 코리아베스트원에서 제조한 청목폐(농축액; TC1, 환; TC2)의 처리에 의한 면역 증진 효능을 확인하기 위하여 마우스 대식세포주인 Raw 264.7 세포를 이용하여 면역증강 효과를 관찰하였다. 먼저 시험 물질(TC1, TC2)이 면역세포 생존에 영향을 미치는지 확인하기 위하여 세포독성(≤20%)이 관찰되지 않은 0, 1, 10, 100 및 400 µg/mL을 처리 농도로 설정하였다. 또한 감염 초기 방어 기전에 중요한 역할을 하는 nitric oxide(NO) 생성에는 시험 물질(TC1, TC2)을 처리에 따른 NO 생성이 대조군과의 차이가 확인되지 않았으나 면역 관련 사이토카인 생성 확인 시, TNF-α, IL-6의 발현은 시험 물질 처리에 의해 농도 의존적으로 유의적인 증가가 관찰되었으며, IL-1β 생성의 경우 TC1와 TC2의 모든 처리 농도에서 증가하는 경향이 나타났다. 더욱이, 시험 물질 처리에 따른 선천적 면역 방어기전의 중요한 기전으로 알려진 탐식작용의 변화 확인 시, TC1을 다양한 농도로 처리한 경우 대조군에 비해 탐식 활성의 증가가 유의적으로 관찰되었으며, TC2는 고농도(400 µg/mL) 처리에 따른 탐식 활성에 유의적인 영향을 미치지 않았으나, 1, 10 및 100 µg/mL 농도로 TC2를 처리한 경우, 대조군에 비해 탐식 활성이 유의적으로 증가하였다. 위 결과를 종합해 볼 때, 청목폐 농축액과 청목폐 환이 면역 증진의 가능성이 있음을 제시할 수 있었으며, 면역 증진에 대한 건강기능식품으로서 활용될 수 있을 것이라 사료된다.


