서 론
김치는 배추나 무 등의 다양한 채소를 주원료로 하여 마늘, 생강, 파, 고춧가루 등의 향신료나 갓 등의 부재료를 첨가하여 일정기간 발효시킨 한국의 발효 식품으로 고유의 맛과 풍미를 가지며(Cho et al., 1998), 중요한 조미식품, 반찬 등으로 이용되어 왔다(Lee and Ahn, 1995). 지역, 주재료, 부재료 및 제조 방법 등에 따라 김치의 종류가 매우 다양하며, 일반적으로 배추 김치, 깍두기, 식해, 동치미 및 절임 등으로 나뉜다(Park et al., 2012). 김치는 10°C 이하의 저온에서 발효하는 과정 중 다양한 유산균이 증식하여 독특한 향과 맛을 형성한다(Kwon and Kim, 2007). 김치의 주요 건강기능성으로 항암(Park, 1995), 항비만(Park et al., 2018), 동맥경화 억제효과(Yun et al., 2014), 항산화(Choi and Hwang, 2000) 등이 있으며, 이는 문헌에 보고된 김치 발효 주요 미생물들의 기능성과 관련이 있다. 김치에서 분리된 미생물들은 Lactobacillus속, Leuconostoc속, Weissella속, Pediococcus 속 등 매우 다양하다(Kim and Lim, 2017; Lee and Lee, 2011; Oh and In, 2008; Shin and Shin, 1995).
유산균은 자연계에 광범위하게 분포하고 전통적으로 다양한 발효식품에 이용되어 왔으며, 인체에 안전하다고 알려진 미생물(GRAS, generally recognized as safe)이다. 소화 흡수를 돕거나 장내부패 억제, 설사 및 변비의 개선, 장내 유해균의 억제, 다양한 비타민의 생성, 혈중 콜레스테롤 저하, 항암, 그리고 인체의 면역력 증강 등의 효능이 꾸준히 보고되고 있다(Kang et al., 2012; Kim and Lee, 2008; Lee and Chang, 2008; Lim et al., 2014). Lee 등(Lee et al., 2008)은 exopolysaccharide(EPS)를 생성하는 Leuconostoc kimchii GJ2 균주를 분리하여 콜레스테롤식이를 급여한 쥐의 총 콜레스테롤 및 LDL-콜레스테롤 함량을 감소시키는 것을 확인하였으며, Park 등(Park and Kim, 2016)은 Bacillus cereus, Staphylococcus aureus 등의 식중독균을 억제하는 Lactobacillus plantarum L2167을 분리한 바 있다. 또한, 항산화 및 항암효과가 우수한 Lb. plantarum pF1 균주가 보고되었다(Min et al., 1992).
프로바이오틱스(probiotics)는 1965년 Stillwell & Lilly에 의해서 처음으로 소개된 용어로 ‘~을 위한’이라는 뜻의 ‘pro’와 생명을 뜻하는 ‘bios’라는 그리스어에서 유래되었다(Lilly and Stillwell, 1965). 2002년 WHO (World Health Organization)와 FAO(Food and Agriculture Organization of United Nations)에서는 프로바이오틱스를 ‘적당량 섭취할 경우 숙주에게 건강상의 유익함을 주는 살아있는 미생물’로 정의 했으며, 현재 이 개념이 세계적으로 가장 널리 통용되고 있다(Marteau et al., 2002). 프로바이오틱스는 인체와 같은 숙주에 도움이 되어야 하고, 장관에서 정상적으로 서식 가능해야 한다. 또한, 섭취 후에 위장과 같은 산성 환경이나 담즙산에 잘 저항하여 장관 안에서 생존 및 대사할 수 있어야 하고, 장관에 부착된 상태를 유지하며, 음식이나 약품제제 안에서 생존이 잘 되어있는 상태로 보관 및 유지될 수 있어야 한다(Kang et al., 2012; Lim et al., 2019).
프로바이오틱스로 사용되는 대표적인 유산균에는 Lb. rhamnosus GG (LGG)가 있으며, 내산성이 높고 장부착능이 우수한 것으로 알려져 있다. 이 균주는 전 세계에서 가장 많이 보고된 프로바이오틱스로 1985년 성인의 분변에서 분리되었으며, 1990년 핀란드에서 처음 제품화 되어 지금까지 많은 제품에 이용되고 있다(Bang et al., 2015). 그 외에 식품의약품안전처에서 허가하여 사용되고 있는 프로바이오틱스에는 Lb. plantarum, Lactococcus lactis, Enterococcus faecium, Bifidobacterium bifidum 등이 있다. 그러나 국내에서 사용되는 유산균은 대부분 수입에 의존하고 있으며, 덴마크, 미국, 프랑스, 독일 등에서 주로 수입하고 있다(Lim et al., 2019).
본 글은 우리나라에서 가장 많이 섭취되는 김치에 대한 연구논문에 보고된 유산균의 프로바이오틱스로서의 기능성을 살펴보고 이용가능성을 알아보고자 한다.
재료 및 방법
김치
김치는 한국의 대표적인 전통 발효식품으로 배추, 무, 오이 등의 채소류를 소금에 절인 후, 마늘, 생강, 파, 고춧가루 등의 부재료를 첨가하여 발효시킨 식품이다(Cho et al., 1998). 주재료에 따른 김치 및 절임류 분류 기준에 의하면 151종 정도로 분류되며, 지역, 주재료, 부재료 및 제조 방법에 따라 김치의 종류가 매우 다양하다(Park et al., 2012). 김치는 단순한 채소 절임이 아닌 절임 후 발효가 진행되는 식품이며(Kim et al., 2020), 10°C 이하의 저온 발효과정을 통해 독특한 향과 맛을 형성한다(Kwon and Kim, 2007). 또한, 열처리를 하지 않아 원재료에 의한 생리활성과 발효 미생물에 의한 건강 기능성을 동시에 가지며, 항암(Park, 1995), 항비만(Park et al., 2018), 동맥경화 억제(Yun et al., 2014), 항산화(Choi and Hwang, 2000) 등 김치의 건강기능성에 대한 연구가 보고되고 있다. Park 등(Park et al., 2018)은 천일염으로 담근 김치의 항비만 효과를 3T3-L1 지방세포를 이용하여 확인 한 바 있으며, Yun 등(Yun et al., 2014)은 김치의 동맥경화 억제 효과를 산화 저밀도지단백이 처리된 THP-1 대식세포를 이용하여 보고한 바 있다.
김치가 건강기능식품으로서 인식되면서 김치 유산균의 분리 및 건강 기능성에 대한 연구결과가 꾸준히 보고되고 있다(Kim et al., 2018). Bong 등(Bong et al., 2013)은 김치로부터 Lb. plantarum KCCM11352P 균주 및 Leu. mesenteroides KCCM11353P 균주를 분리하고 김치 스타터로 사용하여 관능, 항산화 효과, 항암 효과, 항염 효과가 증가된 김치를 제조한 바 있다. 또한, Jang 등(Jang and Kim, 2010)은 김치에서 분리된 유산균들 중에서 이소플라본 배당체 가수분해에 관여하는 β - glucosidase 활성이 우수한 W. cibaria KFRI88010 균주를 선별한 바 있다.
프로바이오틱스
최근 고령 인구의 급속한 증가와 코로나-19와 같은 질병의 노출에 따라 면역에 대한 관심이 증가하면서 프로바이오틱스 시장이 빠르게 증가하고 있다(Jung et al., 2020). 프로바이오틱스는 적당량 섭취할 경우 숙주에게 건강상의 유익함을 주는 살아있는 미생물로(Marteau et al., 2002) 구강을 통해 투여되어 위산과 담즙산 조건에서 생존하여 통과한 후, 장에서 증식하고 정착 할 수 있어야 한다(Kim and Lee, 2008; Lim et al., 2019). 또한, 장내 균총의 안정화, 감염성 질환 또는 유해균 억제활성을 비롯하여 항산화, 항비만, 항암, 항염증, 항당뇨와 같은 기능성을 가지고 있어야 한다(Kerry et al., 2018; Miller et al., 2017; Saarela et al., 2000; Seo et al., 2019).
국내에서는 프로바이오틱스 기능성 원료로 Lb. plantarum, Lac. lactis, Bif. bifidum 등을 포함한 19종의 유산균을 허용하고 있으며, ㈜일동제약의 비오비타, ㈜종근당건강의 락토핏, ㈜쎌바이오텍인터내셔날의 듀오락 등의 제품이 판매되고 있다. 국내 기업에서 다양한 프로바이오틱스 제품을 판매하고 있으나 유산균 종균을 개발하여 제품을 생산하는 곳은 소수이며(Jung et al., 2020), 대부분 유제품으로부터 분리된 동물성 유산균을 수입하여 사용하고 있어(Jung et al., 2020; Lee et al., 2016a; Lim et al., 2019) 보다 다양한 프로바이오틱스 유산균 확보를 통한 제품 차별화가 필요한 실정이다.
김치와 같이 식물을 원료로 한 발효식품으로부터 분리된 유산균은 동물성 유산균과 비교하여 다양한 환경에서의 생존력이 우수하며(Jeong et al., 2012), 다양한 생리활성물질을 생산한다는 연구결과와(Higashikawa et al., 2010; Jeong et al., 2012) 더불어 김치에서 분리된 유산균의 프로바이오틱스 효과에 대한 연구결과가 활발하게 보고되고 있다(Lee et al., 2016a; Lee et al., 2016b; Song et al., 2015). 김치에서 분리된 Lb. plantarum KCCM 11352P(Lee et al., 2016a) 균주는 인공 위액, 인공 담즙 환경에서 LGG균주에 비해 각각 7%, 10% 높은 생존율을 보였으며, 2,2-diphenyl-1 -picryl-hydrazyl-hydrate(DPPH) radical 소거활성은 57.4 ± 4.6%로 LGG 균주에 비해 약 10% 높게 나타났다.
김치 유산균
유산균은 발효유제품의 종균으로 사용되어 왔으며, 국내에서 사용되고 있는 종균의 경우 대부분 프랑스, 미국, 덴마크 등 다양한 국가에서 수입하고 있다(Lim et al., 2019). 국내 유산균의 종균화를 위해서는 기능성이 우수한 유산균의 확보가 우선되어야 하며, 전통 발효식품 중 가장 다양한 유산균을 함유하고 있는 김치가 분리원으로 고려될 수 있다. 김치는 이상발효(hetero-fermentation) 유산균의 번식에 의해 발효가 시작되고, 완숙기에 가장 우수한 성장을 나타낸다(Park, 2017).
김치 발효 중기 이후에는 유산균이 생성한 젖산에 의해 김치의 pH가 저하되고, 산성에 강한 Lactobacillus 속 계열의 미생물들이 빠르게 증식한다(Kang et al., 1995). 김치발효에 관여하는 유산균으로는 Lactobacillus, Pediococcus, Leuconostoc, Weissella 속 등이 알려졌으며(Kim et al., 2020; Lee et al., 2010; Sim and Kim, 2015), 항산화(Kim et al., 2020), 항당뇨(Choi et al., 2020), 항균 효과(Shin and Shin, 1995) 등이 보고되었다. 김치 유산균을 프로바이오틱스로 사용하기 위한 바람직한 특징들을 Table 1에 제시하였다. 김치에서 분리된 Lb.plantarum KC23(Lim et al., 2019) 균주는 LGG 균주와 비교하여 2.23배의 우수한 장내부착능을 나타냈으며, Salmonella Typhimurium과 B. cereus에 대한 항균력이 우수하였다(Lim et al., 2019). 다당류 중 하나인 EPS를 생산하는 것으로 보고된 Leu. kimchii GJ2(Kim and Chang, 2006) 균주는 내산성과 내담즙성이 우수한 것으로 나타났으며, 분변오염의 지표가 되는 E. coli에 대한 항균활성이 확인되었다. 또한, 고콜레스테롤식이를 급여한 흰쥐에 Leu. kimchii GJ2(Lee et al., 2008) 균주를 투여한 경우 혈청 지질 농도를 저하시키고, 간기능을 보호하는 효과가 있는 것으로 나타났다. Lb. plantarum NO1(Lee and Chang, 2008) 균주는 위염, 십이지장 궤양의 원인균으로 알려진 Helicobacter pylori 균주에 대한 탈착 효과가 LGG 균주보다 5% 이상 우수하였다. 이처럼 김치 유산균의 종류와 건강기능성은 매우 다양하며, 프로바이오틱스로서 우수한 특성을 나타내는 균주들이 꾸준히 보고되고 있다.
Table 1.
Characteristics of lactic acid bacteria isolated from kimchi
| Genus | Species | Characteristics | Reference |
| Lactobacillus | plantarum KC23 | antibacterial activity | (Lim et al., 2019) |
| plantarum K6 | antiobesity, antibacterial activity | (Kim and Lim, 2017) | |
| plantarum NO1 | anti-Helicobacter pylory activity | (Lee and Chang, 2008) | |
| plantarum D-9 | antioxidant activity | (Ryu et al., 2020) | |
| plantarum YS712 | antioxidant activity | (Cho et al., 2009) | |
| plantarum GK81 | antioxidant activity | (Lim, 2010) | |
| plantarum pF1 | antioxidant activity | (Lee et al., 2016b) | |
| plantarum K8 | anti atopic dermatitis | (Lee et al., 2008) | |
| plantarum CJLP55 | skin pH improvement | (Han et al., 2019) | |
| plantarum pnuK | anticancer activity | (Bong et al., 2013) | |
| paracasei DKGF1 | antioxidant activity | (Kim et al., 2020) | |
| brevis WK12 | antibacterial activity | (Choi et al., 2014a) | |
| brevis BK11 | anti-Helicobacter pylory activity | (Lim et al., 2014) | |
| lactis WK11 | antibacterial activity | (Choi et al., 2014a) | |
| sakei HJ5 | antibacterial activity | (Park, 2017) | |
| sakei subsp. ALI033 | antifungal activity | (Choi et al., 2013) | |
| Leuconostoc | mesenteroides PH1 | antibacterial activity | (Park, 2017) |
| mesenteroides KFRI73007 | β-glucosidase activity | (Kim et al., 2019) | |
| kimchii GJ2 | antiobesity | (Kim and Chang, 2006; Lee et al., 2008) | |
| Weissella | koreensis HO20 | antifungal activity | (Choi et al., 2013) |
| koreensis OK1-6 | antiobesity | (Moon et al., 2012) | |
| kimchi HO22 | antifungal activity | (Choi et al., 2013) | |
| confuse KK0655 | antibacterial activity | (Lee and Lee, 2011) | |
| cibaria KFRI88010 | β-glucosidase activity | (Jang and Kim, 2010) | |
| parameseneroides KK0717 | antibacterial activity | (Lee and Lee, 2011) | |
| Pediococcus | halophilus No.2 | α-glucosidase activity | (Min et al., 1992) |
| acidilactici D-10 | antioxidant activity | (Kim et al., 2020) |
결과 및 고찰
내산성 및 내담즙성
프로바이오틱스 유산균은 체내에서 유익한 기능성을 갖기 위하여 위산과 담즙산에 살아 남아 소장까지 도달하여야 한다(Kang et al., 2012). 김치에서 분리된 유산균의 내산성과 내담즙성에 대해 조사한 결과(Table 2), Lb. plantarum NO1 균주(Lee and Chang, 2008)는 pH 3.0 에서 99.0%, Lb. plantarum KCTC10782BP 균주(Lee et al., 2016b)는 pH 2.5 에서 93.4%으로 높은 생존율을 나타냈다. 또한, 김치에서 분리된 Lb. brevis 균주와 Lb. arizonensis BCNU9032 균주(Choi et al., 2014b)는 99.7% 이상의 높은 생존율을 나타내어 위산의 영향을 크게 받지 않는 것으로 확인되었다. 담즙산 환경에서 Lb. plantarum KC23(Lim et al., 2019), Lb. plantarum pF1(Lee et al., 2016b), Lb. brevis BCNU9037(Choi et al., 2014b), Lb. brevis BCNU9098(Choi et al., 2014b), Lb. brevis BCNU9101(Choi et al., 2014b) 및 Lb. arizonensis BCNU9032 균주(Choi et al., 2014b)는 100.0% 이상의 생존율을 나타냈으며, Lb. plantarum KC23 균주(Lim et al., 2019)는 156.3%의 생존율을 나타내어 0.3%의 담즙산 환경에서도 영향을 받지 않고 증식 가능한 것으로 예상된다. Lee 등(Lee et al., 2016a)의 연구에서 된장에서 분리된 Lac. lactis KFCC 균주는 pH 2.5에서 36.1%의 생존율을, 0.3%의 담즙산 환경에서는 72.0%의 생존율을 나타낸 것으로 미루어보아, 김치에서 분리된 유산균은 내산성 및 내담즙성이 우수하여, 체내에서 생존하여 소장에 도달할 수 있을 것으로 기대된다.
Table 2.
Acid and bile tolerance of lactic acid bacteria isolated from kimchi
| Strain | Survival rate (%) | Reference | |
| Acid | 0.3% Bile acid | ||
| Lb. plantarum KC23 | 90.9 (pH 3.0, 3 hr)1) | 156.3 (6 hr)2) | (Lim et al., 2019) |
| Lb. plantarum NO1 | 99.0 (pH 3.0, 2 hr) | 97.0 (2 hr) | (Lee and Chang, 2008) |
| Lb. plantarum pF1 | 86.0 (pH 2.5, 2 hr) | 100.7 (6 hr) | (Lee et al., 2016b) |
| Lb. plantarum KCCM11352P | 88.5 (pH 2.5, 2 hr) | 98.0 (6 hr) | (Lee et al., 2016b) |
| Lb. plantarum KCTC10782BP | 93.4 (pH 2.5, 2 hr) | 98.0 (6 hr) | (Lee et al., 2016b) |
| Lb. brevis BCNU9037 | 99.9 (pH 2.5, 3 hr) | 100.0 (24 hr) | (Choi et al., 2014b) |
| Lb. brevis BCNU9098 | 99.7 (pH 2.5, 3 hr) | 102.3 (24 hr) | (Choi et al., 2014b) |
| Lb. brevis BCNU9101 | 100.5 (pH 2.5, 3 hr) | 102.8 (24 hr) | (Choi et al., 2014b) |
| Lb. arizonensis BCNU9032 | 100.1 (pH 2.5, 3 hr) | 100.0 (24 hr) | (Choi et al., 2014b) |
장부착능
유산균이 프로바이오틱스로서 사용되기 위해서는 최종 목적 부위인 장에 도달한 후, 장내 상피세포에 부착해야 한다(Lim et al., 2019). 부착된 유산균은 집락을 형성한 후, 다양한 물질을 분비함으로써 항균, 항산화 및 항비만과 같은 효과를 나타내는 것으로 알려져 있다(Ouwehand et al., 1999). 인체의 소장 상피세포와 유사한 Caco-2, HT-29 세포를 이용하여 김치에서 유래된 유산균의 장부착능을 제시하였다(Table 3). 김치에서 분리된 Lb. plantarum KC23 균주(Lim et al., 2019)의 장부착능은 83.5%으로 대표적인 프로바이오틱스 균주인 Lb. rhamnosus GG 균주(Lim et al., 2019)와 비교하여 약 2.2배 높은 장부착능을 나타냈다. 또한, Lb. plantarum pF1(Lee et al., 2016b) 및 Lb. plantarum KCTC3099 균주(Lee et al., 2016b)는 각각 83.7 ± 0.1%, 83.8 ± 0.1%으로 된장에서 분리된 Lac. lactis KFCC11510P 균주(Lee et al., 2016b)와 미미한 차이를 나타냈다. 장내에 부착된 유산균이 부착되지 못한 유산균보다 건강기능 효과가 우수한 것으로 보고되고 있어(Ouwehand et al., 1999) 장부착능이 우수한 김치 유산균이 다른 유산균에 비하여 장내 집락을 형성하고 프로바이오틱스 기능을 발휘할 가능성이 큰 것으로 사료된다.
Table 3.
Adhesion ability of lactic acid bacteria isolated from kimchi
| Human colon adenocarcinoma cell | Strain | Source | Adhesion capability (%)1) | Reference |
| Caco-2 | Lb. rhamnosus GG | Human gut | 37.4 | (Lim et al., 2019) |
| Lb. plantarum KC23 | Kimchi | 83.5 | (Lim et al., 2019) | |
| HT-29 | Lb. plantarum pF1 | Kimchi | 83.7 ± 0.1 | (Lee et al., 2016b) |
| Lb. plantarum KCCM11352P | Kimchi | 83.4 ± 0.3 | (Lee et al., 2016b) | |
| Lb. plantarum KCTC3099 | Kimchi | 83.8 ± 0.1 | (Lee et al., 2016b) | |
| Lb. plantarum KCTC10782BP | Kimchi | 82.2 ± 0.2 | (Lee et al., 2016b) |
항균활성
유산균은 유기산 및 박테리오신을 비롯한 다양한 유해균 성장 억제물질을 생성하여 식중독균, 오염균 등의 생육을 억제하는 것으로 알려져 있다(Park, 2017). 충치 유발균인 Streptococcus mutans와 Porphyromonas gingivalis에 대한 항균활성이 우수한 유산균(Kang et al., 2018), 위염의 원인균인 H. pylori 억제능이 우수한 유산균 등이 보고된 바 있다(Lee and Chang, 2008). 특히, 김치로부터 분리된 유산균의 다양한 항균활성에 대해 꾸준히 보고되고 있다(Table 4, Fig. 1). 분변오염의 지표가 되는 E. coli의 생육은 조사된 모든 김치 유산균에 의해 억제되었으며(Lee and Chang, 2008; Lim et al., 2019; Park, 2017; Shin et al., 2012), 패혈증의 원인이 되는 Pseudomonas aeruginosa는 Lb. plantarum KC23(Lim et al., 2019) 균주와 Pediococcus pentosaceus BCNU9070 균주(Shin et al., 2012)를 제외한 대부분의 김치 유산균에 의해 억제되었다. 김치에서 분리된 Leu. mesenteroides PH2, Lb. sakei HJ5, Lb. sakei HJC 균주는 식중독균인 Salmonella Typhimurium, Sta. aureus, Listeria monocytogenes를 모두 억제하여 넓은 범위의 항균활성을 나타냈다(Park, 2017). 또한, Lb. plantarum NTU 균주(Lin and Pan, 2019)는 폐렴균인 Klebsiella pneumoniae subsp. pneumoniae, 칸디다증의 원인균인 Candida albicans, 식중독균인 Cronobacter sakazakii 및 Vibrio parahaemolyticus의 생육을 억제하였으며, Lb. pentosus A67 및 Lb. plantarum C2 균주(Chu and Kook, 2019)는 S. enterica subsp. enterica, B. cereus 및 B. subtilis subsp. spizizenii 을 억제하여 다양한 항균활성을 나타냈다. 따라서, 김치에서 분리되는 유산균은 프로바이오틱스로서 유해균을 억제하고 장내균총을 개선하는 효과를 나타낼 것으로 기대된다.
Table 4.
Antimicrobial activity of lactic acid bacteria isolated from kimchi
| Target strain | Lactic acid bacteria | ||||||
| L. plantarum NO1. | L. plantarum KC23 | Leu. mesenteroides PH1 | Leu. mesenteroides PH2 | L. sake i HJ5 | L. sakei HJC | Ped. pentosaceus BCNU9070 | |
| Salmonella Typhimurium | N.D1) | +2) | + | + | + | + | + |
| Streptococcus mutans | + | N.D. | + | + | + | + | N.D. |
| Sta. aureus | ‒3) | + | ‒ | + | + | + | + |
| Lis. monocytogenes | ‒ | + | + | + | + | + | + |
| P. aeruginosa | + | N.D. | + | + | + | + | N.D. |
| E. coli | + | + | + | + | + | + | + |
| Reference | (Lee and Chang, 2008) | (Lim et al., 2019) | (Park, 2017) | (Park, 2017) | (Park, 2017) | (Park, 2017) | (Shin et al., 2012) |
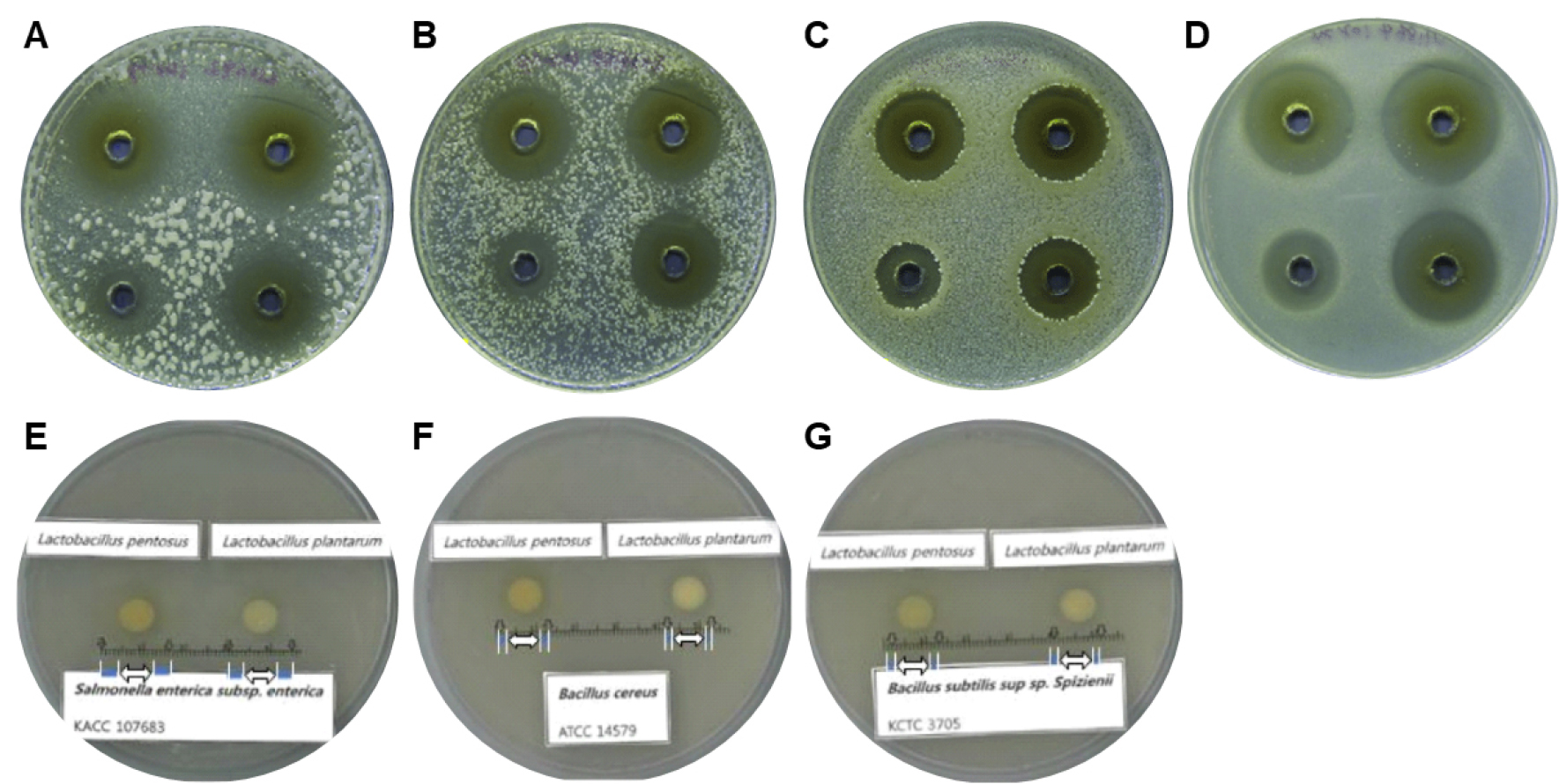
Fig. 1.
Antibacterial activity of Lactobacillus plantarum NTU (Lin and Pan, 2019), Lb. pentosus A67 (Chu and Kook, 2019), and Lb. plantarum C2 (Chu and Kook, 2019) against Klebsiella pneumoniae subsp. pneumoniae BCRC 10692 (A), Cronobacter sakazakii BCRC 13988 (B), Candida albicans BCRC 20511 (C), Vibrio parahaemolyticus BCRC 12864 (D), Salmonella enterica subsp. enterica KACC 10763 (E), Bacillus cereus ATCC 14579 (F), and B. subtilis subsp. spizizenii KCTC 3705 (G).
항산화 효과
생체 내에서 에너지 생산을 위한 호흡 과정 중 산화 작용이 일어나며, 이 과정에서 free radical, 과산화수소, 일중항산소 및 오존 등의 활성산소(reactive oxygen species, ROS)가 생성된다(Lim, 2010). 이러한 독성 생성물들은 생체대사에 관여하는 단백질 등과 반응하여 세포를 손상시키고(Shin, 1997), 암, 간경변, 관절염 등의 각종 질병을 유발하기도 한다(Kim et al., 2020). 유산균은 활성산소로부터 스스로를 보호할 수 있는 항산화 활성을 가지며, 김치 유산균에서도 이러한 활성이 보고되었다.
김치에서 분리된 유산균의 DPPH radical 소거활성을 비교한 결과(Table 5), Lb. plantarum GK81 균주(Lim, 2010)와 Lb. plantarum pF1 균주(Lee et al., 2016b)는 70.8 ± 10.1%, 69.7 ± 3.6%의 활성을 나타냈다. Lb. paracasei DKGF1(Kim et al., 2020)은 53.3 ± 7.0%으로 상대적으로 낮은 활성을 나타냈다. 김치 유산균은 양성 대조구인 butylated hydroxyanisole(BHA, 89.1 ± 2.9%)(Lim, 2010) 및 vitamin C(95.5 ± 0.5%)(Marteau et al., 2002)와 비교하여 낮은 DPPH radical 소거활성을 가지는 것으로 확인되었으나, 된장에서 분리된 Lac. lactis KFCC11510P(43.8 ± 1.1%)(Lee et al., 2016b) 균주와 상용되고 있는 Lb. acidophilus LA-5(50.0 ± 5.0%)(Kim et al., 2020) 균주보다는 높은 활성을 나타내어 항산화 효과가 우수한 것으로 보고되었다.
Table 5.
2,2-Diphenyl-1-picrylhydrazyl (DPPH) radical-scavenging activity of lactic acid bacteria isolated from kimchi
| DPPH radical scavenging activity (%)1) | Reference | |
| Butylated hydroxyanisole | 89.1 ± 2.9 | (Lim, 2010) |
| Vitamin C | 95.5 ± 0.5 | (Lim, 2010) |
| Lb. plantarum GK81 | 70.8 ± 10.1 | (Lim, 2010) |
| Lb. plantarum pF1 | 69.7 ± 3.6 | (Lee et al., 2016b) |
| Lb. plantarum KCCM11352P | 62.8 ± 2.8 | (Lee et al., 2016b) |
| Lb. plantarum KCTC10782BP | 58.7 ± 1.2 | (Lee et al., 2016b) |
| Lb. plantarum KCTC3099 | 56.9 ± 1.6 | (Lee et al., 2016b) |
| Lb. paracasei DKGF1 | 53.3 ± 7.0 | (Kim et al., 2020) |
항비만 효과
비만은 당뇨병, 관상동맥질환, 고혈압 등 다양한 만성 질환의 원인으로 알려져 있으며, 비만인구가 지속적으로 증가함에 따라 만성질환에 노출된 인구도 점차 증가하고 있다(Kahan and Manson, 2019). 비만은 지방 분화에 따른 지방세포의 지방 축적과 지방세포의 수가 증가함에 따라 나타나며(Meln et al., 2019), 비만을 치료하고 예방하기 위한 다양한 연구들이 보고되고 있다(Kim and Lim, 2017). 유산균은 지방세포의 수를 조절하고 지방 분화를 억제하여(Kim and Lim, 2017) 체지방 감소 및 비만억제 효과가 있는 것으로 보고되고 있다.
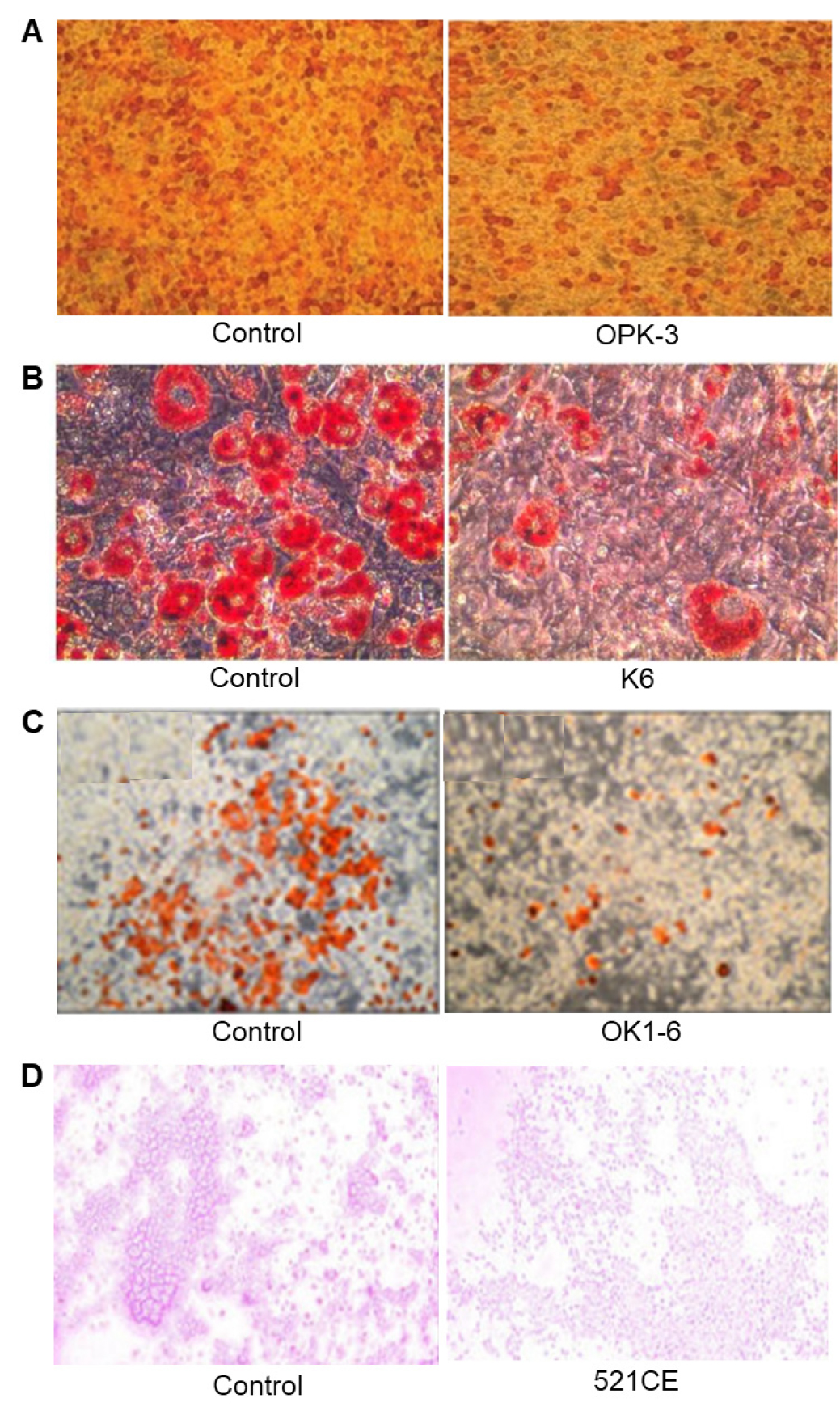
문헌에 보고된 김치 유산균에 의한 지방 분화 억제능을 정리하였다(Table 6, Fig. 2). 김치에서 분리된 Lb. brevis OPK-3(Park et al., 2013) 균주를 처리한 경우 상대적 지질 축적량은 50.0%으로 가장 높은 지방 분화 억제능을 나타냈다. Lb. sakei YRM13 균주(Won et al., 2020)와 Lb. sakei ADM14 균주(Won et al., 2020)는 대조구에 비해 59.9% 와 56.9%의 상대적 지방 축적량을, W. koreensis OK1-6 균주(Moon et al., 2012)는 70.9%의 상대적 지방 축적량을, Lb. plantarum K6(Kim and Lim, 2017), W. koreensis 521CE(Pi et al., 2014), Lb. fermentum SMFM2017-NK4(Kim et al., 2021) 및 Lb. fermentum et al., 2021) 균주는 80% 이하의 상대적 지방 축적량을 나타냈다.
Table 6.
Inhibitory effects of lactic acid bacteria isolated from kimchi on lipid accumulation in 3T3L-1 adipocytes
| Strain | Relative lipid accumulation (%)1) | Reference |
| Lb. brevis OPK-3 | 50.0 | (Park et al., 2013) |
| Lb. sakei YRM13 | 59.9 | (Won et al., 2020) |
| Lb. sakei ADM14 | 56.9 | (Won et al., 2020) |
| W. koreensis OK1-6 | 70.9 | (Moon et al., 2012) |
| Lb. plantarum K6 | 74.0 | (Kim and Lim, 2017) |
| W. koreensis 521CE | 76.7 | (Pi et al., 2014) |
| Lb. fermentum SMFM2017-NK4 | 78.6 | (Kim et al., 2021) |
| Lb. fermentum SMFM2017-GK1 | 79.6 | (Kim et al., 2021) |