서 론
연구설계 및 방법
토양으로부터 항진균 활성 Trichoderma sp. 분리 및 배양
대치배양을 통한 식물병원균 2종의 항진균 활성평가
Trichoderma sp. 생성 VOCs(Volatile Organic Compounds)의 항진균 효과 검정
토양으로부터 분리된 Trichoderma sp. KNU1의 생물학적 동정
분석방법(통계분석)
결과 및 고찰
대치배양을 통한 식물병원균 항진균 활성 결과
Trichoderma sp. KNU1 생성 VOCs 항진균 활성 결과
Trichoderma sp. KNU1의 생물학적 동정결과
서 론
최근 기후변화로 인해 전국적 집중호우로 인한 강수량증가로 병원균 발생률이 증가하여 병해충방제에 많은 어려움을 겪고 있다. 또한, 겨울철의 고온현상으로 인해 식물병원균 및 해충의 월동 생존률과 피해기간이 증가함으로 인한 신종 병해충 확산 등으로 농가들이 막대한 피해가 증가하고 있는 추세이다(Kang et al., 2013). 잿빛곰팡이병을 유발하는 Botrytis cinerea는 전세계적으로 분포하며 주로 잎, 줄기, 과실 등 지상부에 발생하고, 증상으로는 부패 또는 말라 괴사하게 만드는 식물병원균이며, 많은 농작물에 발생하고 생육시기, 저장, 수송 중 과일류와 채소류에 발병한다고 보고되었다(Kwon et al., 2004). 딸기에서는 과실과 꽃받침에 발생하는 잿빛곰팡이병(Botryti cinerea)은 혹한기 기간인 12월부터 2월까지 최대 50%정도 발병하며, 심한 경우 한 화방을 제거해야 하는 피해가 있다(Nam et al., 2011). 균핵병(Sclerotinia sclerotiorum)은 우리나라에서 채소, 과수, 수목, 목초류 등 약 54종의 작물에서 발생하는 것으로 알려져 있으며, 증상으로는 잎과 줄기부분에 부패와 병반 부위의 흰색반점이 발생하는 것으로 나타났다(Kwon, 2006). 포도에서는 나무의 신초 부분에 주로 발병하며 가지에 병반이 생기고 표피가 부서지는 현상이 나타난다. 또한, 병반부에 흰색의 균사가 발생한 후 균핵을 형성하는 특징을 가지고 있다(Park et al., 2009). 이어 식물병원균의 방제를 위해 수확기까지 10회 이상의 화학방제를 살포하고 있는 것이 농가의 현실이며, 화학농약이 생태계에 미치는 영향과 식재료의 잔류할 수 있는 유해성 등의 문제가 있다(Kang et al., 2015). 농약은 먹거리의 안정적인 생산을 위해 불가피하게 사용되는 물질이지만 안전한 농약사용을 위해 안전사용기준과 농약잔류허용기준(Maximum Residue Limt, MRL)을 설정하여 관리하고 있다(Park et al., 2017). 농약잔류허용기준을 초과하게 된 농산물은 전량 회수 및 폐기처리가 되고, 이로 인한 농산물의 생산비, 유통비, 처리비용은 농가들에게 막대한 손실을 입히게 되며, 분석결과 부적합 판정이 되더라도 유통이 될 위험이 있다(Na et al., 2013). 이러한 문제를 해결하기 위해 다양한 연구가 시도되고 있으며, 식물병원균을 친환경적인 방법으로 방제하기 위한 진균, 세균 등을 활용한 생물학적 방제에 관한 연구가 활발히 이루어지고 있다(Lee et al., 2017). Trichoderma 속은 식물뿌리서 발견되는 토양 곰팡이속에 속하며, 비 병원성균으로 균사체에 기생하여 식물의 체내 방어 기작을 활성화하는 것으로 알려져 있다. 또한, 식물 병원균에 대한 저항성을 증가시키고 식물병원균의 세포벽분해 효소를 분해한다는 보고가 있다(Park et al., 2019). 본 연구의 목적은 식물병원균에 대하여 항진균 활성을 갖는 Trichoderma sp.를 분리·동정하여 항진균 효과를 평가하는데 있다.
연구설계 및 방법
토양으로부터 항진균 활성 Trichoderma sp. 분리 및 배양
토양으로부터 항진균 활성을 갖는 Trichoderma sp.를 순수 분리하기 위해 선택배지로 TSM(Trichoderma selective media)와 RBA(Rose Bengal Agar)배지(BD Difco, USA)를 사용하였으며, 조성은 다음과 같다(Table 1). 제조된 배지에 토양 1 g과 증류수 9 mL을 넣어 30분간 150 rpm으로 진탕배양기(Jeio Tech(SI-600R), Korea)로 교반하여 토양용액을 제조하였고, 희석평판법을 통해 희석배수에 맞춰 평판배지에 접종 후 25°C 조건으로 인큐베이터(Sanyo(MIR-553), Japan)에서 배양하였다(Kim et al., 2009). TSM과 RBA배지에 들어가는 Chloramphenicol 또는 Chlortetracycline은 박테리아의 성장을 억제하여 곰팡이와 효모를 분리하는데 적합한 배지로 알려져 있다(Shah and Afiya, 2009). 배양된 Trichoderma sp. 중 1종을 최종적으로 순수 분리하였고, Trichoderma sp. KNU1이라 명명한 후 본 연구에 사용하였다.
Table 1.
Composition of the medium (Trichoderma selective medium [TSM], Rose bengal agar [RBA])
대치배양을 통한 식물병원균 2종의 항진균 활성평가
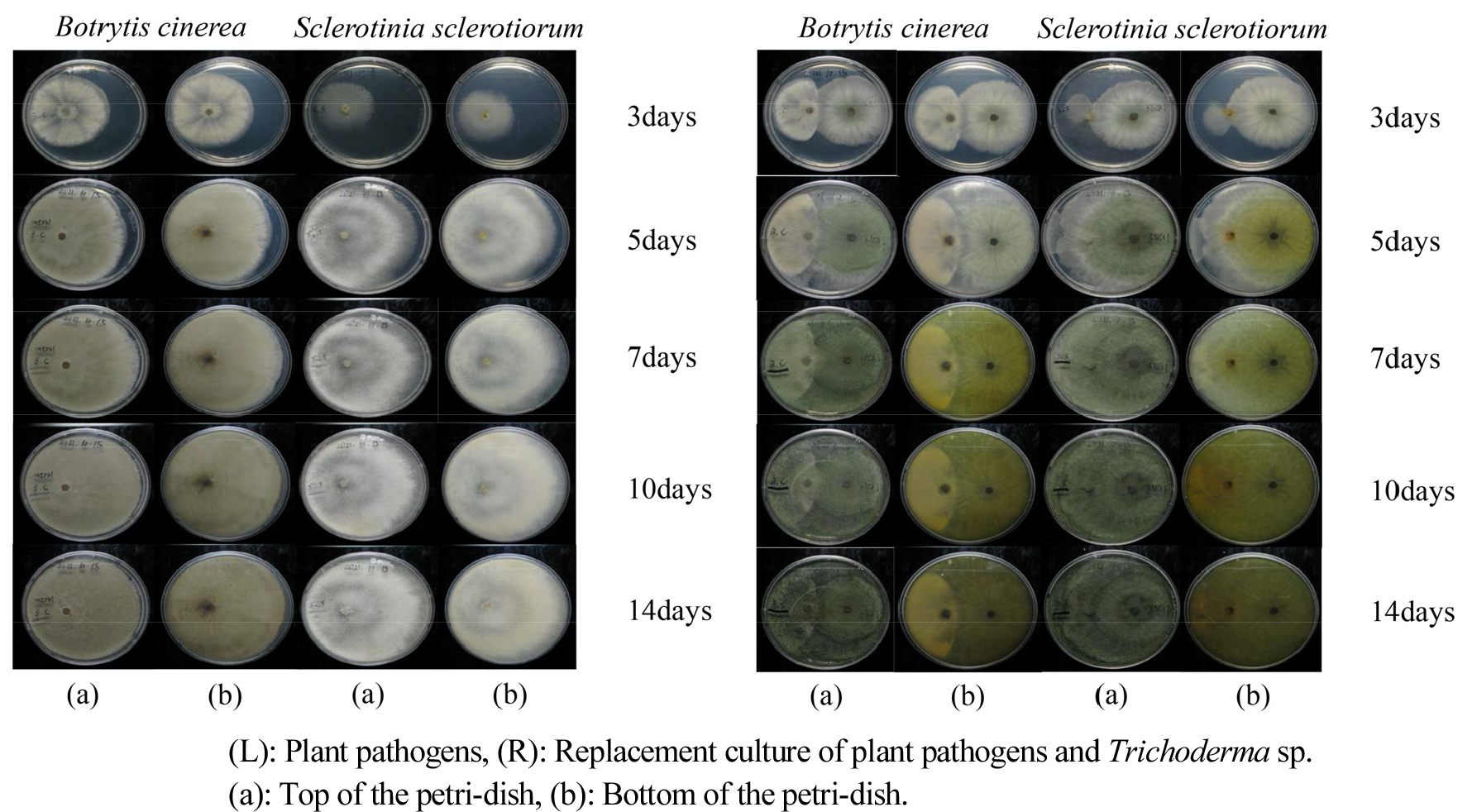
Trichoderma sp. KNU1의 항진균 활성평가를 확인하기 위해 2종의 식물병원균(Botryti cinerea, Sclerotinia sclerotiorum)을 사용하였고, 연구에 사용된 식물병원균은 국립농업과학원 미생물은행(Korean Agricultural Culture Collection)으로부터 분양 받았다. 대치배양은 90 mm 직경의 Petri-dish를 사용하였으며, 3 cm 간격으로 왼쪽엔 식물병원균을 접종 후 다른 한쪽에는 Trichoderma sp. KNU1를 5 mm 직경의 코르크보러(Cork borer)를 사용하여 PDA배지(BD Difco, USA)에 도말하였다. 도말 후 25°C 조건으로 14일간 인큐베이터에서 배양하였고, 대조군으로 식물병원균만 접종하여 동일한 조건으로 배양하여 분석하였다. 식물병원균에 대한 항진균 활성평가는 3, 5, 7, 10, 14일 간격으로 식물병원균의 접종 위치를 시작으로 균체의 직경을 측정하여 대조군과 비교하였고 항진균 활성은 Fig. 1공식을 사용하여 분석하였다(Ru and Di, 2012).
Trichoderma sp. 생성 VOCs(Volatile Organic Compounds)의 항진균 효과 검정
Trichoderma sp. KNU1 생성 VOCs의 항진균 효과 분석은 이중배양법으로 진행하였다. 식물병원균 2종(Botryti cinerea, Sclerotinia sclerotiorum)을 5 mm 직경의 코르크보러(Cork borer)를 사용하여 균사체 디스크를 PDA배지에 접종하고 식물병원균보다 24시간 이전에 Trichoderma sp.를 동일한 직경으로 다른 PDA에 배양하였다. 24시간 후 접종된 서로 다른 두 배지를 겹치게 두고 파라필름(Parafilm)으로 밀봉한 후 25°C 조건으로 인큐베이터에서 7일간 배양하였다. 대조군은 Trichoderma sp. KNU1 없이 식물병원균을 PDA배지에 접종 후 동일한 조건으로 배양하였고 항진균 효과는 3, 5, 7일 간격으로 식물병원균의 직경을 측정하여 다음(Fig. 1)과 같은 공식으로 계산하여 항진균 효과를 확인하였다(Inayati et al., 2019).
토양으로부터 분리된 Trichoderma sp. KNU1의 생물학적 동정
Trichoderma sp. KNU1의 생물학적 동정을 위해 Ribosomal DNA-ITS 부위의 염기서열 분석을 실시하였고, ITS 부위의 증폭을 위해 프라이머를 ITS5(GGAAGTAAAAGTCGTAACAAGG), ITS4(TCCTCCGCTTATTGATATGC) 유니버셜 타입으로 사용하였다. 분석시료를 전기 영동한 후 시퀀싱(Sequancing)을 진행하여 NCBI(National Center for Biotechnology Information)의 BLAST 검색을 활용하여 염기서열의 상동성을 확인하였다(Park et al., 2019).
분석방법(통계분석)
모든 실험의 데이터는 3반복으로 진행하였으며, 평균값과 표준편차 값을 활용하여 SAS 9.4 프로그램 활용 및 Duncan multiple range test(다중 검정)을 통해 유의수준 p < 0.05 수준에서 통계적 검정을 진행하였다.
결과 및 고찰
대치배양을 통한 식물병원균 항진균 활성 결과
대치배양을 통한 Trichoderma sp. KNU1의 항진균 활성 분석한 결과 접종 3일째 Botrytis cinerea는 58.24%, Sclerotinia sclerotiorum는 76.95%의 항진균 활성을 나타냈으며 병원균간 차이를 보인 이유는 Sclerotinia sclerotiorum 균주가 Botrytis cinerea에 비해 초기성장이 빨라 나타난 결과로 보여진다. 접종 5일 경과 후 본격적으로 항진균 활성 효과가 나타나기 시작하였으며, 최종 14일 배양결과 Sclerotinia sclerotiorum 87.88%, Botrytis cinerea는 86.06% 순으로 접종 3일 대비 통계적으로 유의한 차이의 우수한 항진균 활성을 보여주었다(Table 2). 토양 곰팡이에 속하는 Trichoderma sp.는 chitinase, glucanase 등 섬유소분해 효소(Peptaibol)를 2차대산물로 생성 및 분비하는데 이는 식물병원균의 세포벽을 분해하여 병원균 생장을 억제하여 나타난 결과로 사료된다(Ghisalberti and Svasithamparam, 1991). 접종 10일 이후부터 14일까지 식물병원균의 균사의 생장이 일어나지 않았고, 접종 3일 이후부터 Fig. 2와 같이 Trichoderma sp. KNU1은 식물병원균 2종의 균사를 뒤덮어 자라기 시작하였다. El-Hassan et al.(2013)의 연구에 의하면 Trichoderma hamatum과 Fusarium oxysporum 대치배양 시 접종 56시간 이내 균사체가 빠르게 자라 병원균의 균사를 완전히 뒤덮어 자라는 결과와 비슷한 경향을 보여주었다. 또한 Trichoderma sp.는 자라면서 균사가 식물병원균의 균사를 관통하여 식물병원균의 영양분을 섭취 및 세포의 사멸을 킨다는 연구와 유사하게 Trichoderma sp. KNU1는 식물병원균 2종에 대하여 우수한 항진균 활성을 보였다(Harman et al., 2004).
Table 2.
Results of the antifungal activity of Trichoderma sp. through replacement culture
Trichoderma sp. KNU1 생성 VOCs 항진균 활성 결과
Trichoderma sp. KNU1 생성 VOCs의 항진균 활성결과 Botrytis cinerea(잿빛곰팡이병)는 대치배양 결과와는 다르게 배양 3일차부터 74.14%로 높은 항진균 활성을 나타냈으며, 배양 5일과 7일의 항진균력의 경우 각각 82.65, 82.67%로 점차 증가되는 경향을 보여주었다. 반면 Sclerotinia sclerotium(균핵병)의 경우 배양 3일차 47.45% > 5일차 45.10% > 7일차 43.92%로 항진균 활성이 다소 감소하는 것으로 보였으나 통계적으로 유의미한 차이는 보이지 않았다(Table 3). Inayati et al.(2019)의 연구결과에 의하면 Trichoderma virens가 생성하는 휘발성 유기화합물을 GC-MS로 분석한 결과 총 43개의 화합물이 검출되었고, 검출된 화합물의 비율은 Sesquiterpenes가 67.4%, Fatty acids 18.6%, Monoterpene 0.05% 나타냈다. 그 중 a-pinene, cadinene, limonene는 식물추출물(Trachysper mumammi L)에서도 발견이 되며 우수한 항진균 활성을 나타내 식물병원균을 방제하는 생물학적 제제나 의약품으로 자주 사용되는 것으로 알려져 있다. 또한 Trichoderma viride가 생성하는 VOCs는 작물의 뿌리 생중량과 엽록소함량을 증가시켜 식물병원균에 대해 높은 항진균력을 보여줄 뿐만 아니라 식물생장 촉진활성에 긍정적인 영향을 미친다고 알려져 있다(Lee et al., 2016).
Table 3.
Evaluation of the antifungal activity of volatile organic ompounds (VOCs) produced by Trichoderma sp. against two plant pathogens
Trichoderma sp. KNU1의 생물학적 동정결과
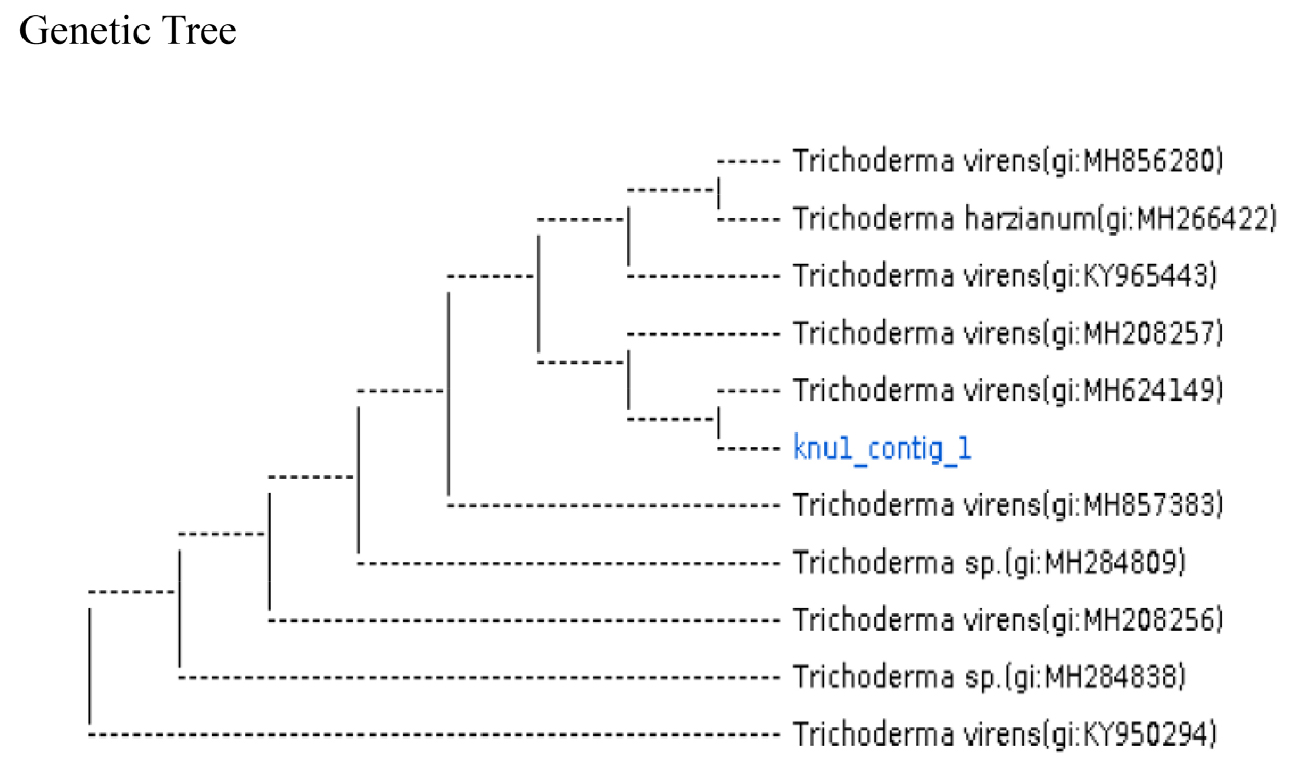
NCBI BLAST 프로그램을 통한 생물학적 유전자 염기서열 분석결과 Trichoderm sp. KNU1는 Identities score Total 595점 중 Match 587점으로 Trichoderma vierens strain T101b 균주와 99% 상동성을 보였다(Table 4, Fig. 3). 해외에서는 트리코더마 속(Trichoderma harzianum, Trichoderma viride, Trichoerma koningii 등)을 활용하여 다양한 방법(종자코팅, 펫렡 등)으로 양파 흑색썩음균핵병에 대한 우수한 방제 효과를 입증하였다(Lee et al., 2006). 본 연구의 결과를 토대로 선발된 항진균 활성균인 Trichoderma vierens T101b는 잿빛곰팡이병과 균핵병에 대한 생물학적 제제로서 가능성을 확인하였다.