서 론
재료 및 방법
실험재료
Gallic acid함량 측정
총 페놀 및 총 플라보노이드 함량 측정
전자공여능
ABTS radical 소거활성 평가
Reducing power
XTT assay에 의한 세포 생존 능력 측정
Tyrosinase 저해 활성
통계분석
결과 및 고찰
Gallic acid 함량 분석
총 폴리페놀 및 총 플라보노이드 함량
전자공여능
ABTS
환원력 측정
항산화 성분과 항산화 활성의 상관관계 분석
세포생존 능력 측정
Tyrosinase 저해 활성 확인
요 약
서 론
최근 약용식물 및 생약 등으로부터 특정성분이나 천연물이 가지는 2차 대사산물인 생리활성물질에 대한 관심이 증대되고 있다. 특히 건강에 관한 관심이 높아지면서 천연 기능성 물질 탐색에 관한 연구가 활발히 진행되고 있다(Joung et al., 2007). 생리활성물질은 매우 적은 양으로 현저한 활성을 나타내는 고부가가치의 물질로서 현재 수많은 종류가 유용하게 이용되고 있으며, 또한 새로운 물질들이 연구 개발되고 있다(Tabance et al., 2001). 특히 산업문명이 고도로 발달됨에 따라 인공합성품 중 일부가 안전성의 문제가 제기되면서 규제가 점점 강화되고 있고, 소비자들의 안전과 건강에 대한 욕구증대에 따라 인공합성품의 사용을 제한하려는 추세에 있어 천연물의 이용분야는 더욱 넓어지고 있는데, 허브를 포함한 다양한 유용식물을 이용하여 전 세계적으로 식물자원에서 항암, 항알레르기, 항비만, 항산화 및 항균 등에 효과있는 기능성 물질을 다량 함유하고 있는 자원을 선발하여 이들 유용한 물질들을 약, 식품첨가제 또는 화장품의 원료로 개발하려는 연구가 다양한 각도에서 진행되고 있다(Kim et al., 2006a; Ali et al., 2005). 최근 천연물에 대한 소비자들의 욕구가 높아져 각 분야에 걸쳐 부작용이 적은 천연물의 이용이 증가하고 있으며, 특히 천연물을 이용한 항균성 물질의 개발 연구가 활성화되고 있으며, 연구 또한 많이 진행되고 있으며(Lee et al., 2020; Kim, 2017; Jeon et al., 2017), 화장품 업계에서는 이를 막기 위해 합성 방부제인 paraben류를 주로 사용하고 있으나 합성방부제의 안전성에 대한 문제가 대두되면서 천연 방부제에 대한 연구가 꾸준히 진행되고 있다(Jun et al., 2000; Yang et al., 2012).
오배자는 매미목의 진딧물과의 곤충인 오배자 면충이 야산에 기생하는 붉나무의 새잎에 기생함으로써 형성된 벌레집으로 일본, 중국과 함께 우리나라 각지에 분포한다. 대표적인 지표 성분으로 gallic acid와 methyl gallate가 있고 항산화 활성, 항염증, 항균활성이 있다(Oh et al., 2003). 탄닌(50-60%)의 수렴작용에 의하여 지사작용, 지혈작용, 억균 작용, 선분비 억제작용을 나타낸다(Cha et al., 2000). 오배자 중 gallotanin 류 및 triterpenoid 화합물 등은 항산화, 항혈전, 항바이러스 및 멜라닌 생합성 억제 활성 등에 관에 관여한다는 보고가 있다(Bae et al., 2012: Song et al., 2002: Kurokawa et al., 1999: Chen et al., 2009). 한방에서는 설사, 대장염, 이질, 위장출혈, 각혈, 코피, 식은땀, 자한(自汗) 등에 쓰며, 외상성 출혈, 창양, 습진, 농가진, 오랜 기침 등에도 쓴다(Lee et al., 2018). 천연물에 포함되어있는 수많은 phenolic compounds 및 flavonoids 성분들은 항산화, 미백, 주름, 보습에 효과가 있다고 알려져 있다(Garg et al., 2017; Panzella and Napolitano, 2019). 따라서, 피부조직의 손상 및 외인성 노화를 예방하기 위하여 항산화, 미백, 주름 개선, 보습 기능이 있는 천연 기능성 화장품에 대한 소비자의 요구가 증가하고 있으며, 이에 따라 천연물을 이용한 화장품 소재로서의 가능성에 대한 연구가 필요한 실정이다. 하지만 아직도 많은 한약재에 대한 생리활성 연구는 비교적 많이 되어 있지 않아 다양한 생리활성 연구는 매우 중요한 자료로써 제공될 것이라고 생각된다. 본 연구에서는 오배자 메탄올 추출물의 미백 효능 및 항산화 활성을 측정하여 항산화 및 화장품 천연소재로서의 활용 가치를 검토하였다.
재료 및 방법
실험재료
본 실험에 사용된 오배자(Rhus chinensis)는 강원도 춘천에 위치한 대광약업사(Chuncheon, Korea)에서 시료를 구입하였으며, 오배자 추출은 시료 100 g에 10배의 80%(v/v) 메탄올을 가한 후 4시간 환류추출하고, 추출액을 여과한 후 감압농축(CCA-1100, Eyela, Tokyo, Japan)하여 -70°C에서 급속동결건조(PVTFA 10AT, ILSIN, Gyeonggi, Korea) 과정을 거쳐 분말 상태로 제조한 후 생리활성 물질 함량분석 및 미백활성 실험에 사용하였으며, 80% 메탄올로 추출한 추출물의 수율은 13.5%였다.
Gallic acid함량 측정
Gallic acid의 HPLC 분석은 Cho 등(2016)의 분석 방법을 변형하여 함량을 측정하였다. 오배자 분말 시료 50 mg을 10 mL 부피플라스크에 정확히 칭량하여 넣어준 후, MeHO로 정용하고 0.45 µm membrane filter로 여과하여 HPLC에 10 µL 주입하였으며, HPLC 분석에 사용된 시약은 모두 HPLC grade를 사용하였다. 오배자 추출물의 분석에 사용된 지표성분인 gallic acids는 Sigma(Sigma-Aldrich Co., St. Louis, MO, USA)에서 구입하였고, gallic acid의 분석 조건은 Table 1에 나타내었다.
Table 1.
HPLC conditions for the analysis of gallic acid
| Instrument | Conditions | ||
| Column | Shiseido C18 (5.0 µm, 4.6 mm×250 mm) | ||
| Column temp. | 40°C | ||
|
Mobile phase (Gradient) | Time (min) | Solvent A1) | Solvent B2) |
| 0 | 8 | 92 | |
| 23 | 8 | 92 | |
| 26 | 15 | 85 | |
| 36 | 30 | 70 | |
| 40 | 45 | 55 | |
| 43 | 45 | 55 | |
| 45 | 8 | 92 | |
| Detector | Waters 996 Photodiode Array Detector (280 nm) | ||
| Flow rate | 1.0 mL/min | ||
| Injection volume | 10 µL | ||
| Run time | 45 min | ||
총 페놀 및 총 플라보노이드 함량 측정
총 페놀 및 총 플라보이드 함량은 Kim et al.(2011)의 방법을 일부 변형하여 측정하였다. 총 페놀 함량은 오배자 시료액과 follin-ciocalteau’s phenol regent(2%) 및 10% Na2CO3를 1 : 1 : 1의 비율로 혼합한 후 1시간 동안 반응시킨 후 750 nm에서 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 이용하여 흡광도를 측정하고 gallic acid 의 표준곡선을 이용하여 총 페놀 함량을 구하였다하였다. 총 플라보노이드 함량은 각 오배자 시료액 0.5 mL에 95% ethanol 1.5 mL, 10% aluminum nitrate 0.1 mL, 1 M potassium acetate 0.1 mL, 증류수 2.8 mL를 첨가하여 상온에서 30분 동안 반응시킨 후 microplate reader로 415 nm에서 흡광도를 측정한 후 rutin 표준곡선을 이용하여 총 플라보노이드 함량을 측정하였다.
전자공여능
DPPH radical 소거능은 전자 전달에 의한 항산화활성을 측정하는 방법으로, 방향족 화합물, 방향족 아민류에 의해 전자나 수소를 받아 환원되어 안정한 분자를 형성하게 될 때, 보라색이 탈색되어지는 원리를 이용하여 다양한 천연소재로부터 항산화물질을 탐색하기 위해 많이 이용되고 간단하게 짧은 시간에 항산화 능력을 측정할 수 있는 방법이다. 1 mL 에탄올, 10 µL 추출물, 100 mM sodium acetate buffer(pH 5.5) 990 uL를 넣은 시험관에 0.5 mL의 0.5 mM DPPH 용액를 넣어 혼합한 후, 냉암실에서 5분간 반응 유도 후, 남아있는 radical의 농도를 UV spectrophotometer를 이용하여 517 nm에서 측정하였다(Lee and Lee, 2008). 전자공여능(%)은 [(1-As/Ac) × 100)] 으로 나타내었고, As와 Ac에 실험군과 대조군의 흡광도 값을 각각 대입하여 계산하였다.
As : 추출물 첨가구의 흡광도
Ac : 추출물 무첨가구의 흡광도
ABTS radical 소거활성 평가
ABTS 라디칼을 이용한 항산화능의 측정은 샘플 내의 항산화 물질에 의해 ABTS free 라디칼 제거되어 청록색이 탈색되는 원리이다(Cho et al., 2013). 7 mM ABTS와 2.45 mM potassium persulfate 용액을 16시간 동안 암소에서 반응시키고 radical을 발생 후 96-well microplate에 시료 10 µL와 ABTS 용액 290 µL를 가해 혼합한 후 6분간 어두운 곳에서 반응시킨 후 734 nm에서 흡광도를 구하고 소거활성을 계산하였다(Re et al., 1999). 다음 식에 의해 시료의 ABTS radical 소거능을 구하였다.
Reducing power
Reducing power activity는 시료 0.1 mL, sodium phosphate buffer(0.2 M) 0.5 mL, potassium ferricyanide(1%) 0.5 mL를 혼합한 후 20분간 50°C에서 반응시키고 trichloroacetic acid(10%) 0.5 mL를 가한 후 10분간 원심 분리한 후, 0.5 mL의 상등액에 증류수 0.5 mL, iron(III) chloride(0.1%) 0.1 mL를 가하여 10분간 상온에서 반응시키고 700 nm에서 microplate reader를 이용하여 흡광도를 측정하고(Cho et al., 2011), 구한 값을 이용하여 환원력을 비교하였다.
XTT assay에 의한 세포 생존 능력 측정
오배자 추출물의 세포독성 평가는 Kim 등(2011)의 방법에 따라 XTT[2,3-bis(2-methoxy-4-nitro-5-sulfophenyl)- 2H-tetrazolium-5-carboxanilide innersalt] assay kit를 이용하여 측정하였다. 3T3-L1 세포를 1 × 105 cell/mL로 96 well plate에 분주하고, 오배자 추출물 시료를 농도별(10, 25, 50, 100 µg/mL)로 처리하여 24시간 배양시킨 후, XTT 시약을 첨가하여 CO2 incubator(MCO-20AIC, Sanyo, Osaka, Japan)에서 4시간 반응시켰다. 이후 microplate reader를 사용하여 450, 690 nm에서 흡광도 값을 측정하여 값을 빼준 후 다음 식으로 계산하였다.
Tyrosinase 저해 활성
Mushroom tyrosinase-150 unit(Sigma-Aldrich Co.) 150 µL, L-tyrosinase 225 µL(2.5 mM), 0.4 M Hepes buffer(225 µL, pH 6.8), ethanol 300 µL 용액을 혼합 후 반응 전후 475 nm에서 흡광도를 각각 측정하여(Kim et al., 2006b) tyrosinase가 억제되는 정도를 다음과 같이 구하였다.
A and B: 각각 시료를 가지는 용액의 배양 전과 배양 후의 흡광도
C and D: 각각 시료를 넣지 않은 용액(기준 용액)의 배양 전과 배양 후의 흡광도
통계분석
통계처리는 SAS version 9.3(SAS Institute Inc., Cary, NC, USA)을 이용하여 분석하였다. 유의성 분석은 oneway ANOVA 검정을 실시하였으며, Duncan의 다중범위 검정법(Duncan’s multiple range test)으로 유의성 p < 0.05 수준에서 검정하였다. 항산화 성분과 항산화 활성의 상관성 분석은 Pearson correlation을 수행하여 p < 0.01 수준에서 유의성을 검증하였고 상관계수를 구하였다.
결과 및 고찰
Gallic acid 함량 분석
오배자 추출물에 함유된 gallic acid의 함량은 Table 2에 나타내었으며 14.89 mg/g의 높은 함량을 나타내었다. Gallic acid는 많은 식물에 유리된 상태로 또는 갈로타닌 상태로 결합되어 있는 물질로 수용성이며 물에 잘 녹는 성질을 가지고 있다. 품종별 밤의 gallic acid 함량 분석결과 품종에 따라 0.15-1.3%의 연구결과(Jeon et al., 2020)와 비교하였을 때 오배자 추출물이 더 많은 gallic aicd 함량을 나타내었다. 추후 오배자 추출물의 gallic acid를 순수 분리하여 항산화 및 tyrosinase 억제 활성에 관한 연구가 진행되어야 할 것으로 판단된다.
Table 2.
Gallic acid content in Rhus chinensis methanol extracts
| Sample | Contents (mg/g) |
| RCM1) | 14.89 ± 0.25 |
총 폴리페놀 및 총 플라보노이드 함량
식물성 식품 속에 함유되어 있는 페놀화합물의 기능은 다양하며, 식물성 식품에 함유되어 있는 페놀성 분자들은 체내에서 항산화, 항비만 및 항염증 등과 같은 기능을 가지고 있는 것으로 알려져 있으며(Cho et al., 2007), polyphenolic substance로서 플라보노이드류는 화학구조에 따라 flavonols, flavones, catechins, isoflavones 등으로 분류되며, 물과 에탄올에 대한 용해도가 다르고 과산화 지질 생성 억제 등의 생화학적 활성은 구조적 차이에 의해 일어나는 것으로 알려져 있다(Middleton and Kandaswami, 1994). 80% 메탄올의 오배자 추출물의 총 페놀 및 플라보노이드 함량은 Table 3에 나타내었으며 총 페놀 함량은 446.66 ± 0.01 mg GAE/g, 총 플라보노이드 함량은 33.50 ± 0.31 mg QE/g으로 나타내었다. 페놀 화합물 함량이 높을수록 식물 기원의 시료에서 항산화 활성이 높은 것으로 알려져 있다(Duval and Shetty, 2001). 오배자 추출물의 항산화에 대한 효과가 있는 것으로 사료되며 추후 항산화 작용에 대한 깊은 연구가 진행되어야 할 것으로 사료된다.
Table 3.
Total polyphenol and flavonoid content of Rhus chinensis methanol extract
| Sample | RCM1) |
| Total Phenol contents (GAE2) mg/g) | 446.66 ± 0.01 |
| Total Flavonoid contents (RE3) mg/g) | 33.50 ± 0.31 |
전자공여능
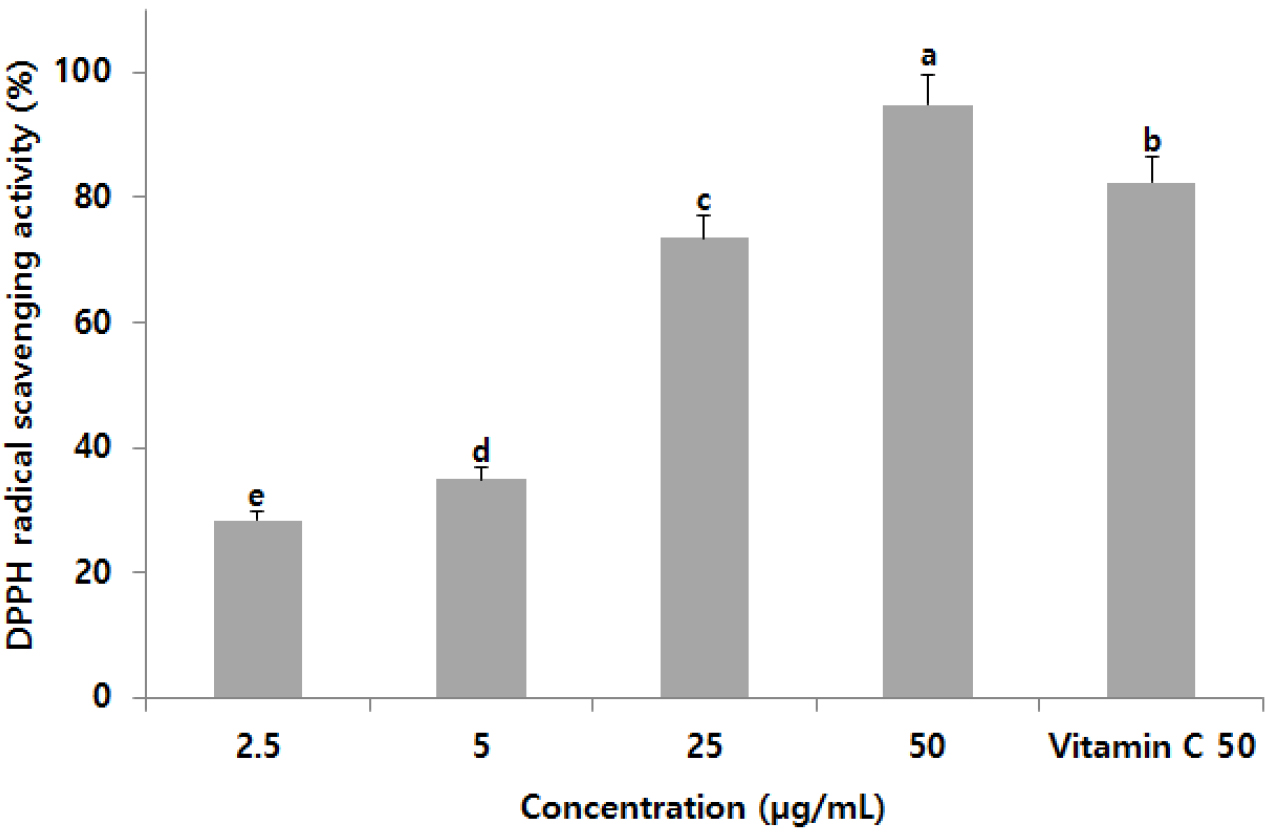
일반적으로 특정 물질에 대한 항산화활성을 측정하는 방법에는 여러 가지가 있으나 그 중에서 DPPH free radical 소거 활성법은 간단하고 대량으로 측정이 가능하며, 비교적 간단하고 짧은 시간 내에 항산화 활성을 측정할 수 있어 널리 사용되고 있다(Que et al., 2006). 오배자 추출물의 DPPH 소거능은 2.5, 5.0, 25.0, 50.0 ug/mL의 농도에서 각각 28.45, 34.97, 73.53 및 94.75%로 농도가 증가할수록 DPPH radical 소거능은 증가하였다(Fig. 1). 부평초 추출물의 1000 µg/mL 소거능 측정 결과인 48.32 µg/mL보다 높은 결과를 나타냈으며(Song and Choi, 2017), 대조군인 ascorbic acid와 오배자 추출물이 고농도에서 유사한 억제율을 나타내어 오배자 메탄올 추출물의 항산화 효과를 확인할 수 있었으며, 우수한 free radical에 위한 노화 억제효과를 나타낼 수 있을 것으로 사료된다.
ABTS
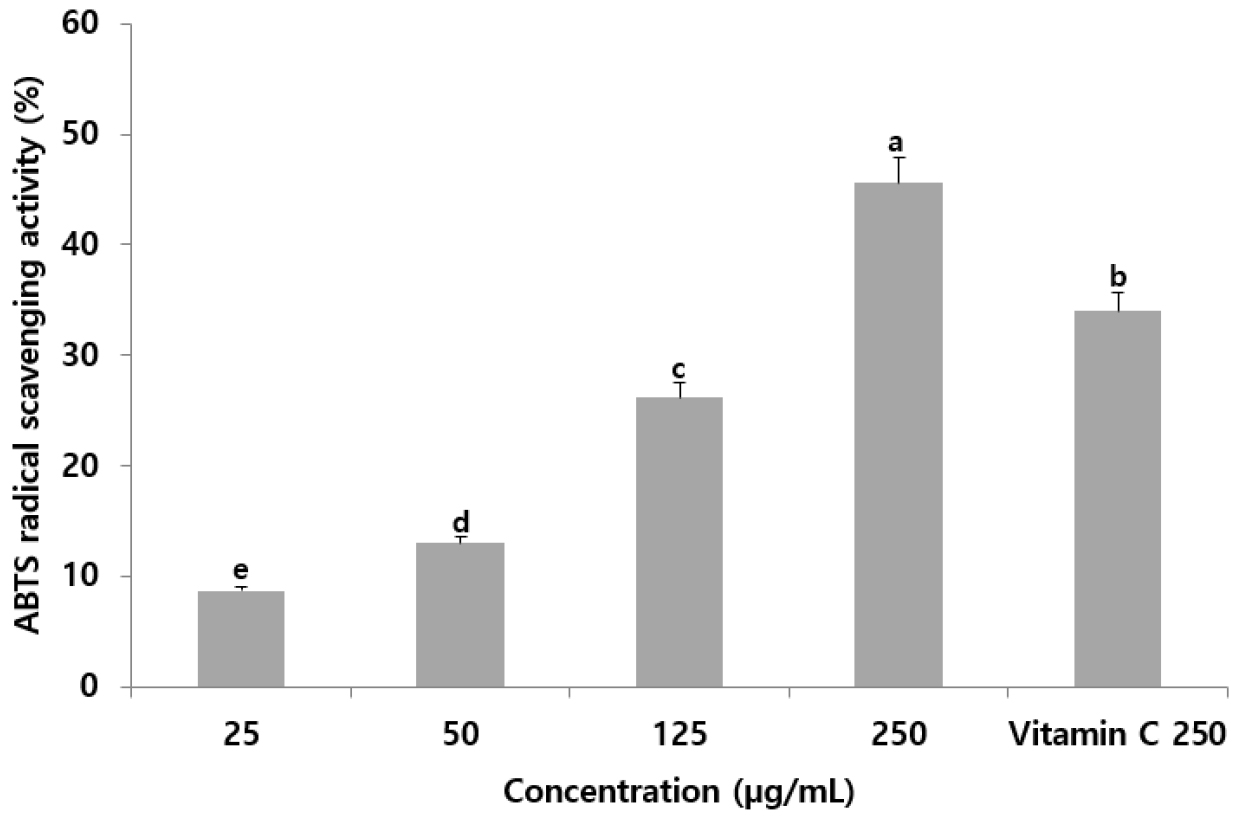
ABTS radical은 potassium persulfate와의 반응으로 생성된 peroxide radical 의 ABTS가 항산화성 물질에 의해 제거되면서 청록색이 탈색되어지는 것을 이용하여 항산화능의 차이에 의해 청록색이 탈색되는 정도를 흡광도 수치로 나타낸다. DPPH radical 소거능의 경우에는 유리라디칼이 소거되어지는 것을 이용하는 반면, ABTS radical 소거능은 양이온인 라디칼이 소거되어지는 것을 이용한다(Miller et al., 1993). 오배자 추출물의 ABTS radical 소거능은 Fig. 2에 나타내었다. 수생식물의 연꽃뿌리의 95% 에탄올 추출물에서 ABTS radical 소거능을 측정한 결과, 양성 대조군으로 사용된 ascorbic acid 만큼 소거되는 것이 관찰되었다(Park et al., 2016). 이 연구에서 연꽃 뿌리에 함유된 폴리페놀 성분이 radical 소거에 관여하였으리라는 보고와 같이 본 실험에 사용된 오배자 또한 페놀 및 플라보노이드 등의 성분이 ABTS radical 소거능에 탁월하게 작용하였으리라 기대된다.
환원력 측정
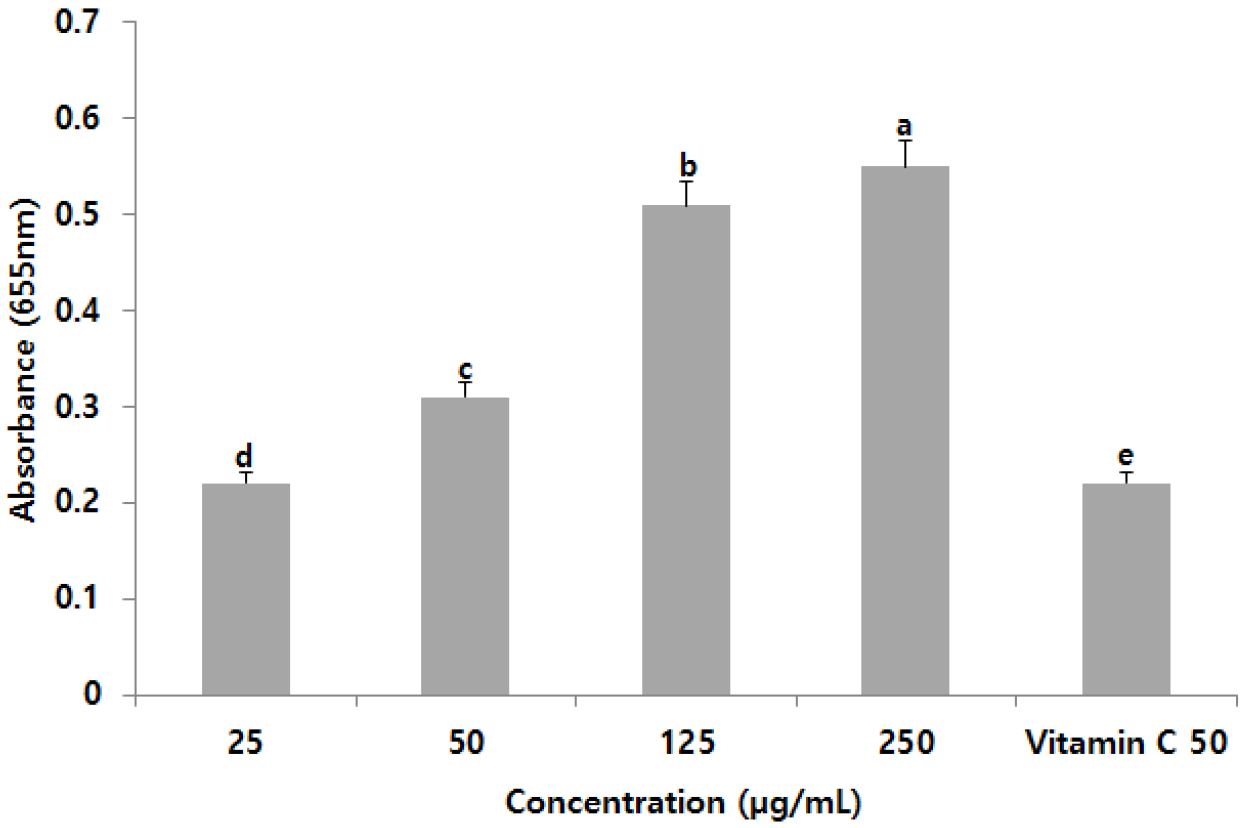
환원력은 시료가 Fe3+에 수소를 공여하여 라디칼을 안정화시킴으로써 Fe2+로 환원되는 것을 이용한 방법으로, 환원력을 평가한 655 nm의 값은 25, 50, 125.0, 250.0 ug/mL의 농도에서 각각 0.22, 0.32, 0.51 및 0.55를 나타내어 농도의존적으로 증가함을 나타내었다(Fig. 3). 연잎 메탄올 추출물을 이용하여 환원력 뿐만 아니라 hydroxy radical 및 free radical 소거활성을 측정한 결과 매우 강한 항산화 효과를 나타내었다고 보고(Wu et al., 2003)하여 본 실험의 결과와 유사한 결과를 나타내었다.
항산화 성분과 항산화 활성의 상관관계 분석
항산화 활성을 평가하는 in vitro 방법은 기전에 따라 크게 5가지 유형으로 금속이온 킬레이팅, 수소공여기전, 항산화성 효소기전, 산소 소거기전 및 일중항산소 제거기전 등으로 나눌 수 있다(Yang et al., 2011; Lee et al., 2012). 본 연구에서는 농도별 오배자 추출물의 항산화 성분(총 페놀 및 플라보노이드 함량)과 항산화 활성(DPPH radical 소거능, ABTS radical 소거능, reducing power)을 평가 하였으며, 실험결과를 바탕으로 항산화 성분과 항산화 활성에 대한 상관관계를 비교하여 R2 값으로 나타내었다(Table 4). 그 결과 모든 항산화 활성실험 값이 항산화 성분에 대하여 1에 가까운 R2 값을 나타내어 페놀 및 플라보노이드가 증가함에 따라 항산화 활성도가 유의적으로 증가하는 것으로 나타났다. 위의 결과로 보아 오배자 추출물은 라디칼 소거능 및 산화·환원작용을 통하여 항산화 활성을 가지는 것으로 사료되며, 천연 항산화 소재로서의 활용가능성이 높을 것으로 기대된다.
Table 4.
Correlation analysis (R) among the antioxidative activity and antioxidant compounds of Rhus chinensis methanol extract
| Parameter | DPPH | ABTS | Reducing power | TPC1) | TFC2) |
| DPPH | 1.000 | ||||
| ABTS | 0.983** | 1.000 | |||
| Reducing power | 1.000** | 0.986** | 1.000 | ||
| TPC1) | 0.999** | 0.999** | 1.000** | 1.000 | |
| TFC2) | 0.967** | 0.996** | 0.971** | 0.997** | 1.000 |
세포생존 능력 측정
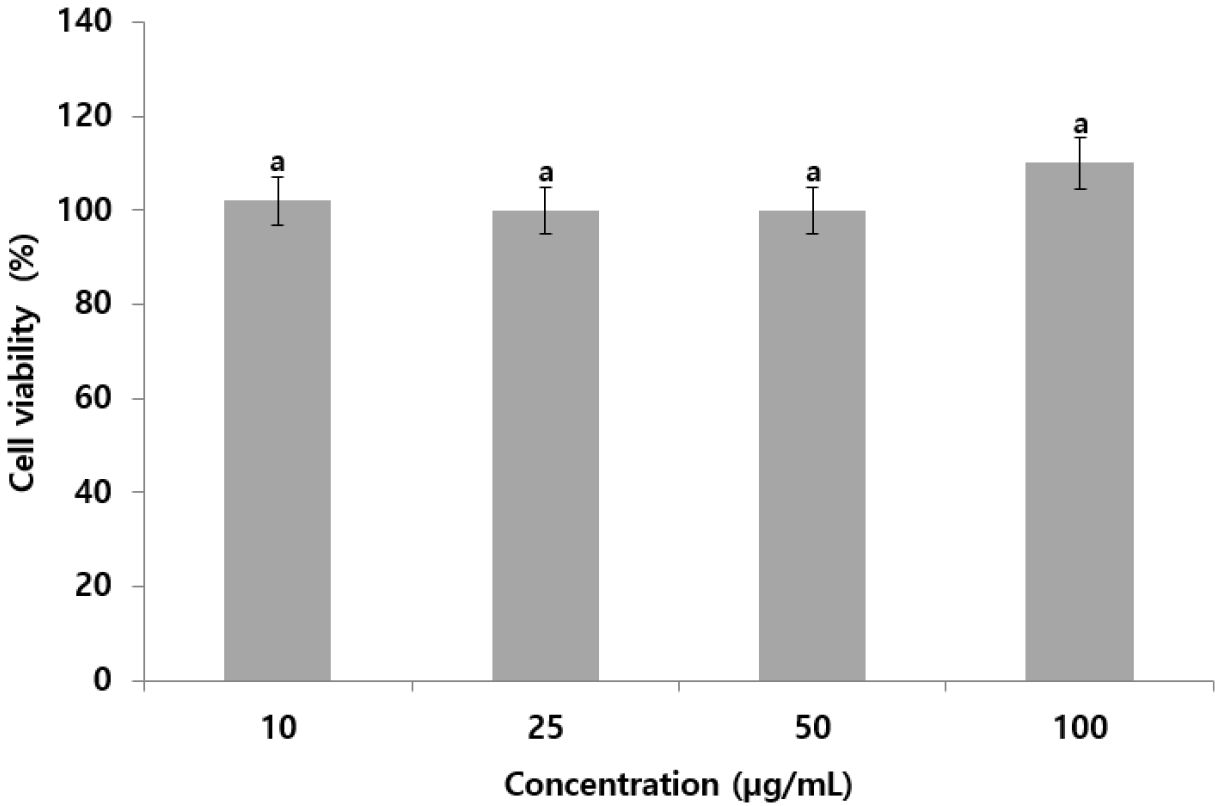
세포 수준의 연구에 많이 이용되고 있는 XTT assay는 cell proliferation과 viability의 in vitro 분석에 매우 유용하게 사용되고 있으며, 오배자 추출물에 의한 RAW 264.7 세포의 생존율을 확인한 결과(Fig. 4), 추출물이 10, 25, 50, 100 µg/mL 농도에서 100% 이상의 세포 생존율을 확인하였다. 따라서 RAW 264.7 세포에서 세포독성이 없어 50 µg/mL 농도 이하에서 melanin 생합성 저해 실험을 진행하였다.
Tyrosinase 저해 활성 확인
Melanin 생성 과정에 있어서 핵심적인 요소는 피부 내에서 tyrosinase이다. 이 효소는 아미노산인 tyrosine으로 시작되는 멜라닌 생합성 과정 중에서 tyrosine으로부터 3,4-dihydroxy phenylalanine(DOPA), DOPA로부터 DOPA quinone 그리고 dihydroxyindole(DHI)로부터 melanin을 형성한다(Lee et al., 2012). 오배자 추출물을 대상으로 tyrosinase 저해활성을 측정하였다(Table 5). 오배자 추출물 100, 500, 1,000 µg/mL에서 각각 8.24%, 35.17% 및 40.35%의 저해율을 나타냈다. 미백제로 알려진 arbutin과 비교하였을 때, tyrosinase 저해활성이 동일 농도에서 더 높게 나타나 오배자 추출물은 천연소재로서의 미백기능에 효과적인 가치가 있음을 기대할 수 있다. 찔레꽃 잎과 뿌리의 에탄올 추출물에 대한 tyrosinase 활성억제를 조사한 결과 200 µg/mL의 농도에서 tyrosinase 활성을 20%-25% 억제한다고 보고되었으며(Ha et al., 2009), 일부 생약과 해조류의 tyrosinase 저해 활성 측정 결과 치자 36%, 인삼 27%, 지실 15%, 매생이 21%, 청각 11% 그리고 미역 7%의 저해율을 나타내어(Cho, 2004), 오배자 추출물의 활성이 우수함을 확인할 수 있었으며 돌단풍 잎의 피부미백 효과와 유사한 결과를 나타내었다(Ha et al., 2016).
Table 5.
The effect of 80% methanol extract of Rhus chinensis on tyrosinase activity
| Control | Arbutin (ug/mL) | RCM1) (ug/mL) | ||
| 1000 | 100 | 500 | 1000 | |
| 100 ± 1.82 | 34.82 ± 4.21 | 8.24 ± 0.28 | 35.17 ± 0.41 | 40.35 ± 0.21 |
요 약
본 연구에서는 한방에서 생약으로 사용되고 있는 오배자의 천연 기능성 화장품 소재로서의 활용 가능성을 검토하기 위해 80% 메탄올로 추출하여 항산화 활성 및 미백효과에 대해 알아보았다. 80% 메탄올의 오배자 추출물의 총 페놀 및 플라보노이드 함량은 Table 1에 나타내었으며 총 페놀 함량은 446.66 ± 0.01 mg GAE/g, 총 플라보노이드 함량은 33.50 ± 0.31 mg QE/g으로 나타내었다. DPPH radical, 환원력, ABTS radical 등의 항산화능력은 유의적으로 증가함을 나타내어 항산화에 효과가 있음을 알 수 있었다. 항산화 성분과 항산화 활성의 상관관계는 모든 항산화 활성실험 값이 항산화 성분에 대하여 1에 가까운 R2 값을 나타내어 페놀 및 플라보노이드가 증가함에 따라 항산화 활성도가 유의적으로 증가하는 것으로 나타났다. 미백제로 알려진 arbutin과 비교하였을 때, tyrosinase 저해활성이 동일 농도에서 더 높게 나타났다. 오배자 추출물은 천연소재로서의 위의 결과로 보아 오배자 추출물은 라디칼 소거능 및 산화·환원작용을 통하여 항산화 활성을 가지는 것으로 사료되며, 천연 항산화 소재 및 미백기능에 효과적인 가치가 있는 소재 로서의 활용가능성이 높을 것으로 기대된다.