서 론
재료 및 방법
병원균의 분리 및 보관
병원균의 형태학적 특성 분석
염기서열 분석 및 분자생물학적 동정
병원성 검정
농약 종류에 따른 병원균 균사생장 억제효과 조사
결과 및 고찰
점무늬병의 발생 및 동정
병원성 검정
농약 성분에 따른 균사생장 억제효과
요약 및 결론
서 론
경제 발전과 더불어 웰빙에 대한 인식과 관심이 식문화에 큰 변화를 가져왔다(Song, 2006). 현대인의 식단 트렌드 변화에 따른 다양한 소재 발굴, 생산 방식, 소비자 선호 상품성 등의 다방면적 개발이 우리 농산물 성장에 필수적이라 할 수 있다(MIFAFF, 2016). 소규모로 재배되던 산나물류가 밭작물로 대량 재배가 이뤄지고 있다. 취나물류는 항암, 항산화 효능을 인정받아 웰빙 식단의 품목으로 각광받고 있다(Chang et al., 2008; Kim et al., 2014). 취나물류는 국화과(Asteraceae)에 속하며, 전 세계적으로 100여 종이 알려져 있다(Han et al., 2010). 우리나라에는 약 60여종이 분포하며, 참취(Aster scaber)와 곰취(Ligularia fischeri), 각시취(Saussurea pulchella), 곤달비(Ligularia stenocephala) 등이 가장 많이 재배되는 작물이다(Lee et al., 2016). 특히 참취는 동남아시아 일대에 널리 분포하며 진통, 해독, 혈액순환 촉진, 근골통증, 요통, 두통, 복통, 인후염 등의 치료 효과가 보고되었다(Choi et al., 2001). 곰취는 독특한 향이 있어 쌈, 무침, 묵나물 등으로 소비되고, 한약을 만들 때에도 해수, 요통, 관절통, 백일해, 천식, 타박상 등을 치료할 때 사용된다. 또한 곰취의 항암효과도 근래에 밝혀져 웰빙시대에 중요한 식재료로 인지되고 있다(You et al., 2009). 취나물의 다양한 약리 효능과 유용성으로 지속적 수요 상승이 발생하고 있으며, 농가의 년 생산량은 약 7,197톤에 달하고(Research Institute of Wild Vegetable Gangwondo ARES, 2017), 향후 취나물 사업은 더욱 확대될 것으로 전망된다(Youn and Park, 1998).
곰취와 참취 생산에 다양한 균류에 의한 병해가 경제적 피해를 야기하고 있다; 점무늬병(Septoria astericola), 잎마름병(Phoma), 뿌리썩음병(Phytophthora drechsleri), 줄기썩음병(Sclerotium rolfsii), 흰가루병(Spaerotheca fusca, Neoerysiphe galeopsidis), 잘록병(Rhizaoctonia solani), 잿빛곰팡이병(Botrytis cinerea)(List of plant diseases in Korea 4th, 2004; NAS, 2016). Alternaria는 배, 사과, 토마토, 키위 등의 다양한 작물을 가해하며, 이로 인한 상품성 저하 및 생산량 감소는 경제적으로 심각한 수준이다(Kwon et al., 2011; Yun and Yu, 1992). 최근에는 곰취와 참취의 재배지에서 Alternaria에 의한 점무늬병로 의심되는 병징이 발견되지만, 이에 대한 보고는 미흡한 상황이다. 특히 Alternaria alternata는 alternariol, alternariol monomethl ether, altenuene, alterxouns I, II, III 등의 mycotoxin을 생성하여 사람 또는 가축에 중독 현상을 일으키기도 한다(Lee and Yu, 1995; Ostry, 2008). 따라서 작물 재배할 때 적절한 방제 기술을 활용하여 병원균을 방제할 필요성이 있다.
현재 우리나라 취나물류의 점무늬병 방제를 위한 살균제에는 difenoconazole, azoxystrobin, polyoxin B 등이 있다(한국작물보호협회, www.koreacpa.org). 그러나 이 살균제는 Septoria astericola를 방제하기 위한 약제이고, 아직까지 다른 병원균에 대한 방제 약제 연구는 미흡한 수준이다. 본 연구에서는 곰취와 참취의 점무늬병반에서 원인병원체를 분리, 동정하여 해당 병해가 Alternaria alternata에 의한 것임을 밝혔다. 분리한 Alternaria alternata의 방제를 위해 살균제의 효능 및 특성에 대한 연구를 수행하였다. 본 연구 결과는 Alternaria alternata에 의한 곰취 및 참취의 점무늬병을 방제하기 위한 기초자료로 활용될 것으로 생각된다.
재료 및 방법
병원균의 분리 및 보관
점무늬병에 걸린 이병체는 2020년 8월 강원도 춘천(37°52'17.8"N, 127°44'43.5"E)과 양구(38°08'04.4"N, 128°00'29.8"E)의 곰취 및 참취 재배지에서 채취했다. 점무늬병징을 보이는 곰취와 참취 이병체에서 병원균을 분리하기 위해 실온에서 24시간 말린 후, 병반 부분을 5 × 5 mm 정도의 크기로 잘라 표면 살균한 뒤 ampicillin(100 µg/mL) (Duchefa Biochemie, Netherlands)이 첨가된 PDA배지(potato dextrose agar, 4 g of potato infusion, 20 g of dextrose, 15 g of agar per liter)에 접종해 25°C, 3일간 배양하였다. 배양된 균은 단포자를 분리하여 PDA배지에 접종 후 실험에 사용했다. 분리한 병원균을 오랜 시간 보관하기 위해 PDA배지에 접종한 병원균을 25°C, 광조건에서 10일간 배양해 포자 생성을 유도하였다. 그리고 멸균수를 첨가하고 표면을 긁어 miracloth에 걸러내어 포자 현탁액을 얻고, 25% glycerol로 포자현탁액을 만들어 -70°C에 보관하였다.
병원균의 형태학적 특성 분석
분리한 균의 형태학적 특성을 확인하기 위해 PDA, OMA 배지(50 g of oatmeal and 25 g of agar per liter), V8A 배지(80 mL of V8 juice, 310 µL of 10N NaOH, and 15 g of agar per liter)를 사용하였다. 직경 4 mm의 agar plug를 각각의 배지 중앙에 접종하고 균총의 직경을 측정하기 위해 25°C, 광조건에서 3일간 배양하였으며, 포자의 모양을 확인하기 위해 25°C, 광조건에서 5일간 배양하였다.
염기서열 분석 및 분자생물학적 동정
병원균의 분자생물학적 방법으로 동정하기 위해 PDA 배지에 배양한 균사의 균총을 drilling method를 이용하여 DNA를 추출하였다(Chi et al., 2009). 추출한 DNA의 18S rRNA internal transcribed spacer(ITS), RNA polymerase II subunit 2(RPB2) 영역을 각각 ITS1(5' TCCGTAGGTGAACCTGCGG 3')와 ITS4(5' TCCTCCGCTTATTGATATGC 3'), RPB2-5f(5' GAYGAYMGWGATCAYTTYGG 3')와 RPB2-7cR(5' CCCATRGCTTGYTTRCCCAT 3')primer를 사용하여 polymerase chain reaction(PCR)을 통해 증폭하였고(Raja et al., 2017), 증폭된 DNA산물의 염기서열을 분석을 서울대학교 농업생명과학공공기기원(NICEM, Korea)에 의뢰하였다. 확인된 DNA염기서열은 Genbank database에 있는 종들 간의 유사도를 NCBI BLASTN(http://www.ncbi.nlm.nih.gov/)프로그램을 이용하여 확인하였고, 그 내용을 바탕으로 계통수를 작성하였다. 계통수는 MEGA7 프로그램을 이용하여 maximum-likelihood 방법으로 작성하였다(Kumar et al., 2016).
병원성 검정
병원성 검정에 사용할 agar plug를 얻기 위해, A. alternata KCA-1을 PDA 배지에 접종 후 25°C 배양기에 5일간 배양하였다. 배양된 A. alternata KCA-1의 균총 선단부를 직경 5 mm의 코르크 보러로 잘라 agar plug를 만들고, 이를 참취 잎 윗면에 접종하였다. 이후 접종한 agar plug 위에 멸균수 200 µL를 떨어뜨려 적셔주었다. Agar plug를 접종한 참취는 밀폐 용기에 실온에서 습실처리하여 4일 후 발병 여부를 확인하였다.
농약 종류에 따른 병원균 균사생장 억제효과 조사
병원균의 균사생장 억제 효과를 조사하기 위해 difenoconazole, streptomycin, kasugamycin, azoxystrobin, metconazole, cyprodinil, kresoxim-methyl 성분의 살균제를 사용하였다(Table 3). 살균제 배지는 멸균한 PDA가 적당히 식었을 때(약 55°C) 50 mL conical tube를 사용하여 25 mL을 맞추고, 각각의 살균제를 0.01, 0.1, 1, 10, 100, 1,000 µg/mL의 농도가 되도록 첨가하여 90 mm의 petri dish에 부어 만들었다. 이후 PDA배지에서 3일간 키운 A. alternata KCA-1의 균총 선단부를 직경 5 mm의 코르크 보러를 이용해 잘라 살균제 배지와 무처리 PDA배지 중앙에 접종하여 5일간 25°C에서 배양하였다. 살균제 배지에서 배양된 균들과 무처리 배지에서 배양한 균들의 균사 생장율을 비교하여 균사생장 억제율을 측정하였다. 실험은 3반복으로 진행하였고, Duncan multiple range test를 이용하여 통계 분석하였다.
균사 생장 억제율(%) = [1-(처리구 균사 생장 길이 ÷ 무처리구 균사 생장 길이)] × 100
결과 및 고찰
점무늬병의 발생 및 동정
강원도 춘천과 양구에서 점무늬병에 걸린 곰취와 참취 샘플을 채집하여 원인균에 대한 동정을 수행하였다(Fig. 1A, 1B). 병반조직을 표면살균한 후에 PDA배지에 치상하고 3일간 배양하였다. 이후 순수 분리를 위하여 단포자 분리를 수행하였고, 단포자를 PDA에 접종하였으며 3일 뒤 얻은 균사체로부터 DNA를 추출하였다. 균 동정을 위해서 18S rRNA의 ITS의 염기서열을 비교 분석하였다. 그 결과 총 6개의 참취 샘플 중 4개의 샘플에서 Alternaria, 2개의 샘플에서 Phoma가 검출되었다. 그리고 11개의 곰취 샘플 중 7개의 샘플에서 Alternaria, 4개의 샘플에서 Phoma가 검출되었다(Table 1).
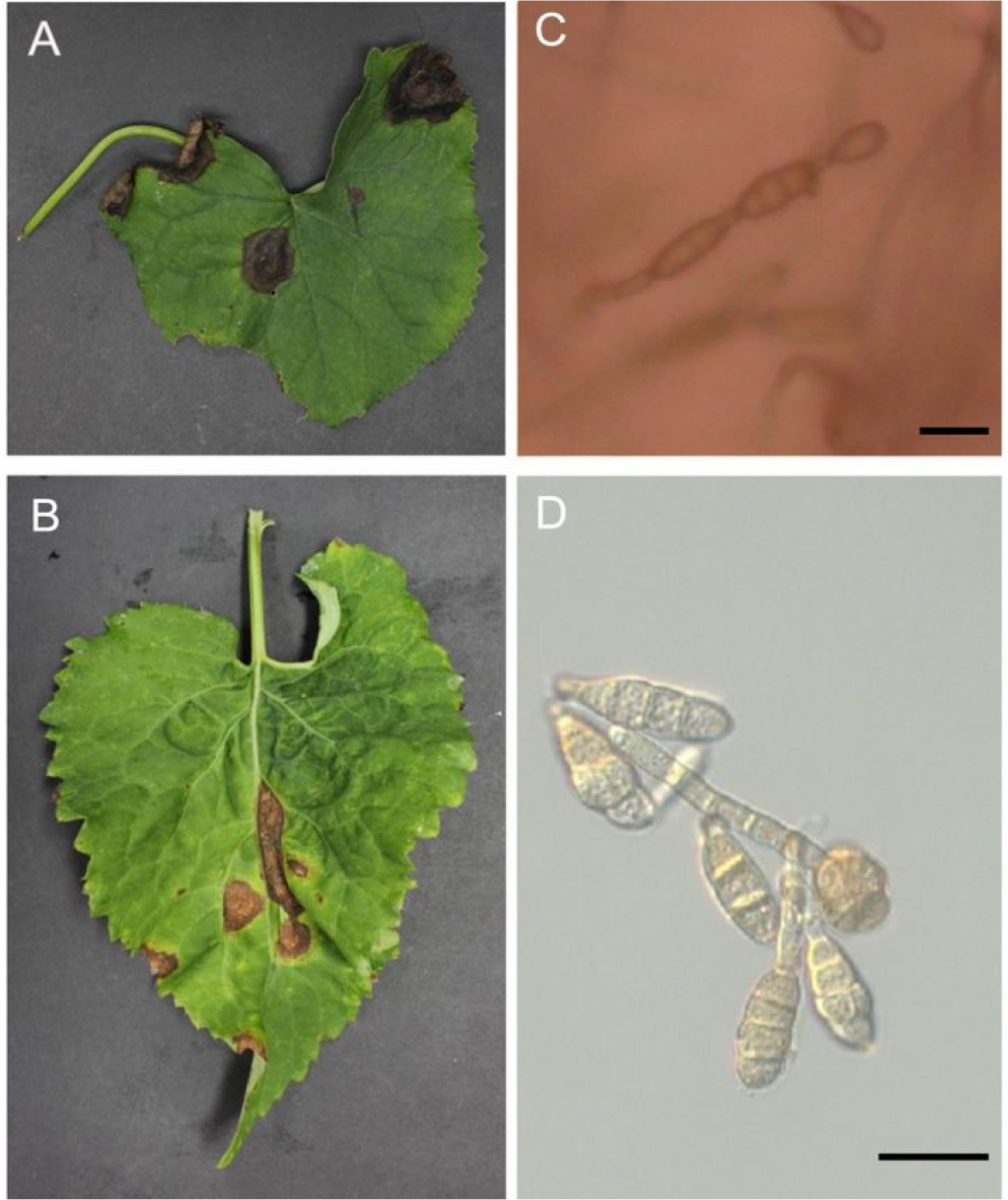
Fig. 1.
Leaf spot disease caused by Alternaria on Aster scaber and Ligularia fischeri. Morphological characteristics of A. alterrnata KCA-1. A and B, symptoms of Alternaria leaf spot on a L. fischeri leaf (A) and A. scaber leaf (B); C, Conidia in chains of A.alternata KCA-1; D, Conidia of A. alternata KCA-1. Bar = 20 µm.
Table 1.
Isolation and identification of fungal strains from infected plants
Alternaria 속으로 분류된 병원균들을 PDA에서 5일간 광조건에서 키워 분생포자를 관찰한 결과 곤봉 또는 난형 모양의 포자가 한 개 또는 여러 개가 연쇄상으로 관찰되었으며, 횡격막은 1-6개, 종격막은 0-3개가 관찰되었다(Fig. 1C, 1D). 이는 기존에 연구된 Alternaria의 형태학적 특성과 일치한다(Jeong et al., 2008; Woudenberg et al., 2013). 분자생물학적 종 동정을 위해 Alternaria species 유전자 염기서열 분석방법(Woudenberg et al., 2013)에 의거하여 ITS 및 RPB2 염기서열을 분석 후 기존에 알려져 있는 Alternaria spp.(Table 2)와 비교하였다. 그 결과 Alternaria 속에 속한 분리된 병원균들은 A. alternata CBS 916.96과 96%이상의 염기서열 상동성을 보여 Alternaria section alternata와 같은 계통군에 속함을 알 수 있었다(Fig. 2).
Table 2.
GenBank accession number used to analyze the phylogenetic tree in this study
병원성 검정
코흐의 가설을 바탕으로 분리한 병원균이 참취 점무늬병의 원인 균임을 증명하기 위하여, PDA에서 5일간 키운 KCA-1의 agar plug를 참취에 접종해 점무늬병의 발병여부를 확인했다. 접종 후 5일 뒤 참취 잎 앞면과 뒷면에 담갈색 내지 검은색 반점 형태의 병반이 관찰되었다(Fig. 3). 시간이 지남에 따라 검은색 병반은 원형 또는 불규칙한 형태의 동심원을 그리며 커지는 것을 확인했다. 이러한 특성은 기존에 보고되었던 Alternaria leaf spot의 병징(Abdessemed et al., 2019)과 일치했으며, 병원균을 분리하기 전 참취 점무늬병 병징과 유사하였다(Fig. 1A, 1B). 그리고 검은색 병반을 잘라 현미경으로 관찰한 결과 A. alternata KCA-1와 형태학적으로 같은 모양의 포자를 확인하였다. 그 병반으로부터 병원균을 다시 순수 분리해 ITS 와 RPB2 유전자의 염기서열을 분석한 결과, 분리된 병원균이 A. alternata KCA-1과 동일한 병원균임을 확인하였다. 지금까지의 병원성 검정 실험 결과를 바탕으로 A. alternata KCA-1이 참취에 점무늬병을 일으키는 병원균임을 증명하였다.

Fig. 3.
Pathogenicity test of A. alternata KCA-1 on A. scaber. 5 mm agar plugs of A. alternata KCA-1 were inoculated on A. scaber leaves and 200 µL of diluted water was dropped on the agar plugs. Leaf with leaf spot symptoms on abaxial (A) and adaxial surface (B). The experiment was conducted at 25°C in humid conditions. Photos were taken 4 days after inoculation.
농약 성분에 따른 균사생장 억제효과
A. alternata의 방제 대책을 제시하기 위하여 지금까지 Alternaria에 방제 효과가 있다고 보고된 7종의 살균제를 선발하였다(Table 3). 그리고 각각의 살균제를 포함하는 살균제 배지를 제작한 뒤, A. alternata KCA-1를 접종해 각 약제 별 균사생장 억제 효과를 조사하였다(Fig. 4, Fig. 5). 그 결과, metconazole이 1,000 µg/mL와 100 µg/mL에서는 100%, 10 µg/mL에서는 85.5%의 억제율을 보이며 10 µg/mL 이상에서 다른 살균제에 비해 매우 높은 억제율을 보였다. Difenoconazole은 1 µg/mL 이하에서 metconazole과 통계적으로 유사한 억제율을 보여주었고, 10 µg/mL 이상에서는 70% 이상의 억제율을 보여주었다. Cyprodinil은 0.01 µg/mL와 0.1 µg/mL에서는 5% 이하의 억제율을 보여주었으나 1 µg/mL에서는 difenoconazole과 metconazole과 유사한 수준의 억제율을 보였고 10 µg/mL에서는 79.5%, 100 µg/mL과 1,000 µg/mL에서는 80% 이상의 높은 억제율을 보였다. Kasugamycin은 100 µg/mL 이하의 농도에서 다른 살균제에 비해 비교적 낮은 억제율을 보였으나, 1,000 µg/mL에서는 100% 억제율을 보였다. Azoxystrobin과 kresoxim-methyl은 metconazole과 비교했을 때 0.01 µg/mL에서 통계적으로 유사한 수준의 억제율을 보였으나, 이후 농도가 증가함에 따라 억제율의 증가 폭이 크지 않았으며 가장 높은 농도인 1,000 µg/mL에서 50% 이하의 억제율을 보였다. Streptomycin은 0.01 µg/mL부터 100 µg/mL까지 10% 이하의 억제율을 보이고, 1,000 µg/mL에서도 25.3%의 다른 살균제에 비해 가장 낮은 억제율을 보였다.
Table 3.
Fungicides used in this study
| Chemical group | Active ingredient | Concentration (%) | Formulation1) |
| Triazole | Difenoconazole | 10 | WP |
| glucopyranosyl antibiotic | Streptomycin | 20 | WP |
| hexopyranosyl antibiotic | Kasugamycin | 10 | WG |
| Strobilurin | Azoxystrobin | 21.7 | SC |
| Triazole | Metconazole | 20 | SC |
| anilino-pyrimidine | Cyprodinil | 50 | WG |
| Strobilurin | Kresoxim-methyl | 44.2 | SC |
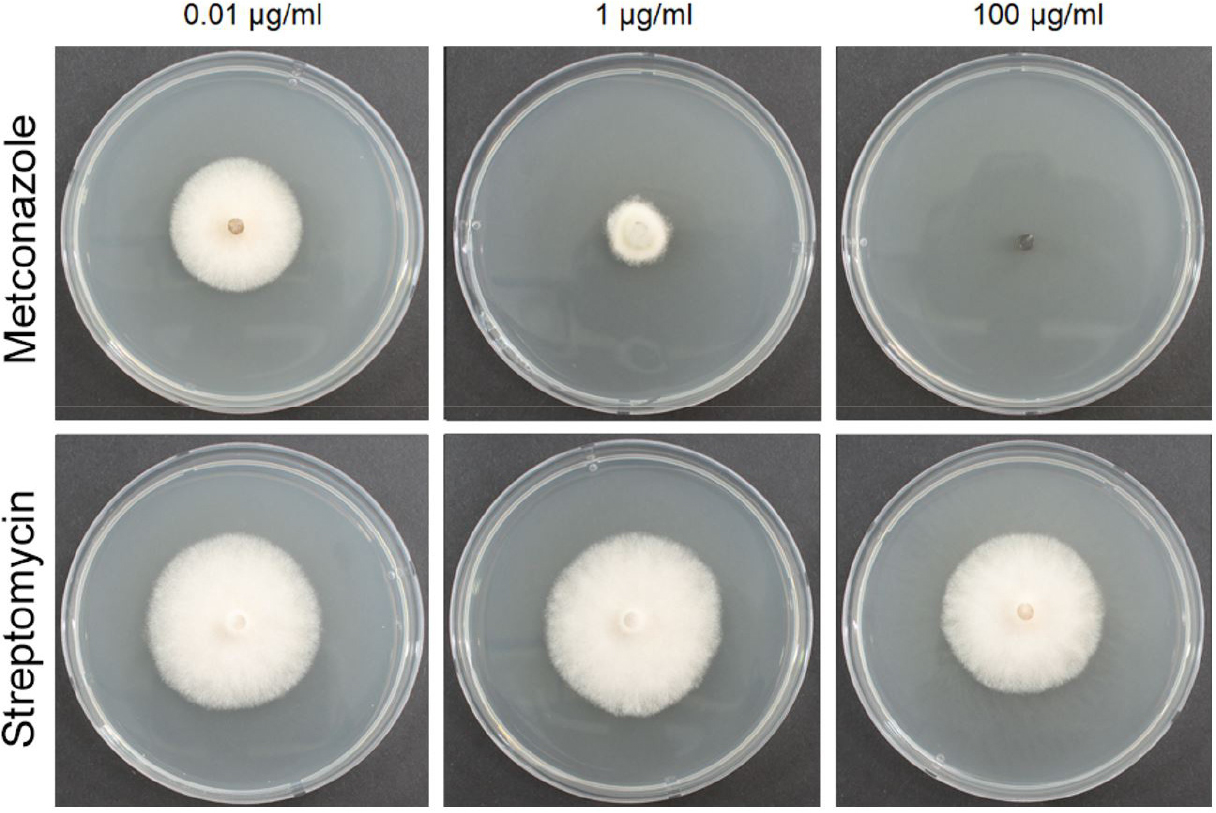
Fig. 4.
Effectiveness of metconazole and streptomycin on mycelial growth inhibition of A. alternaria KCA-1. Five millimeter agar plugs of A. alternata KCA-1 were inoculated on potato dextrose agar plates which contain metconazole or streptomycin. The experiment was conducted at 25°C. Photos were taken 4 days after inoculation.
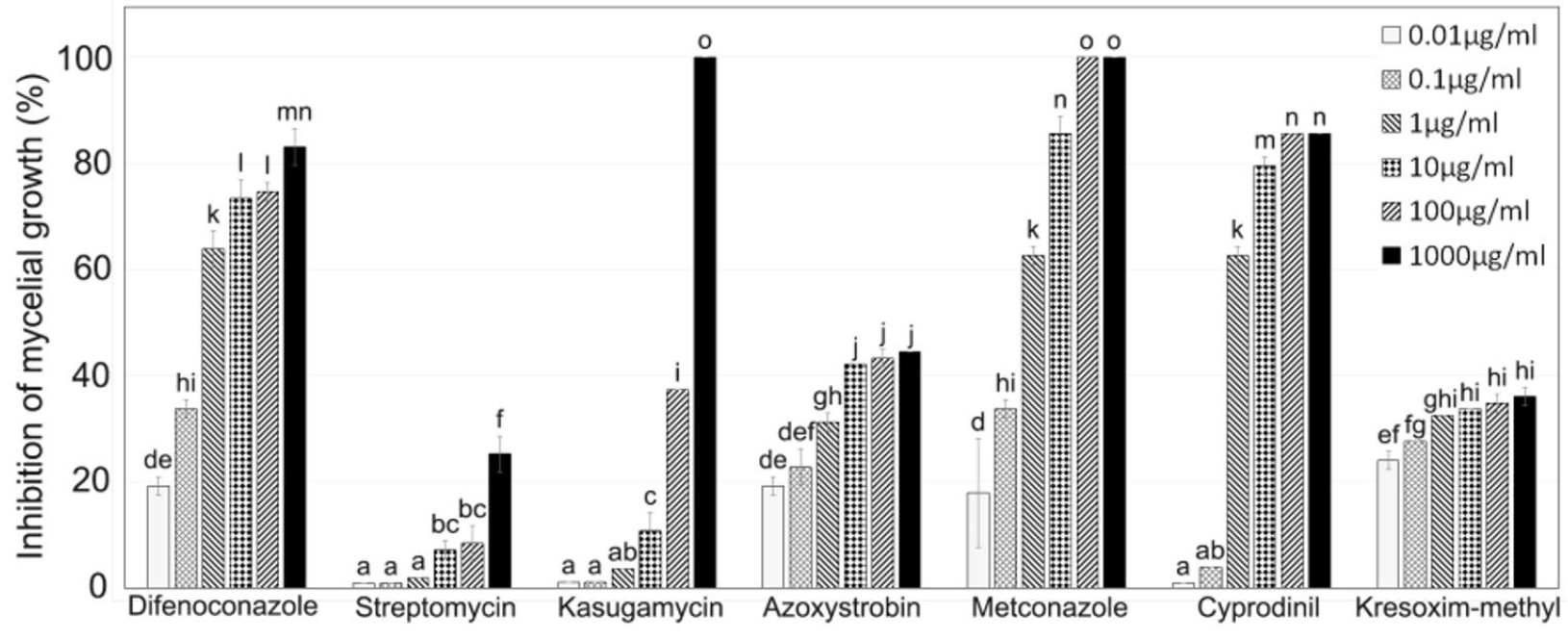
Fig. 5.
Effectiveness of several fungicides on mycelial growth inhibition of A. alternaria KCA-1. Each concentration of fungicide suspensions was mixed with autoclaved PDA. Colony diameters were measured 4 days pest after inoculation. All experiments were repeated thrice. Duncan's multiple range test using the SigmaStat statistical software package (SPSS Inc.) was used to be analyze the data and the same letters denote no significant differences at a p value = 0.05.
Alternaria alternata는 여러 기주에서 점무늬병을 일으키는 것으로 알려졌으나(Abdessemed et al., 2019; Tziros, 2013), 지금까지 A. alternata가 곰취 또는 참취에 점무늬병을 일으키는 것은 보고된 적이 없었다. 본 연구에서 실험을 진행한 결과 A. alternata 또한 참취의 주요 병원균으로서 점무늬병을 일으켜 작물의 상품성을 떨어뜨리는 것을 확인하였다. 따라서 A. alternata에 초점을 맞춘 방제 대책 또한 마련해야할 것으로 사료된다. 화학적 방제 대책을 제시하기 위해 실험한 결과, 에르고스테롤 생합성과 관련되어 있는 metconazole(Duan et al., 2018)과 difenoconazole (Hagan et al., 1991) 그리고 메싸이오닌 생합성과 진균 가수분해 효소의 분비를 억제하는 cyprodinil(Fenoll et al., 2011)이 A. alternata를 방제하기 위한 적합한 살균제로서 작용한다고 생각된다. 나아가, 현재 유기농 재배 작물의 선호도가 높아지고 있음에 따라 화학적방제 뿐만 아닌 친환경적인 생물학적 방제에 대한 연구가 활발히 진행되고 있다. 특히 최근에 취나물과 관련되어 Enterobacter asburiae ObRS-5가 곰취에 뿌리썩음병을 일으키는 Phytophthora drechsleri의 zoosporangia 형성과 zoospore의 발아를 억제한다는 보고가 있다(Kim et al., 2020). 따라서 A. alternata의 생물학적 방제에 관한 연구도 진행될 필요가 있다고 사료된다.
요약 및 결론
본 연구는 강원도 춘천과 양구에서 문제가 되고 있는 곰취와 참취 점무늬병의 원인 균을 파악하기 위해, 병반으로부터 병원균을 순수 분리 후 동정하였다. 그 결과 A. alternata와 Phoma sp.가 검출되었으며 특히 A. alternata의 비율이 Phoma sp.에 비해 높은 것을 확인하였다. 이후 코흐의 가설을 토대로 참취에 접종하여 확인한 결과 참취 점무늬병을 일으키는 병원균임을 확인하였다. 지금까지 A. alternata에 의한 취나물 점무늬병을 방제하기 위해 등록된 약제가 등록되어 있지 않기 때문에, 7종류의 살균제를 선발하여 균사 생장 억제 실험을 진행하였다. 그 결과 metconazole 이 농도 10 µg/mL에서는 85.5%, 1,000 µg/mL와 100 µg/mL 에서는 100%의 억제율을 보이며 다른 살균제들에 비해 높은 균사생장 억제 효과가 나타났다. 그리고 difenoconazole과 cyprodinil 또한 10 µg/mL에서는 70% 이상, 1,000 µg/mL에서는 80% 이상의 높은 균사생장 억제율을 보였다. 이러한 실험 결과는 취나물류의 Alternaria에 의한 점무늬병 방제를 위한 기초자료로 활용될 것으로 사료된다.





