서 론
재료 및 방법
상추 재배 시험
토양 분석
식물체 분석
통계분석
결과 및 고찰
토양 물리적 특성 변화
토양 화학적 특성 변화
토양 생물학적 특성 변화
하이드로겔 처리에 따른 식물체 특성 변화
결 론
서 론
최근 지구온난화로 인해 전 세계적으로 극단적인 기상현상의 빈도가 증가하고 있다(D’Amato and Akdis, 2020). 우리나라에서도 위험기상의 강도와 빈도 및 지속 기간이 변화하고 있으며, 특히 집중호우나 폭염 발생 일수와 빈도가 뚜렷하게 증가하고 있는 추세이다(Ho et al., 2023). 이 중 폭염 발생 일수와 빈도의 증가는 가뭄 발생 빈도 증가로 이어질 수 있으며, 가뭄이 발생하는 지역에 위치한 농경지는 물 부족으로 인해 작물 생산량이 감소하게 되고 이는 환경뿐만 아니라 경제, 사회적 문제를 초래할 수 있다(Kim et al., 2022a; Saha et al., 2020).
가뭄은 사질 토양이 주로 분포하는 지역에서 심각한 문제가 될 수 있는데 이는 사질 토양이 공극이 커 배수가 빠르게 일어나 수분보유능력이 낮기 때문이다(Baiamonte et al., 2019). Cho et al.(2012)의 연구에 따르면 우리나라 농경지의 물리적 특성은 토지이용형태에 따라 차이가 있지만 밭 토양의 80-90%가 사양질과 사질의 토성으로 보고하였다.
토양 수분을 관리하기 위한 관행적인 방법으로는 작물의 잔해, 짚, 기타 유기물 또는 폴리에틸렌 필름 등을 토양 표면에 덮는 멀칭을 사용하고 있다(Gao et al., 2014). 그러나 폴리에틸렌과 같은 플라스틱 필름은 사용이 쉽다는 편리성이 있지만 폐기물 발생의 문제와 더불어 토양에서 분해되며 미세플라스틱이 유입되면서 토양건강성 악화 및 새로운 환경문제가 되고 있다(Machado et al., 2018). 이러한 단점을 완화하기 위해 최근에는 토양의 수분보유능력을 향상시킬 수 있는 바이오차, 하이드로겔 등과 같은 다양한 소재에 대한 연구가 진행되고 있다(Mohawesh and Durner, 2019).
고흡수성 고분자물질(SAPs; superabsorbent polymers)인 하이드로겔은 초기 질량 대비 400-1,600배에 달하는 물을 흡수할 수 있어 토양개량제로 활용하는 연구가 활발히 이루어지고 있다(Adjuik et al., 2023; Ahmed, 2015; Mohawesh and Durner, 2019). 하이드로겔을 토양에 처리할 시 용적밀도를 감소시키고, 다공성과 수분보유능력을 증가시키는 등 토양의 물리성을 개선시켜 작물 생장에 적합한 환경을 조성할 수 있다(Akhter et al., 2004; Basuki et al., 2015). 이러한 하이드로겔의 물리성 개선 및 수분보유능력 증진 효과는 가뭄에 의한 작물의 수분 스트레스를 감소할 수 있는 수단 중 하나로 여겨진다(Guo et al., 2020).
하지만 기존의 하이드로겔은 물성이 약할 뿐만 아니라 토양에 처리시 쉽게 분해되기 때문에 합성에 사용된 원료물질(acrylic acid, polyacrylamide 등)이 방출되면서 다양한 환경적 문제(독성, 오염 등)가 발생할 수 있다. 따라서 이를 해결하기 위해 하이드로겔 생산 시 환경친화적 원료물질의 탐색이 요구되고 있다(Song et al., 2020). 현재 환경친화적인 원료물질로 점토 광물인 라포나이트, 벤토나이트 등이 활용되고 있으며(Li et al., 2023), 이 중 라포나이트를 기반으로 합성한 하이드로겔은 기존의 하이드로겔 보다 높은 인장강도와 신축성 뿐만 아니라 향상된 경도로 인해 경운과 같은 외부 영향에 대해서도 안정적인 것으로 알려져 있다(Gao et al., 2021). 이로 인해 라포나이트 기반 하이드로겔(laponite hydrogel; LHD)을 토양에 처리하면 토양 수분 보유능에 많은 기여를 할 것으로 판단되나 LHD처리에 따른 토양의 특성 변화와 작물 생육에 관한 연구는 부족한 실정이다.
따라서 본 연구는 라포나이트 하이드로겔을 사질 토양에 처리하였을 때 토양 특성 변화와 작물 생육에 미치는 영향을 조사하여, 토양개량제로의 활용 가능성을 평가하고자 수행하였다.
재료 및 방법
상추 재배 시험
상추 재배 시험은 강원도 춘천시(37.9°N 127.7°E)에 위치한 강원대학교 부설농장에서 수행하였다. 연구기간은2022년 09월 27일부터 11월 07일(7주)까지 진행되었으며, 대상지역의 평균 온도는 13.0°C, 총 강수량은 54.5 mm, 평균 강수량은 5.9 mm이었다(KMA, 2022).
연구에 사용된 라포나이트 하이드로겔(LHD; Na0.7[(Mg5.5Li0.5Si8)O20]0.7)은 ㈜테라그린으로부터 제공받아 사용하였으며 LHD 제조 시 라포나이트는 직경 25 nm, 높이 1 nm 의 판상체를 활용하였다(Kim et al., 2022b).
처리구의 구성은 LHD 처리 수준을 0.25%, 0.5% 및 1%(w/w)로 달리하였고, 토양 20 cm 깊이에 처리하였다. 각 처리구당 면적은 1 m2(1 m × 1 m)로 임의배치법에 의하여 3반복 배치하였다. 모든 처리구는 토양 이화학적 특성(Table 1)에 따라 NPK 시비량을 산출하여 요소 12 kg 10 a-1, 용성인비 13 kg 10 a-1, 황산칼륨 4.8 kg 10 a-1을 기비 처리하였다.
Table 1.
Physicochemical properties of the soil used in this study
|
pH - |
EC dS m-1 |
SOM g kg-1 |
Avail. P2O5 mg kg-1 |
CEC cmolc kg-1 | Soil Texture |
| 5.5 ± 0.02 | 0.3 ± 0.1 | 13.9 ± 0.3 | 221.4 ± 37.2 | 5.9 ± 0.2 | Sandy loam |
2022년 09월 27일에 묘를 정식하여 49일간 재배 후 11월 07 일에 수확하였다. 재배 시험에 사용한 작물은 상추(Lactuca sativa L.)로 재식 거리 30 × 30 cm 로 49일간 생육시켰으며, 처리구당 10 L관수를 1회 진행 후 자연 강우에 의존하였다.
토양 분석
토양은 상추 재배 후 채취하여 그늘진 곳에서 풍건하였다. 이후 2 mm(10 mesh) 체거름하여 폴리에틸렌 지퍼백에 보관하여 분석에 사용하였다. 생물학적 분석을 위한 일부 토양 시료는 채취 즉시 4°C 이하로 냉장보관하여 분석에 사용하였다.
토양의 물리적 특성은 농촌진흥청의 토양 및 식물체 분석법에 준하여 수행하였다(NAS, 2000). 토성은 토양에 분산제(95% sodium hexametaphosphate(NaPO3)6 + sodium carbonate(NaCO3)를 가하는 비중계법으로 측정하였다. 용적밀도(bulk density; BD)는 부피를 정확히 아는 core를 사용하여 현장에서 core에 토양을 채취한 후 105°C 로 16시간 이상 건조한 core의 무게를 core의 부피로 나누어 계산하였다. 수분함량은 core에 포함되어 있는 토양의 건조 전 중량과 건조 후 중량의 통해 계산하였다. 이후 식 (1)에 따라 water filled pore space를 산출하였다.
토양의 화학적 특성은 농촌진흥청의 토양화학분석법에 준하여 수행하였다(NAS, 2000). 토양 pH와 전기전도도(electrical conductivity; EC)는 건조 토양과 증류수 1:5(w/v)의 비율로 혼합하여 30분간 진탕 후 pH/EC meter (Thermo-Orion, Orion Star A215, USA)로 측정하였다. 유기물(soil organic matter; SOM)은 Tyurin 법을 참고하여 K2Cr2O7로 산화한 후 여액을 UV/Vis spectrophotometer(UV-1280, Shimadzu, Japan)로 측정하였다. 유효인산 (Available P2O5; Av. P5O5)은 Bray No.1 방법으로 추출하여 SnCl2에 의한 몰리브덴 청법으로 발색시켜 UV/Vis spectrophotometer로 측정하였다. 교환성 양이온(Exchangeable cation; Exch. cation)은 토양에 1 N Ammonium acetate(pH 7.0)을 1:5(w/v)의 비율로 혼합하여 교반 후 여과하여 ICP-OES(iCAP Duo6300, Thermo, USA)로 Ca, K, Mg를 정량하였다. 양이온교환용량(Exchangeable cation capacity; CEC)은 교환성 양이온(Exch. K+, Ca2+, Mg2+) 농도와 여과액의 pH로 산출하였다.
토양의 생물학적 특성 중 phosphatase는 Tabatabai and Bremner(1969)가 제시한 방법에 따라 생토 1 g에 0.25 mL toluene, 4 mL p-nitrophenyl phosphate 및 4 mL modified universal buffer(MUB, pH 6.0)를 첨가하여 37°C에서 1시간 동안 배양 후, 4 mL 0.5 M NaOH와 1 mL 0.5 M CaCl2를 첨가해 여과 후 여액을 UV/Vis spectrophotometer 로 비색 정량하였다. β-glucosidase는 Hayano(1973)가 제시한 방법에 따라 생토 1 g에 0.25 mL toluene을 첨가한 후 15분 교반하였다. 교반 후 4 mL MUB 와 1 mL p-nitrophenyl-β-D-gulcoside 용액을 첨가한 뒤 37°C에서 1시간 동안 배양하였다. 배양 후 1 mL 0.5 CaCl2와 4 mL 0.1 M THAM(pH 12)을 첨가하고, 여과 후 여액을 400 nm에서 UV/Vis spectrophotometer로 비색 정량하였다. Urease는 Kandeler and Gerber(1988)의 분석법에 따라 플라스크에 습토 5 g 취하고 79.9 mM Urea 2.5 mL를 넣어 섞어준 후 37°C에서 2시간 교반하였다. 이후 증류수 2.5 mL + KCl 50 mL 첨가한 뒤 30분간 교반하여 여과하였다. 여과액 1 mL와 9 mL D.W + 5 mL Reagent A(0.3 M NaOH 100 mL + Sodium salicylate solution 100 mL + 증류수 100 mL) + 39.1 mM dichloroisocyanurate solution 2 mL를 test tube에 넣어 섞어준 후 30분간 교반하고 UV-Vis spectrophotometer로 파장 690 nm에서 비색 정량하였다. Dehydrogenase는 Rossel and Tarradellas(1991) 분석법에 따라 습토 20 g과 CaCO3 0.2 g을 혼합하여 6 g씩 3개의 시험관에 분취한 후 3% TTC(2,3,5-Triphyenyl tetrazolum chloride, TTZ) 시약 1 mL와 증류수 2.5 mL를 가하여 유리막대로 섞어주었다. 충분히 섞은 후 입구를 밀봉하고 37°C에서 24시간 배양 후 methanol 10 mL를 가한 후 1분 교반하였다. 플라스크 입구를 탈지면으로 막은 funnel을 놓고, 혼합물을 여과하였다. 탈지면에 지속적으로 methanol을 넣어주며 100 mL 표선 후, UV-VIS spectrophotometer로 파장 485 nm에서 비색 정량하였다. 토양 호흡량은 Anderson(1982)의 분석법을 참고하여 습토 50 g을 300 mL bottle에 넣은 후 0.5 M NaOH 10 mL를 넣은 15 mL glass vial를 300 mL bottle에 위치시켜 밀봉한 후 25°C에서 72시간 배양하였다. 배양 후 vial에 들어있는 NaOH 용액을 100 mL 비커로 옮긴 후 phenolphthalein(99% ethanol 90 mL + D.W 10 mL + phenolphthalein 0.1 g)을 1-2방울 넣고, 자색에서 무색으로 변할 때까지 1 M HCl로 적정하였다. 그 후 bromocresol green 시약을 2-5방울을 넣고 청색에서 황색으로 변할 때까지 0.2 M HCl로 적정하였다. 이때, 소모된 적정량을 이용하여 CO2의 양을 계산하였다. Colony forming unit(CFU)는 Chander et al.(2005) 분석법에 따라 50 mL conical tube에 습토 3 g을 취하고 멸균 증류수 27 mL를 넣어주어 10분간 진탕하여 1차 희석액을 만들었다. 그 후 1차 희석액 0.1 mL를 다른 50 mL conical tube에 취한 후 멸균 증류수 9.9 mL를 넣어 진탕한 후 희석액 0.2 mL를 tryptic soy agar 배지에 접종한 후 25°C에서 24시간 배양하였다.
식물체 분석
상추는 수확 후 흐르는 물에 세척한 후 수분을 충분히 제거하여 생중량을 측정한 뒤 60°C dry oven에서 3일간 건조 시킨 후 건중량을 측정하였다. Leaf-proline(L-proline)은 작물이 수분 스트레스를 받으면 잎에 축적되는 물질로 LHD 처리가 작물의 수분 스트레스 해소에 미치는 영향을 확인할 수 있는 중요한 지표이다(Wang et al., 2022). L-proline 분석은 수확한 상추를 세척 후 액체질소로 동결시킨 뒤 분쇄하여 Bates et al.(1973)가 제시한 분석법에 따라 분석하였다. 동결 분쇄한 상추 시료 1 g에 3% sulfosalicylic acid 용액 10 mL를 첨가하여 24시간 동안 상온에 방치한 후 여과지(Whatman No. 42)로 여과하였다. 여과액 1 mL를 시험관에 옮긴 후 99.8% glacial acetic acid 용액 1 mL와 4.2% ninhydrin reagent 1 mL를 첨가하고 시험관을 밀폐하여 100°C의 끓는 물에서 1시간 동안 반응시킨 뒤 21°C 의 상온에서 5분간 방치하였다. 이후 시험관에 99.7% toluene 2 mL를 첨가하여 20초 동안 교반 후 상등액을 취해 520 nm 파장에서 UV/Vis spectrophotometer로 측정하였다.
통계분석
LHD 처리가 토양의 특성에 미치는 영향을 비교하기 위하여 SAS 9.4(SAS institute, USA)를 이용하여 일원배치 분산분석(One-way ANOVA)을 진행하였고, 사후검정은 Duncan test를 통해 P < 0.05 수준에서 유의성을 판단하였다.
결과 및 고찰
토양 물리적 특성 변화
토양의 물리적 특성을 분석한 결과 LHD 처리량이 증가함에 따라 토양의 용적밀도와 수분함량에 유의적 변화가 있는 것으로 나타났다(Table 2). Đurović et al.(2012)는 사질 토양에 하이드로겔을 처리한 결과 용적밀도가 27% 감소하는 것으로 보고하였으며, 본 연구에서도 용적밀도는 무처리구에서 1.56 g cm-3인 반면 LHD 0.5%, 1% 처리구에서 1.38 g cm-3, 1.22 g cm-3으로 각각 12%, 22% 감소하였다. 이는 수분공급을 통한 하이드로겔의 팽창과 수축 과정이 반복되면서 토양 공극률의 증가하고 이로 인해 용적밀도가 감소하는 것으로 판단된다. 하지만 토양의 용적밀도가 너무 낮을 경우 작물 생장에 오히려 부정적인 영향을 미칠 수 있고(Blanco-Canqui, 2017), Jaggi et al.(1972)는 그 수준을 1.1 g cm-3 이하일 때 모세관 현상이 발달하지 못하기 때문으로 보고했다. 따라서 본 연구대상 토양에 LHD를 1% 이상 처리하면 토양의 용적밀도 감소로 인해 작물 생장에 불리한 결과를 초래할 수 있을 것으로 판단된다.
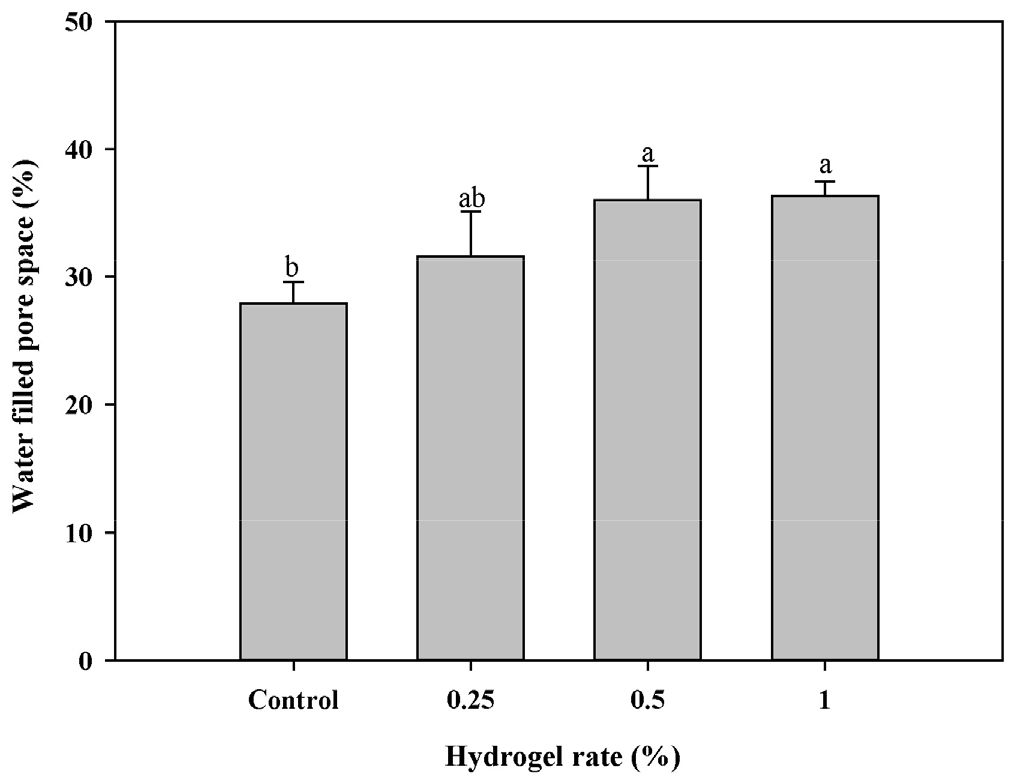
상추 수확 후 동일한 시점에 채취한 각 토양의 water filled pore space의 결과는 Fig. 1과 같으며, 무처리구에서 27.9%이었고, LHD 0.5%, 1% 처리구에서 36.0%, 36.3%로 LHD 처리량이 많을수록 증가하는 경향을 나타냈다. Hüttermann et al.(1999) 또한 사질 토양에 하이드로겔을 0.4%(w/w) 처리하였을 때 양토 또는 미사질식토 수준으로 수분보유력을 증가시킨다고 보고하였다.
Table 2.
Variation in physicochemical properties of soil after lettuce cultivation as affected by laponite hydrogel treatment
토양 화학적 특성 변화
연구 대상 지역에 LHD 처리 시 토양의 화학적 특성은 처리구 간 유의한 차이를 보이지 않았으며(Table 2), 이는 선행연구에서도 유사한 결과를 확인할 수 있었다(Jeevan et al.,2023; Orikiriza et al., 2013; Ritonga et al., 2019). 하지만 일부 선행연구에서는 하이드로겔 처리가 pH, EC 및 교환성 양이온 함량에 영향을 주는 것으로 보고된 바 있다(Jeevan et al., 2023; Saini et al., 2020). 이는 하이드로겔에 사용되는 원료물질이나 합성 방법에 따라 달라지는 하이드로겔의 특성에 의해 토양에 미치는 영향 또한 달라지는 것으로 판단된다.
토양 생물학적 특성 변화
각 처리구별 LHD 처리량에 따른 토양의 생물학적 특성 변화는 Table 3에 나타냈다. 이 중 phosphatase는 무처리구 대비 1% LHD 처리 토양에서 18% 증가하는 것을 확인할 수 있었다. Liu et al.(2013)는 phosphatase가 토양의 용적밀도와 음의 상관관계를 나타낸다고 보고하였으며, Sardans et al.(2006)은 토양수분함량과 양의 상관관계를 나타낸다고 보고하였다. 따라서 본 연구에서도 LHD처리에 따른 토양의 용적밀도 감소와 토양수분함량 증가로 인해 토양의 phosphatase가 증가하는 것으로 판단된다.
Table 3.
Changes in biological properties of soil after lettuce cultivation as affected by laponite hydrogel treatment
Lozano et al.(2021)는 가뭄 환경에 노출된 토양 내에서 β-glucosidase 활성이 35% 감소하였다고 보고하였는데, 본 연구에서는 LHD 0.25%, 0.5% 및 1% 처리구는 무처리구 대비 β-glucosidase 활동이 24.4%, 8.4%, 30.8% 증가하였다. 이는 LHD 처리구의 토양수분함량 증가로 β-glucosidase 의 활성이 증가하는 것으로 판단된다. 이 외에도 dehydrogenase는 무처리구 대비 LHD 0.25%, 0.5% 및 1% 처리하였을 때 1.9-3.7배 증가하였는데, 이와 같은 결과도 토양의 수분함량과 연관이 있는 것으로 보인다. 실제로 Borowik and Wyszkowska(2016)의 연구 결과에서는 토양 수분함량이 건조 토양 대비 20% 높을 때 dehydrogenase의 활동이 11.6% 증가하였다. 하지만 토양 수분 함량 증가는 urease 활성과 양의 상관관계를 보인다는 선행 연구결과(Abay et al., 2022) 와는 달리 본 연구에서는 처리구간 urease 함량의 유의한 차이를 관찰하지 못하였다.
토양 호흡량은 LHD를 1% 처리하였을 때 무처리구 대비 57% 증가하였으며, 이는 토양 수분의 증가와 용적밀도의 감소로 인해 토양 내 미생물의 호흡에 긍정적인 역할을 했기 때문으로 판단된다(Huang et al., 2022). CFU는 무처리구 대비 LHD를 처리하였을 때 모든 처리구에서 4배 이상 증가하였다. Tomadoni et al.(2020)은 토양에 alginate 기반 하이드로겔을 5%(w/w) 처리하였을 때 무처리구 대비 곰팡이, 박테리아, 방선균의 수가 각각 28%, 30% 38% 증가하였고, 미생물군의 증가는 작물 성장, 생산성 및 환경 스트레스에 대한 저항성을 높인다고 보고하였다.
하이드로겔 처리에 따른 식물체 특성 변화
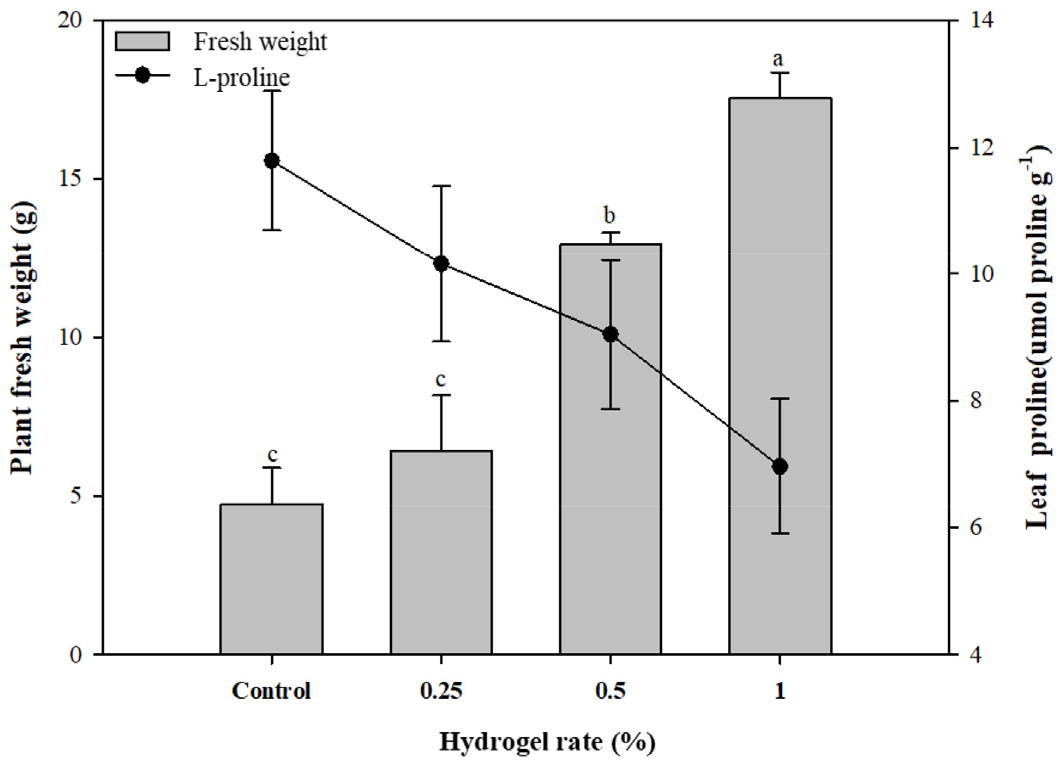
각 처리구에서 재배한 상추의 생중량을 조사한 결과 무처리구 대비 LHD 1% 처리구에서 상추의 생중량이 약 3.7배 높게 나타났다(Fig. 2). 이는 LHD 처리로 인해 토양의 수분보유능 및 토양 효소활성 증가로 인해 상추의 생장이 증가한 것으로 판단된다. 또한 LHD 처리량이 증가 함에 따라 상추 내 L-proline 함량이 감소하는 것을 관찰할 수 있었다(Fig. 2). L-proline은 일반적으로 식물의 삼투 작용을 조절하는 인자로 알려져 있으며(Reddy et al., 2015), 건조한 토양 환경에서 L-proline은 식물 잎에 축적되기 때문에 식물의 가뭄 스트레스 인자로 활용될 수 있다(Claussen, 2005; Van Heerden and de Villiers, 1996). Arteaga et al.(2020)은 건조 스트레스 환경 하에 콩과 상추(Phaseolus vulgaris L.)을3주간 재배하였을 때 건조 스트레스가 없는 조건 대비 상추의 L-proline 함량이 2주차 31.67 µmol g-1 DW에서 86.61 µmol g-1 DW로 273.5% 증가하였다. 결과적으로 본 연구에서 토양에 처리한 LHD가 토양 수분함량을 증진시키면서 작물의 수분스트레스가 줄어들었고 이로 인해 L-proline 함량이 감소한 것으로 나타났다.
결 론
본 연구는 고분자 합성 물질인 LHD를 토양에 처리시 토양의 물리・화학・생물학적 특성 변화와 작물의 생육에 미치는 영향을 조사하고자 수행하였다. 비록 LHD처리가 토양의 화학적 특성에 미치는 영향은 미비하였으나, 토양의 수분함량을 포함해 물리성과 생물학적 특성은 LHD 처리에 따른 개선 효과를 확인할 수 있었으며, 상추의 생육에도 긍정적인 영향을 보였다. 하지만 본 연구 결과에서 보여준 바와 같이 LHD의 처리량이 증가할수록 토양 용적밀도는 감소하기 때문에 LHD를 과다하게 처리하는 것은 식물 뿌리 활착 및 생장에 악영향을 미칠 수 있다. 따라서 향후 LHD의 적정 사용량 설정 및 연용에 따른 효과 지속성에 대한 연구가 필요할 것으로 사료된다.