서 론
재료 및 방법
실험동물
대장염 유도 및 시료물질 투여
Disease activity index(DAI) 측정
채혈 및 장기 적출
혈장 TNF-α, IL-6, IL-1β 및 대장조직의 MPO, PGE2 분석
조직 병리학적 분석
통계 방법
결과 및 고찰
DAI 측정
혈장 TNF-α, IL-6, IL-1β
대장길이 및 대장조직의 병리학적 분석
대장조직의 MPO, PGE2분석
요약 및 결론
서 론
염증성 장질환은 궤양성 대장염(ulcerative colitis)과 크론병(Crohn’s disease)을 포함하는 포괄적인 질환으로 임상적으로 심한 복통, 설사, 피로감, 체중 감소를 특징으로 한다(Kane et al., 2001). 궤양성 대장염은 직장과 결장에서 발생되는 재발성 만성 염증질환으로 정확한 원인은 아직 밝혀지지 않았으나, 환경적· 유전적 요인과 함께 자가면역질환 등이 원인으로 추정되고 있다(Baumgart and Carding, 2007). TNF-α는 궤양성 대장염의 염증반응에서 매우 중요한 표적인자로, 대장염 환자의 혈액과 분변, 점막에서 TNF-α 농도가 증가되고, 점막 상피조직의 세포 자멸사를 유도한다는 연구가 보고되었다(Alabi et al., 2018; Sartor, 2006). 또한, 염증성 장질환은 염증물질에 의해 장 투과성이 증가되고 장점막 상피조직이 손상되어 장내미생물에 의해 TNF-α, IL-6, IL-1β와 같은 염증성 사이토카인의 생성이 증가하게 된다(Papadakis and Targan, 2000). 궤양성 대장염을 완치할 수 있는 치료법은 아직 없으며, 약물 치료에는 항염증제(sulfasalazine, mesalazine), 부신피질 호르몬제 등이 사용되고 있다. 그리고, 환자의 상태에 따라 면역 억제제, 항생제, 기타 여러 가지 약물을 적절히 선택하여 사용하고 있으나(Melgar et al., 2008), 이들 약물치료에는 많은 부작용이 있어, 장기치료를 요하는 염증성 장질환에는 적절하지 않다. 최근에는 이러한 약물치료의 부작용을 완화시키고, 장기간 치료에 효율적인 소재 개발을 위한 많은 연구들이 보고되고 있다(Kim et al., 2020; Miao et al., 2021; Xia et al., 2020).
스피루리나(Spirulina, SP)는 Arthrospira platensis와 Arthrospira maxima의 남세균으로, 세계 미세조류 바이오매스 생산량의 30% 이상을 차지하고 있다(Costa et al., 2019). 또한, 스피루리나는 FDA 인정 식품첨가 안전물질(Generally Recognized as Safe, GRN No. 127)로 인증되었으며, 영양학적으로 필수아미노산을 함유한 고단백, 필수지방산, 무기질, 비타민, 폴리페놀 함량이 높은 식품이다(Nuhu, 2013). 스피루리나는 대사성 질환, 간보호, 항암, 항염증, 항산화 활성 등 다양한 약리활성을 나타내어 건강기능식품 소재로 다양하게 사용되고 있다(Karkos et al., 2011; Lafarga et al., 2020). 블루스피루리나(Blue spirulina, BS)는 스피루리나에서 추출·정제한 phycobiliprotein인 phycocyanin성분을 일컫는 상품용어이다. 블루스피루리나는 ROO-, OH-, ONOO-을 포함하는 라디칼 소거활성과 항산화 활성이 높아 항염증, 항암, 면역조절을 위한 치료적 가치가 매우 뛰어나며(Wu et al., 2016), 블루스피루리나의 파란색소와 형광성은 식품 및 생물공학 응용분야에까지 폭넓게 활용되고 있다(Guzmán et al., 2003). 블루스피루나는 염증유발물질 glucose oxidase, carrageenan, CCl4, endotoxin, zymosan 등을 활용한 질환모델에서 항염증 효과를 나타내었다(Romay et al., 2003). 그러나, 염증성 장질환(inflammatory bowel disease, IBD)에 대한 효능연구는 많이 보고되지 않았다. 화학물질로 유도하는 IBD동물모델 중 dextran sulfate sodium(DSS)은 음용수로 제공할 때, 대장염 초기에 나타나는 체중감소, 설사, 혈변 등의 임상증상과 대장축소 및 점막궤양이 인체의 궤양성 대장염과 매우 유사하여 IBD 연구에 가장 많이 활용되고 있다(Okayasu et al., 1990). 따라서, 본 연구는 2.5% DSS로 유도한 대장염 모델에서 스피루리나와 블루스피리루리나의 대장염 증상 개선 및 관련 항염증 활성을 비교하고자 하였다.
재료 및 방법
실험동물
7주령의 수컷 C57BL/6 마우스를 대한바이오링크에서 구입하여 온도 23 ± 1℃, 습도 55 ± 5%, 12시간 자동명암조절을 유지하는 동물사육실에서 1주간 적응시켰다. 체중을 측정하여 무작위법으로 그룹당 8마리씩 5그룹으로 나누었다. 실험군은 (1) 대조군(Normal control, NC), (2) 대장염 유발군(DSS), (3) 스피루리나 저농도 투여군(SPL, DSS + SP 100 mg/kg) (4) 스피루리나 고농도 투여군(SPH, DSS + SP 400 mg/kg), (5) 블루스피루리나 저농도 투여군(BSL, DSS + BS 100 mg/kg), (6) 블루스피루리나 고농도 투여군(BSH, DSS + BS 400 mg/kg으로 나누었다. SP와 BS의 투여량은 Oriquat(2018)의 고지방식이로 유도한 비알콜성 지방간 연구를 참고하였으며, 스피루리나는 5g/kg으로 14일간 투여하였을 때 독성이 없는 것으로 보고되었다(Chen et al., 2016). 본 연구의 동물실험은 (재)홍천메디칼허브연구소 실험동물운영 위원회 승인(HIMH A20-05)을 받아 규정을 준수하여 수행하였다.
대장염 유도 및 시료물질 투여
급성 대장염은 2.5% DSS(M.W. 36-50 kDa, MP biomedicals)를 멸균 수돗물에 녹여 5일간 음용수로 공급하여 유도하였다. 스피루리나(SP)와 블루스피루리나(BS, 100% phycocyanin)는 ㈜뉴트리케어(강원도, 횡성군)에서 제공받아 사용하였다. SP와 BS는 12일간 경구투여하였으며, 2.5% DSS는 실험 8일째부터 5일간 투여하였다. 시료분말은 PBS에 현탁하여 200 µL 용량으로 경구투여하였고, NC군과 DSS군은 vehicle로 PBS를 투여하였다.
Disease activity index(DAI) 측정
7일간 시료물질을 먼저 투여한 후, 8일째부터 2.5% DSS를 음용수로 5일간 제공하면서 매일 음수량과 체중을 측정하였다. 변의 경도와 혈변측정은 ColoScreen Ⅲ kit(#5071, Helena Laboratories, Beaumont, USA)를 이용하였다. 대장염의 질병활성지수(DAI, disease activity index)는 Table 1에서 제시한 기준에 따라 체중감소, 변의 경도, 혈변 상태를 매일 체크하여 각 항목을 4점 척도로 계산하여 합산하였다(Berberat et al., 2005).
Table 1.
Disease activity index score
채혈 및 장기 적출
실험종료일에 4시간 절식을 실시하였다. 이소플루란 흡입마취제로 심마취한 후, 하대정맥에서 채혈하였고, 방혈 후 안락사하였다. 맹장부터 직장까지 적출하여 대장길이를 측정한 후, saline으로 대장을 세척하였다. 대장을 2등분하여 proximal colon부위는 swiss-rolling 기법으로 말아 10% formaldehyde 용액에 고정하여 hematoxyline and eosin staining(H&E)을 실시하였다. 대장의 나머지 부분은 액체질소에 급속동결하여 –80℃에 보관하였다.
혈장 TNF-α, IL-6, IL-1β 및 대장조직의 MPO, PGE2 분석
채혈한 혈액은 4,000 rpm에서 15분간 원심분리하여 혈장을 분리하였다. 혈장에서 TNF-α, IL-6, IL-1β 농도는 R&D systems ELISA kit(Minneapolis, MN, USA) 를 이용하여 분석하였다. 대장조직은 10배의 PBS을 넣고 균질화하여 7,000 rpm에서 20분간 원심분리한 후, 상등액을 사용하였다. 대장 조직액의 myeloperoxidase(MPO)와 prostaglandin E2(PGE2) 농도는 Cusabio ELISA kit(Wuhan, China)를 사용하여 분석하였다.
조직 병리학적 분석
Formaldehyde 용액에 고정한 대장조직은 파라핀 포매 후 5 µm 두께로 박절하여 H&E 염색을 실시하였다. 조직병리학적 분석은 대장점막조직의 손상, 염증세포의 침윤(infiltration), 점막조직의 궤양(ulceration)정도를 Table 2의 기준에 따라 분석하였다(Jin et al., 2017).
Table 2.
Histology injury score
통계 방법
실험결과는 Mean ± SEM로 나타내었고, 통계처리는 GraphPad 7.05를 이용하여 one-way ANOVA로 분석하였다. 투여기간에 따른 체중변화 및 DAI 측정은 Two-way ANOVA를 사용하였다. 처리군 간의 유의성은 Dunnett’s multiple range test로 p < 0.05 수준에서 유의성 검정을 실시하였다.
결과 및 고찰
DAI 측정
DSS로 유도하는 궤양성 대장염 모델은 체중감소, 설사, 직장출혈 등의 임상증상과 장점막의 crypt손상, 궤양, 염증세포 침윤 등의 조직병리학적 특징을 잘 반영하여 염증성 장질환 연구에 가장 많이 활용되는 모델이다(Chassaing et al., 2014). DSS투여 후, 5일간 체중, 설사, 혈변을 매일 측정하여 DAI를 계산하였다. 2.5% DSS 음수량은 DSS군이 4.40 ± 0.19 mL/day으로 NC군 3.96 ± 0.30 mL/day보다 유의적으로 증가하였으며(p < 0.05), 시료물질 투여군에서는 음수량의 차이가 없었다(Fig. 1A). 2.5% DSS 투여 5일째에 체중이 유의적으로 감소하였고(p < 0.001), BSL군과 BSH군에서는 DSS군보다 체중감소가 유의적으로 억제되는 효과가 나타났다(Fig. 1B). DSS 투여 4일째부터 묽은 변과 설사가 관찰되었다(Fig. 1C). 혈변은 DSS 투여 2–3일째에 잠혈이 검출되었고, 4일째부터는 혈변을 배설하였다(Fig. 1D). SP와 BS투여군에서는 설사와 혈변지수가 DSS군보다 감소하는 효과를 보였다. 체중감소, 설사, 혈변 점수를 합산하여 평가한 DAI 점수는 DSS 투여 3일째부터 NC군보다 큰 차이로 증가하였다. 반면, SP와 BS투여군의 DAI 점수는 DSS군보다 감소하였으며, BSL군과 BSH군에서 투여 4, 5일에 DSS군보다 유의적인 수준으로 감소하였다(Fig. 1E).
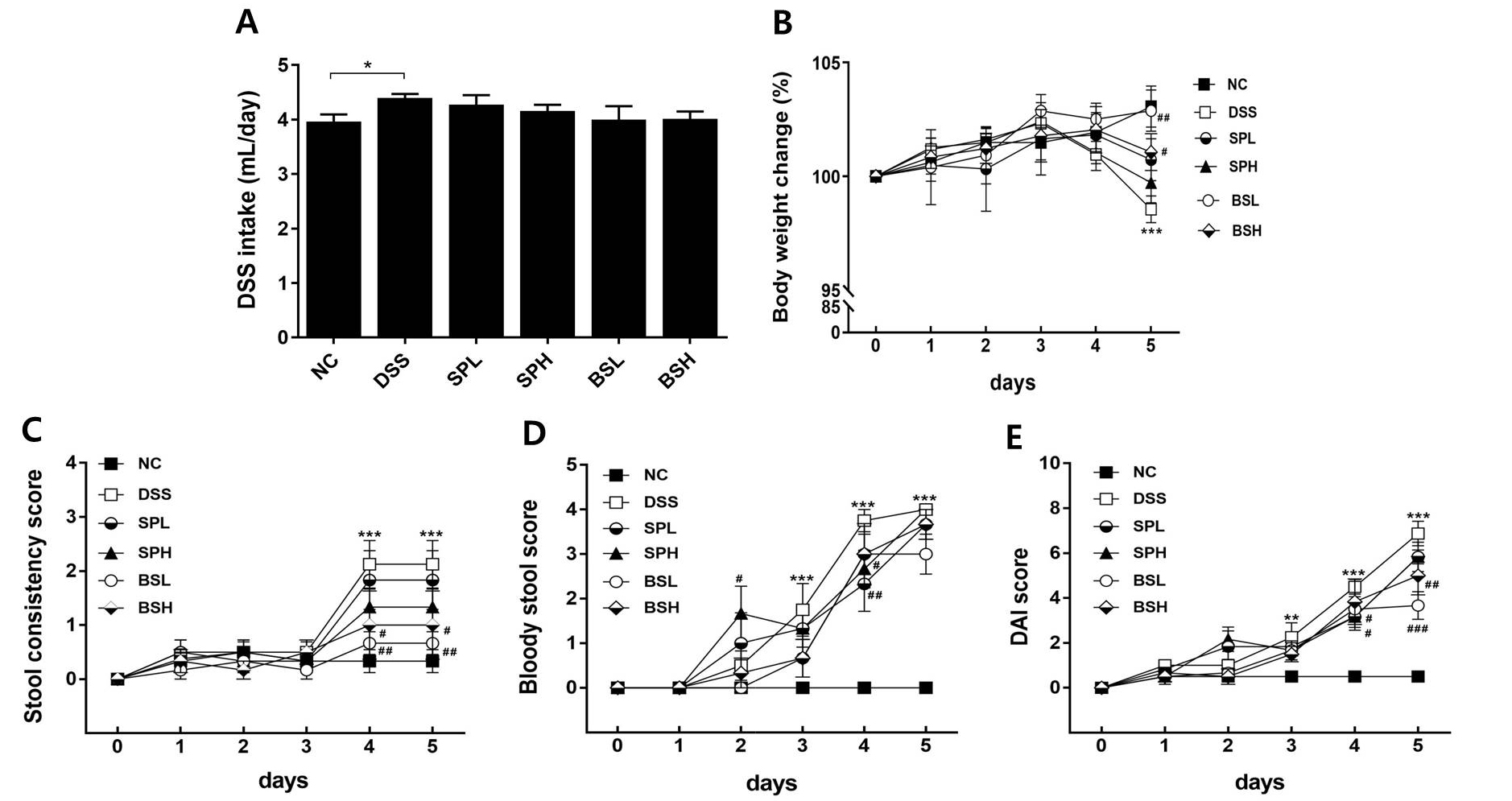
Fig. 1
Effects of blue spirulina on the clinical signs of DSS-induced colitis mice. Mice were administered spirulina or blue spirulina for 12 days and colitis was induced by oral gavage with 2.5% DSS for 5 days from 8th day. (A) DSS intake, (B) Body weight change, (C) Stool consistency score, (D) Bloody stool score, and (E) DAI score. *p < 0.05, **p < 0.01, ***p < 0.001 vs NC; #p < 0.05, ##p < 0.01 vs DSS.
혈장 TNF-α, IL-6, IL-1β
혈장의 TNF-α, IL-6, IL-1β 농도를 Fig. 2에 나타내었다. TNF-α 농도는 DSS군 1.63 ± 0.53 pg/mL로 NC군 0.36 ± 0.34 pg/mL 보다 4.5배 증가하였다(p < 0.01, Fig. 2A). SP와 BS 투여군에서는 DSS 투여로 증가한 TNF-α 농도를 10–37% 억제하였으나, 통계적 유의성은 없었다. IL-6 농도는 DSS군 26.75 ± 9.05 pg/mL로 ND군 1.01 ± 0.64 pg/mL보다 26배 이상 증가하였다(p < 0.001, Fig. 2B). 반면, 시료 투여군에서는 SPL군 15.96 ± 5.76 pg/mL, SPH 군 11.63 ± 7.26 pg/mL, BSH군 7.70 ± 8.10 pg/mL으로 DSS투여로 증가된 IL-6 농도를 현저하게 감소시켰다. IL-1β는 농도는 DSS군 3.62 ± 1.22 pg/mL로 NC군 0.31 ± 0.26 pg/mL 보다 11.7배 증가하였다. SP와 BS투여군에서는 DSS군의 IL-1β 농도보다 30–44% 유의적으로 감소시켰다. 궤양성 대장염에 있어서 염증반응에 의한 장벽파괴는 가장 중요한 특징으로 다루어지고 있다(Pastorelli et al., 2013). 장내 염증반응은 대식세포나 호중구를 자극하여 TNF-α, IL-6, IL-1β 등의 염증성 사이토카인을 과분비하게 되고, 분비된 이들 염증성 사이토카인은 파괴효소나 자유라디칼을 생성하여 궤양성 대장염을 악화시킨다(Perše and Cerar, 2012; Nell et al., 2010). 이전 연구보고에 따르면, 대장염이나 만성 염증성 질환의 조직이나 혈액에서 TNF-α, IL-6, IL-1β의 농도가 현저히 증가하였다(Műzes et al., 2012). 스피루리나와 블루스피루리나의 항염증 효능은 많은 연구에서 in vitro 또는 in vivo 실험을 통하여 규명되었으며(Nasirian et al., 2018; Prabakaran et al., 2020), 본 연구에서도 DSS로 유도한 대장염 모델을 통하여 염증성 사이토카인의 농도를 억제함으로써 이들 시료물질의 항염증 효과를 확인할 수 있었다.
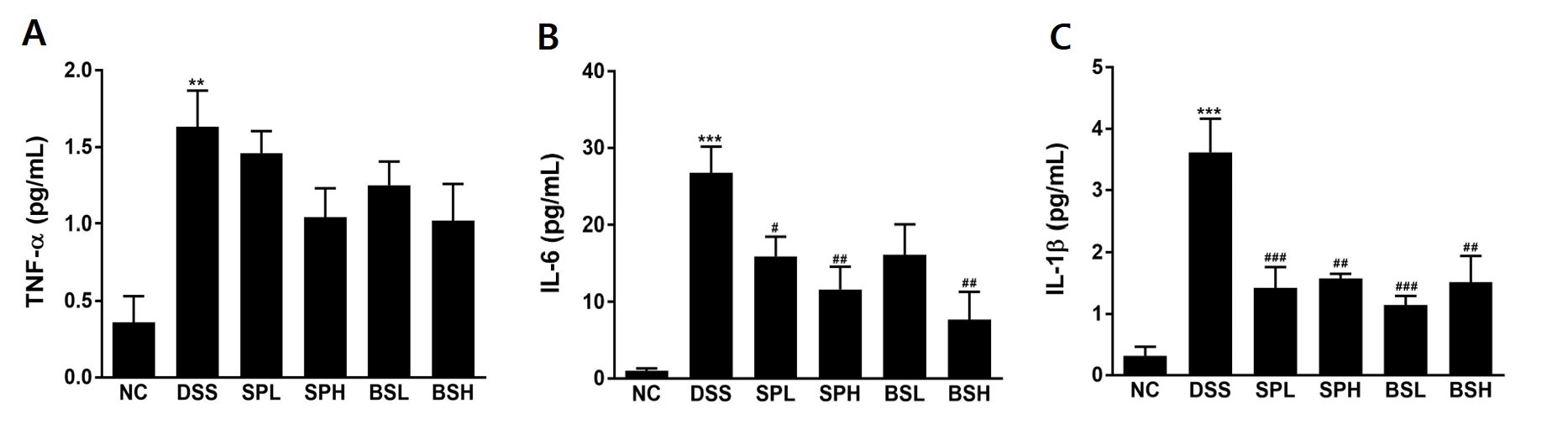
Fig. 2
Effects of blue spirulina on inflammatory cytokines in DSS-induced colitis mice. Mice were administered spirulina or blue spirulina for 12 days and colitis was induced by oral gavage with 2.5% DSS for 5 days from 8th day. (A) TNF-α, (B) IL-6, and (C) IL-1β **p < 0.01, ***p < 0.001 vs NC; #p < 0.05, ##p < 0.01, ###p < 0.001 vs DSS.
대장길이 및 대장조직의 병리학적 분석
DSS로 유도한 대장염 마우스의 대장길이와 조직염색의 병리학적 분석결과를 Fig. 3에 나타내었다. 대장길이는 장내 염증의 심각성을 반영하는 지표로 체중감소와 혈변과도 관련성이 크며, 염증이 개선되면 회복되는 특징이 있다(Gou et al., 2019). 본 연구에서 대장길이는 DSS군이 6.20 ± 0.28 cm로 NC군 7.51 ± 0.81cm 보다 18% 유의적으로 감소하였다(p < 0.01, Fig. 3A). 시료 투여군의 대장길이는 SPL군 6.62 ± 0.51 cm, SPH군 6.65 ± 0.53 cm, BSL군 6.91 ± 0.53 cm, BSH군 6.84 ± 0.55 cm이었고, SP투여군에서는 7%, BS 투여군에서는 11% DSS군보다 대장길이가 증가하였다. 특히, BSL군에서는 대장길이가 유의적으로 증가하였다(p < 0.05). DSS군의 대장염색조직을 관찰하였을 때(Fig. 3D), goblet cell 손실, crypt 구조파괴, 상피층손상, 염증세포, 점막하 조직 비대 등 전형적인 염증성 변화가 관찰되었으나(Yoda et al., 2014), 시료추출물 투여군의 조직병리학적 분석결과 DSS군과 차이가 없었고, BSL군에서 염증점수가 감소하는 경향을 나타내었다(Fig. 3C).
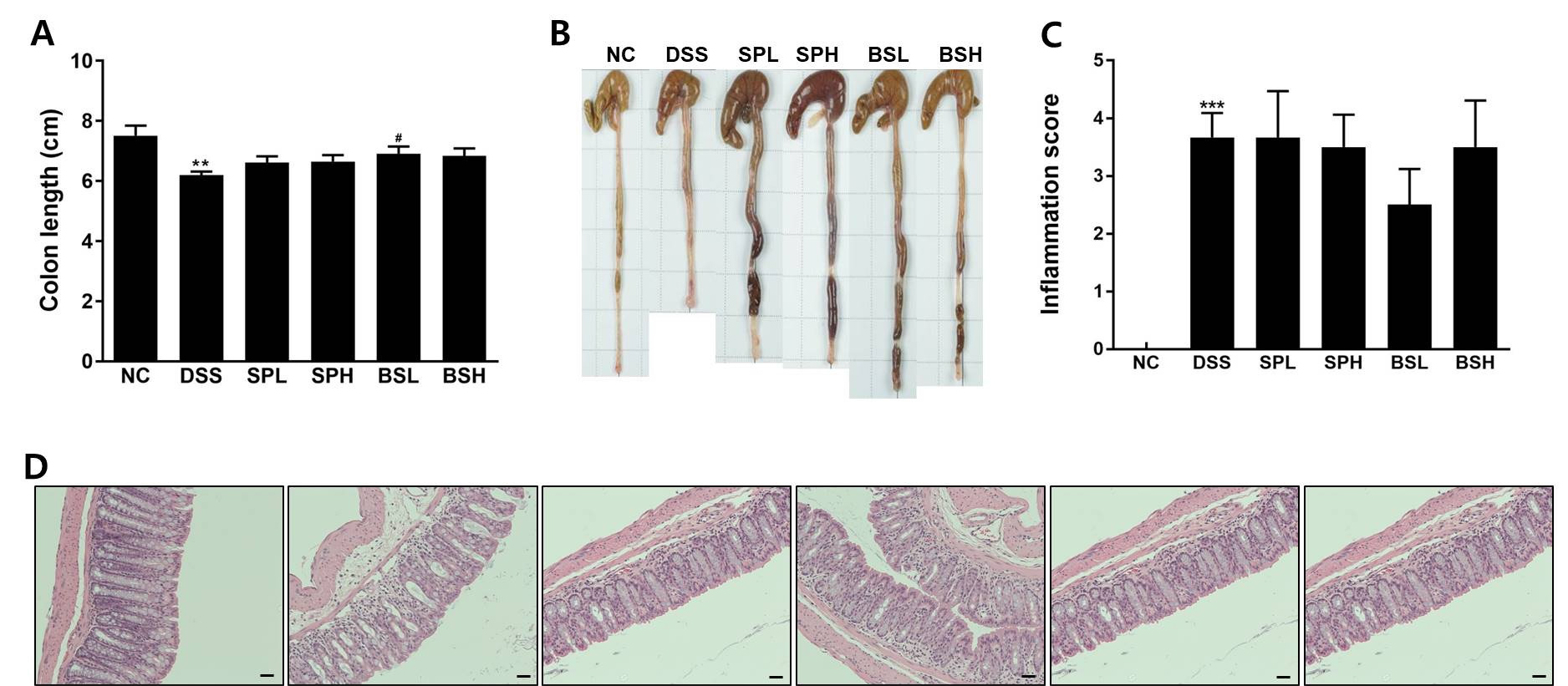
Fig. 3
Effects of blue spirulina on colon length and histopathology of DSS-induced colitis mice. Mice were administered spirulina or blue spirulina for 12 days and colitis was induced by oral gavage with 2.5% DSS for 5 days from 8th day. (A) Colon length, (B) Representative photographs of colon tissue, (C) Colon histopathological damage score and (D) Histological evaluation (H&E staining, 200×, Scale bar = 200 µm). **p < 0.01, ***p < 0.001 vs NC; #p < 0.05 vs DSS.
대장조직의 MPO, PGE2분석
대장조직에서 염증매개 인자로 활용되는 MPO와 PGE2를 분석하였다(Fig. 4). DSS군의 MPO 농도는 69.70 ± 14.12 ng/mg로 NC군 49.98 ± 5.22 ng/mg보다 40% 증가하였다(p < 0.01, Fig. 4A). SP와 BS투여군에서는 증가한 MPO 농도를 억제하는 효과가 있었고, SPH군과 BSL군에서 DSS군보다 MPO 농도를 각각 25%, 24% 유의적으로 억제하였다. PGE2 농도는 DSS군에서 NC군보다 1.8배 증가하였으며, 시료물질 투여군에서는 DSS로 증가된 PGE2 농도를 그룹별로 각각 53%, 37%, 33%, 37% 억제하였다(Fig. 4B). 특히, SPL군과 SPH군에서는 DSS군보다 PGE2 농도가 유의적으로 감소하였다. 면역세포 호중구 침윤의 지표로 사용되는 MPO 활성은 DSS로 유도한 궤양성 대장염 실험에서 염증 손상 정도에 따라 증가하는 것으로 보고되었다(Zhao et al., 2013). PGE2 증가는 염증세포 침윤, 점막 염증, 부종, 궤양 등을 유발하며, 궤양성 대장염 그룹에서 현저하게 증가되는 것으로 보고되었다(Dai et al., 2015). 염증성 장질환 환자와 대장염 동물모델의 장점막에서 다량의 자유라디칼을 생성할 수 있는 단핵백혈구가 대량 침투된 것을 발견한 연구가 보고되었다(Almeer et al., 2018; Damiani et al., 2007). 염증반응 중 분비되는 라디칼 종은 점막 투과성을 증가시키고 추가적인 호중구를 활성화시켜 조직손상과 염증을 가속화시킨다(Simmonds and Rampton, 1993). 따라서, DSS유도 대장염에서 스피루리나와 블루스피루리나의 보호효과는 자유라디칼 소거에 의한 항산화 활성으로 염증성 장질환 치료에 중요한 근거로 활용될 수 있을 것이다.
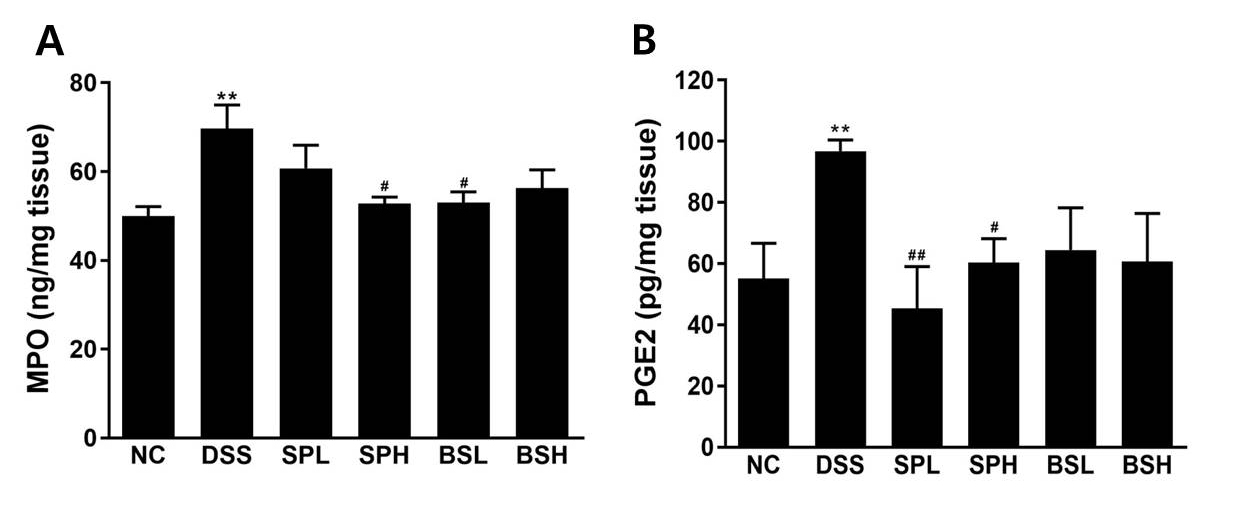
Fig. 4
Effects of blue spirulina on inflammatory mediators, MPO and PGE2, in colon homogenate from DSS-induced colitis mice. Mice were administered spirulina or blue spirulina for 12 days and colitis was induced by oral gavage with 2.5% DSS for 5 days from 8th day. (A) MPO, (B) PGE2. **p < 0.01 vs NC; #p < 0.05, ##p < 0.01 vs DSS. MPO, myeloperoxidase; PGE2, Prostaglandin E2.
요약 및 결론
본 연구는 미세조류 스피루리나와 스피루리나의 추출·정제물질인 phycocyanin, 블루스피루리나의 궤양성 대장염 개선 효능을 평가하고자 하였다. 시료물질은 12일간 투여하였으며, 투여 8일째 2.5% DSS을 5일간 음용수로 제공하여 궤양성 대장염을 유도하였다. 체중감소, 설사, 혈변의 임상증상을 평가한 질병활성화 DAI 지수는 2.5% DSS투여 3일부터 급격히 증가하였으며, BSL군과 BSH군에서는 투여 4-5일에 유의적으로 감소하였다. BSL군에서는 DSS투여로 감소한 대장길이가 유의적으로 증가하었다. 2.5% DSS투여군에서는 혈장 TNF-α, IL-6, IL-1β의 염증성 사이토카인과 대장조직의 MPO, PGE2 농도가 대조군보다 현저히 증가하였으나, 스피루리나와 블루스피루리나 투여군에서는 DSS로 유도된 염증반응을 억제하였다. 따라서, DSS로 유도한 궤양성 대장염 모델에서 스피루리나와 블루스피루리나는 대장염 임상증상를 완화시키고, 염증성 사이토카인과 염증매개 인자를 억제하는 강한 항산화 활성과 항염증 활성으로 염증성 장질환을 개선하고 보호하는데 효과적이었다.




