서 론
재료 및 방법
시료 제조
실험재료 및 시약
실험동물 사육
T-maze
Novel object recognition(NOR)
Morris water maze(MWM)
혈청 aspartate aminotransferase(AST) 및 alanine aminotransferase(ALT) 측정
Western blotting
통계분석
결 과
스코폴라민 투여 마우스에서 공간인지능력 손상에 대한 CJM의 효과
스코폴라민 투여 마우스에서 물체인지능력 손상에 대한 CJM의 효과
스코폴라민 투여 마우스에서 학습 및 기억력 손상에 대한 CJM의 효과
스코폴라민 투여 마우스에서 체중 및 조직무게에 대한 EACJM의 효과
스코폴라민 투여 마우스에서 혈청 AST 및 ALT에 대한 EACJM의 효과
스코폴라민 투여 마우스에서 뇌 내 AChE 및 신경영양인자 관련 단백질 발현에 대한 EACJM의 효과
스코폴라민 투여 마우스에서 뇌 내 세포사멸 관련 단백질 발현에 대한 EACJM의 효과
고찰 및 결론
서 론
치매(dementia)는 뇌혈관의 장애 및 뇌의 위축으로 인한 만성퇴행성 뇌질환으로, 고령화가 심화되는 현대사회에서 주요한 건강 문제로 대두되고 있다. 그중에서도 알츠하이머 치매(Alzheimer’s disease)는 치매의 가장 흔한 형태로, 전체 치매 환자의 약 60%를 차지한다. 알츠하이머 치매는 뇌신경세포가 소실되어 전반적인 뇌 위축을 나타내며, 기억력 감퇴와 같은 임상적 증상을 초래한다(Lemière et al., 1999). 알츠하이머 치매에서 관찰되는 조직병리학적 특징으로는 세포 내의 신경섬유 얽힘(neurofibrillary tangle)과 세포 외의 노인반(senile plaque) 생성이 대표적인데, 이들은 활성산소종(reactive oxygen species)의 생성을 촉진시켜 뇌 세포사멸을 유도하며 이는 뇌 실질 위축으로 이어질 수 있다(Cheignon et al., 2018; Choi et al., 2005).
알츠하이머 치매에서 기억력 감퇴는 해마 내 콜린성 신경계 장해가 직·간접적으로 관련된 것으로 알려져 있다. 예를 들어 알츠하이머 치매 환자의 해마에서는 아세틸콜린(acetylcholine)의 합성이 감소될 뿐만 아니라 아세틸콜린을 분해하는 아세틸콜린에스터라제(acetylcholine esterase, AChE)가 증가하는 것으로 보고되었다. 이는 기억 및 학습에 중요한 역할을 하는 신경전달물질인 아세틸콜린의 뇌 내 농도를 감소시켜 기억력 손상을 유발할 수 있다(Kuhl et al., 1999). 따라서 임상적 증상의 치료를 위해 콜린성 가설(cholinergic hypothesis)에 근거한 약물을 사용하고 있다. 즉, 도네페질(donepezil), 리바스티그민(rivastigmine), 갈란타민(galantamine)과 같은 가역성 콜린효소억제제(reversible acetylcholinesterase inhibitor, AChEI)를 투여함으로써 AChE의 농도를 감소시켜 증상을 완화시킨다(Roberson et al., 1997). 그러나 이들 약물은 단지 일시적인 효과를 나타내며, 장기적으로 복용할 경우 간 독성을 나타낼 뿐만 아니라 심장 서맥 및 위장관 장애와 같은 부작용을 유발함에 따라 그 사용이 제한적이다(Dawson and Iversen, 1993). 따라서 알츠하이머 치매의 예방과 치료를 위해서 천연물로부터 부작용이 거의 없는 후보물질을 발굴하려는 노력이 지속적으로 이루어지고 있다.
엉겅퀴(Cirsium japonicum var. maackii, CJM)는 국화과(Compositae)에 속하는 다년생 초본으로 우리나라 전역의 산과 들판에서 자생한다. 예로부터 민간에서는 가시나물이라 불리며 어린 순을 채취하여 나물로 이용하였고, 한방에서는 토혈, 혈뇨 및 간염 치료를 위한 약제로 활용해왔다(Jeong et al., 2017; Jang et al., 2012). 최근 보고된 연구에 따르면 엉겅퀴는 난소가 제거된 쥐에서 나타난 갱년기 증상을 완화하였으며, 유방암 세포에서 암 전이를 저해하고, 염증이 유도된 대식세포에서 염증인자의 활성을 억제하였다(Park et al., 2018; Park et al., 2017; Shin et al., 2017). 특히 C6 신경교세포에서 H2O2와 아밀로이드 베타(Aβ)에 의한 세포손상을 개선하는 등 인지능과 관련된 신경계에서도 우수한 생리활성을 나타냈다(Lee et al., 2018; Kim et al., 2019). 이러한 생리활성은 엉겅퀴에 포함된 활성물질에 의한 것으로 사료되는데, 예를 들어 엉겅퀴의 주요 활성물질인 cirsimaritin은 estrogen receptor α를 활성화하여 폐경 증상을 완화시키고 혈관 신생을 억제하여 암 세포의 전이를 막고, 염증 전사인자의 활성을 감소시키는 것으로 알려졌다(Park et al., 2018; Park et al., 2017; Shin et al., 2017). 또한 엉겅퀴로부터 분리된 apigenin은 연골 손상과 관절염을 유도하는 Hif-2α를 차단하여 골관절염을 효과적으로 억제하는 것으로 보고되었다(Cho et al., 2019). 신경계와 관련하여 luteolin은 당뇨에 의한 중추신경계 기능장애, 즉 당뇨성 뇌병증에 대하여 탁월한 개선 효과를 나타냈으며, apigenin은 kainate로 유도된 흥분독성에 대하여 해마에 작용하여 감소시켜 흥분독성을 완화한다고 보고되었다(Liu et al., 2013; Han et al., 2012). 이와 같이 엉겅퀴는 다양한 생리활성을 보유한 것으로 알려져 있으나, 인지능력 개선 효과에 대한 동물모델에서의 연구는 전무한 실정이다. 따라서 본 연구는 스코폴라민(scopolamine)을 처리한 동물모델에서 엉겅퀴의 인지능 개선 효과와 그 메커니즘을 밝히고자 한다.
재료 및 방법
시료 제조
실험에 사용한 엉겅퀴는 Cirsium japonicum var. maackii로 임실생약 영농조합법인(Imsil, Korea) 포장에서 2019년도 재배된 것을 제공받아 사용하였다. 엉겅퀴를 건조한 후 환류냉각장치(reflux, Sunileyela, Seongnam, Korea)를 이용하여 99% ethanol(EtOH)로 추출하였고, EtOH 추출물 667.2 g을 얻었다(수율 11.68%). 이후 n-hexane(213.6g), CHCl3(39.0g), ethyl acetate(67.6g), 및 n-butanol(47.0g)을 이용하여 분획물을 제조하였고, 그중 엉겅퀴 ethyl acetate 분획물(EACJM)을 시료로 사용하였다(수율 1.18%).
실험재료 및 시약
마우스의 기억력 손상을 유도하기 위한 스코폴라민은 Sigma(St. Louis, USA)사의 제품을 구입하여 사용하였다. Western blotting을 수행하며 사용한 radioimmunoprecipitation assay(RIPA) buffer는 Elpis Biotech.(Daejeon, Korea)사, polyvinylidenefluoride(PVDF) membrane은 Millipore Co.(Billerica, USA)사, skim milk는 Sigma(Saint Louis, USA)사, enhanced chemoluminescence(ECL)은 Bio-Rad Lab.(Hercules, USA)사 제품을 사용하였다.
실험동물 사육
실험동물은 ICR 마우스를 사용하였으며, 5주령의 수컷 마우스를 오리엔트바이오(Seongnam, Korea)에서 공급받아 사용하였다. 실험동물 사육 환경은 온도 20 ± 2°C, 습도 50 ± 10%, 12시간 간격 light-dark cycle을 유지하였다. 1주일의 적응기간을 가진 뒤, 군 별로 평균체중의 통계적 유의성이 없도록 정상군(normal), 스코폴라민 투여군(control), 스코폴라민 투여 및 50 mg/kg EACJM 섭취군(EACJM50), 스코폴라민 투여 및 100 mg/kg EACJM 섭취군(EACJM100)으로 나누었다. EACJM은 정수물에 녹여 매일 1회 경구투여 하였으며, 시료를 섭취하지 않는 normal 및 control군은 시료 대신 정수물을 경구투여 하였다. 기억력 손상을 유도하기 위해 1.5 mg/kg 스코폴라민을 행동실험 시작 30분 전에 복강투여 하였으며, 기억력 손상을 유도하지 않는 normal군은 스코폴라민 대신 생리식염수(0.9% NaCl)를 복강투여 하였다. 행동실험이 종료된 후 실험동물은 졸레틸과 럼푼 혼합액으로 마취한 뒤 심장으로부터 혈액을 채취하고 생리식염수로 관류시켜 장기 내 혈액을 제거하였다. 이후 뇌, 간, 및 신장 조직을 적출한 뒤 무게를 측정하고 보관용기에 담아 밀봉하여 -80°C deep freezer에 냉동보관하며 실험에 사용하였다. 본 실험은 부산대학교 동물실험윤리위원회의 승인을 받아 수행되었다(승인번호: PNU-2021-0079).
T-maze
T-maze 실험은 Montgomery(1952)의 방법으로 실시하였다. 실험에 사용한 미로는 ‘T’자 형태로 가운데 통로와 왼쪽 및 오른쪽 통로로 구성되었으며, 외부환경으로부터 차단되도록 흑색 아크릴로 제작하였다. 실험은 총 2일간 진행하였다. 첫째 날은 오른쪽 통로로 가는 길목에 차단문을 설치하여 왼쪽 통로만 이용할 수 있도록 하였고, 마우스는 가운데 통로에 배치한 뒤 10분간 자유롭게 탐색할 수 있게 하였다. 둘째 날은 차단문을 제거하여 왼쪽 및 오른쪽 통로 모두 이용할 수 있도록 하였고, 마우스를 동일하게 배치한 뒤 10분간 자유롭게 탐색할 수 있게 하였다. 기존의 왼쪽 통로와 새로운 오른쪽 통로에 들어간 횟수를 각각 측정하여 공간인지능력을 산출하였다.
Novel object recognition(NOR)
NOR 실험은 Bevins와 Besheer(2006)의 방법에 따라 수행하였다. 실험은 흑색 아크릴로 제작한 정사각형의 상자에서 진행하였고, 총 2일간 실시하였다. 첫째 날은 상자 안에 크기와 모양이 동일한 물체를 두고 마우스를 가운데 배치한 뒤 10분간 자유롭게 탐색할 수 있게 하였다. 둘째 날은 두 물체 중 하나를 크기와 모양이 다른 새로운 물체로 교체한 뒤 10분간 자유롭게 탐색할 수 있게 하였다. 기존의 물체와 새로운 물체를 탐색한 횟수를 각각 측정하여 물체인지능력을 산출하였다.
Morris water maze(MWM)
MWM 실험은 Morris(1984)의 방법을 참고하여 실시하였다. 실험에 사용된 수중미로는 스테인리스 스틸을 이용하여 원형으로 제작하였다. 수중미로를 4개의 구역으로 나눈 뒤, 임의로 한 구역을 선정하여 중앙에 원형 도피대를 설치하였다. 도피대는 마우스로부터 숨겨지도록 물의 수면으로부터 1 cm 아래에 위치하도록 하였다. 마우스가 시각적 공간단서를 이용하여 도피대를 찾아갈 수 있도록 각 구역의 벽면에 각각 다른 모양의 표식을 부착하였다. 실험 기간동안 물은 오징어 먹물로부터 추출한 흑색 색소를 이용하여 불투명하게 만들었으며, 물의 온도는 22 ± 2°C로 유지하였다. 실험은 총 4일간 진행되었고, 3일의 훈련기간과 1일의 실험기간으로 구성하였으며, 매일 3회의 실험을 4시간 간격으로 실시하였다. 훈련기간 동안 마우스는 임의의 시작점에서 60초간 자유롭게 수중미로를 탐색하며 숨겨진 도피대를 찾아내도록 하였고, 도피대를 찾지 못한 경우에는 도피대로 유도하여 15초간 도피대의 위치를 인식하도록 훈련하였다. 실험기간에는 3가지의 실험을 진행하였다. 첫 번째 실험은 이전과 같이 숨겨진 도피대를 찾아내는 것으로, 마우스가 숨겨진 도피대를 찾아내는 시간을 측정하였다. 두 번째 실험은 도피대를 제거한 후 도피대가 있던 사분면에서 마우스가 머무르는 시간을 측정하였다. 마지막 실험은 도피대가 노출되도록 투명한 물로 교체한 후, 노출된 도피대를 찾아내는 시간을 측정하였다. 실험 중 마우스 이동경로를 분석하기 위해 SMART video tracking software 3.0(Panlab, Spain)을 사용하였다.
혈청 aspartate aminotransferase(AST) 및 alanine aminotransferase(ALT) 측정
실험동물로부터 채취한 혈액은 실온에 30분간 방치한 뒤 4°C에서 3,000 rpm으로 15분간 원심분리를 2 회 반복하여 혈청을 분리하였다. 혈청 내 AST 및 ALT의 농도는 kit를 이용하여 측정하였다(AM-102K 및 AM-103K, Asan Pharm. Co., Seoul, Korea)(Reitman and Frankel, 1957).
Western blotting
RIPA buffer와 protease inhibitor cocktail을 혼합하여 만든 lysis buffer를 이용하여 실험동물로부터 적출한 뇌 조직을 균질화한 후 4°C에서 12,000 rpm으로 30분간 원심분리 하여 뇌 조직으로부터 단백질을 분리하였다. 단백질은 10% sodium dodecyl sulfate polyacrylamide gel로 전기영동하여 분리한 후 PVDF membrane에 transfer하였다. PVDF membrane은 적절한 비율로 희석한 1차 항체와 overnight 반응시켰다. 실험에 사용한 1차 항체는 β-actin(1 : 1000, Cell Signaling Tech.), AChE(1 : 500, Santa Cruz Biotech.), brain-derived neurotrophic factor(BDNF, 1 : 500, Cell Signaling Tech.), cAMP response element-binding protein(CREB, 1 : 500, Cell Signaling Tech.), phospho-CREB (p-CREB, 1 : 500, Cell Signaling Tech.), B-cell lymphoma-2-associated X protein(Bax, 1 : 500, Cell Signaling Tech.), B-cell lymphoma-2(Bcl-2, 1 : 500, Abcam Inc.)이다. 이후 적절한 2차 항체(1 : 1000, Cell Signaling Tech.)를 1시간 동안 반응시킨 후 ECL 용액을 통해 단백질 발현도를 확인하였다.
통계분석
본 연구의 실험 결과는 Statistical Package for the Social Sciences(SPSS, Chicago, IL, USA) 프로그램을 이용하여 분석하였다. 각 실험값은 평균 ± 표준편차로 나타냈다. 통계적 분석은 one-way analysis of variance(ANOVA)를 시행하였으며, Duncan’s multiple test를 이용하여 p < 0.05 미만일 경우 통계적으로 유의한 것으로 판정하였다. 각 군내 짝지어진 두 지표의 비교는 Student’s t-test를 이용하였으며, p < 0.05 미만일 경우 통계적으로 유의한 것으로 판정하였다.
결 과
스코폴라민 투여 마우스에서 공간인지능력 손상에 대한 CJM의 효과
T-maze 실험을 통해 스코폴라민으로 유도된 기억력 손상 동물모델에서 EACJM의 공간인지능력에 대한 효과를 평가하였다(Fig. 1). 생리식염수를 투여한 normal군에서 기존의 통로와 새로운 통로를 탐색하는 비율은 각각 33.53%와 66.47%로 기존의 통로보다 새로운 통로를 탐색하는 비율이 유의적으로 더 높았다. 한편, 스코폴라민을 투여한 control군은 기존의 통로와 새로운 통로를 탐색하는 비율이 각각 52.86%와 47.14%로 유의적인 차이를 나타내지 않았다. 반면, EACJM 50 및 100 mg/kg/day 투여군 모두 기존의 통로에 비해 새로운 통로를 탐색하는 횟수가 유의적으로 높았으며, 특히 EACJM100군에서는 새로운 통로를 탐색하는 비율이 normal군과 비슷한 수준을 나타냈다.
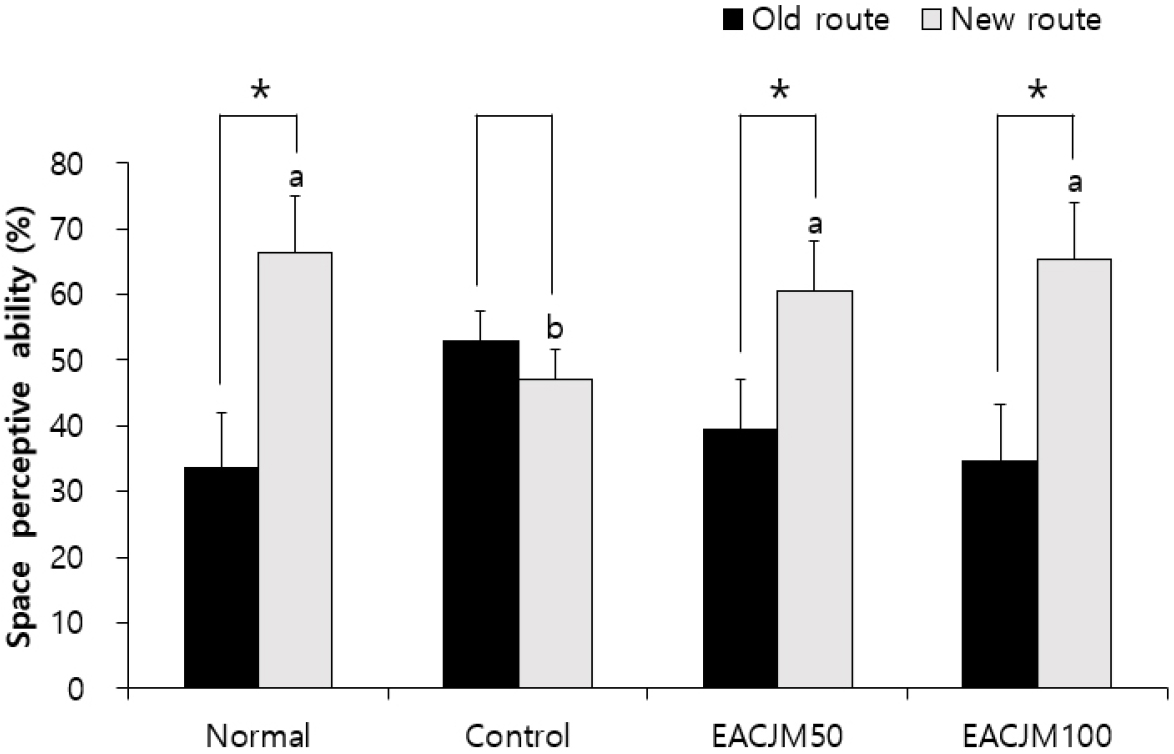
Fig. 1.
Effect of the ethyl acetate fraction of Cirsium japonicum var. maackii on spatial perception in T-maze. Values are means ± SD. a - b: Means with different letters are significantly different (p < 0.05) as determined by Duncan’s multiple range test. *The space perceptive abilities are significantly different as determined by Student’s t-test (p < 0.05). Normal: 0.9% NaCl + water; Control: scopolamine + water; EACJM50: scopolamine + EACJM (50 mg/kg/day); EACJM100: scopolamine + EACJM (100 mg/kg/day).
스코폴라민 투여 마우스에서 물체인지능력 손상에 대한 CJM의 효과
NOR 실험을 통해 EACJM의 스코폴라민 투여 동물모델에서의 물체인지능력을 평가하였다(Fig. 2). 스코폴라민을 처리한 control군에서 기존의 물체와 새로운 물체를 탐색하는 비율은 각각 48.00% 및 47.87%로 두 비율 간의 유의적인 차이는 없었다. 생리식염수를 처리한 normal군에서는 기존의 물체와 새로운 물체를 각각 49.63% 및 59.04%의 비율만큼 탐색하여 새로운 물체를 인식하는 비율이 유의적으로 증가하였다. 하지만 EACJM을 투여했을 때 기존의 물체보다 새로운 물체를 인지하는 비율이 증가하였으며, 100 mg/kg/day 농도로 투여했을 때는 기존의 물체와 새로운 물체를 탐색하는 비율이 각각 48.49%와 58.86%로 통계적 유의성을 나타냈다.
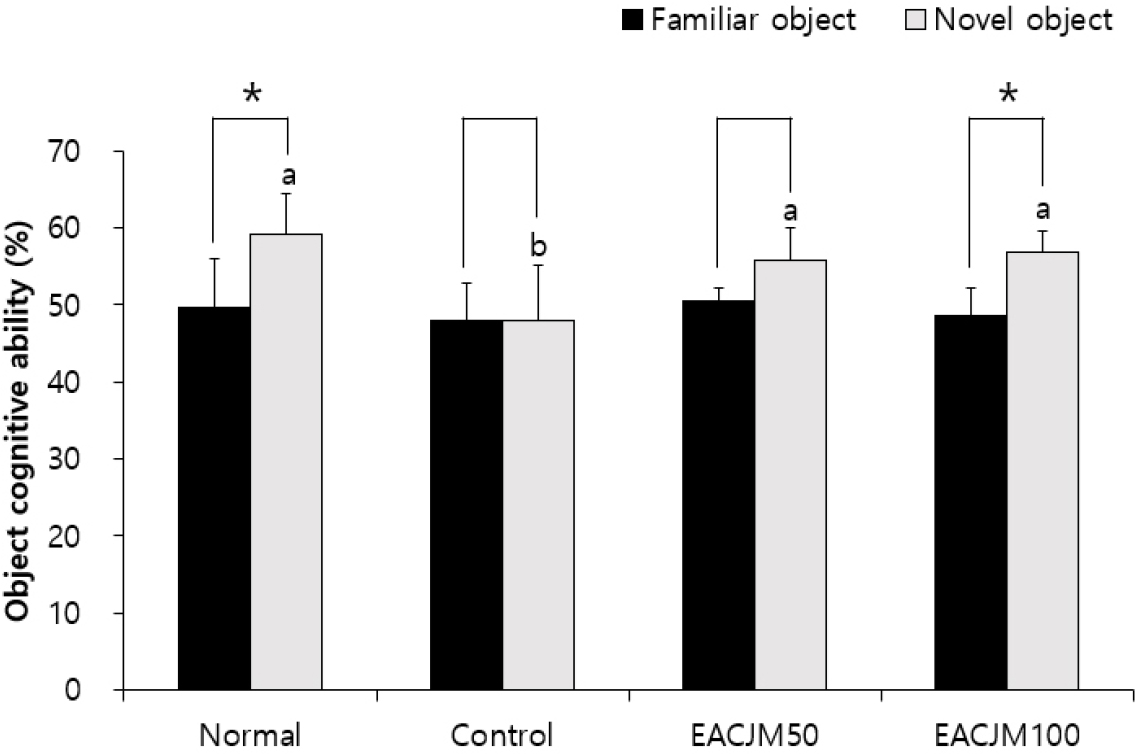
Fig. 2.
Effect of the ethyl acetate fraction of Cirsium japonicum var. maackii on object recognition in scopolamine-injected mice. Values are means ± SD. a - b: Means with different letters are significantly different (p < 0.05) as determined by Duncan’s multiple range test. *The object perceptive abilities are significantly different as determined by Student’s t-test (p <0.05). Normal: 0.9% NaCl + water; Control: scopolamine + water; EACJM50: scopolamine + EACJM (50 mg/kg/day); EACJM100: scopolamine + EACJM (100 mg/kg/day).
스코폴라민 투여 마우스에서 학습 및 기억력 손상에 대한 CJM의 효과
MWM를 통해 스코폴라민에 의해 기억력이 손상된 마우스에서 EACJM이 학습과 기억력에 미치는 영향을 평가하였다(Figs. 3, 4, 5). 생리식염수를 처리한 normal군은 훈련을 통해 반복학습 할수록 숨겨진 도피대를 찾는 시간이 빨라졌다(Fig. 3). 그러나 스코폴라민을 투여한 control군은 훈련이 계속되어도 숨겨진 도피대의 위치를 기억하지 못하여 4일째 되는 날 도피대를 찾아내는 시간이 43.3초로, 14.5초를 기록한 normal군보다 유의적으로 길었다. 반면, EACJM을 투여한 군은 반복훈련을 통해 숨겨진 도피대의 위치를 기억하여 도피대를 찾는 시간이 점점 짧아졌으며, 특히 4일째 EACJM100군은 normal군만큼 빠르게 도피대를 찾아냈다. 도피대를 제거한 후 도피대가 있던 사분면에 머무르는 시간을 측정한 결과(Fig. 4), control군은 해당 사분면에 머무르는 시간이 18.2초로 normal군의 25초에 비해 유의적으로 짧았다. 반면 EACJM을 투여했을 때 control군에 비해 유의적으로 오랜 시간동안 해당 사분면에 머무르는 것을 확인하였다. 한편, 마우스가 노출된 도피대를 찾아가는 시간을 측정한 결과(Fig. 5), 모든 실험군 간의 유의적인 차이가 나타나지 않았다.
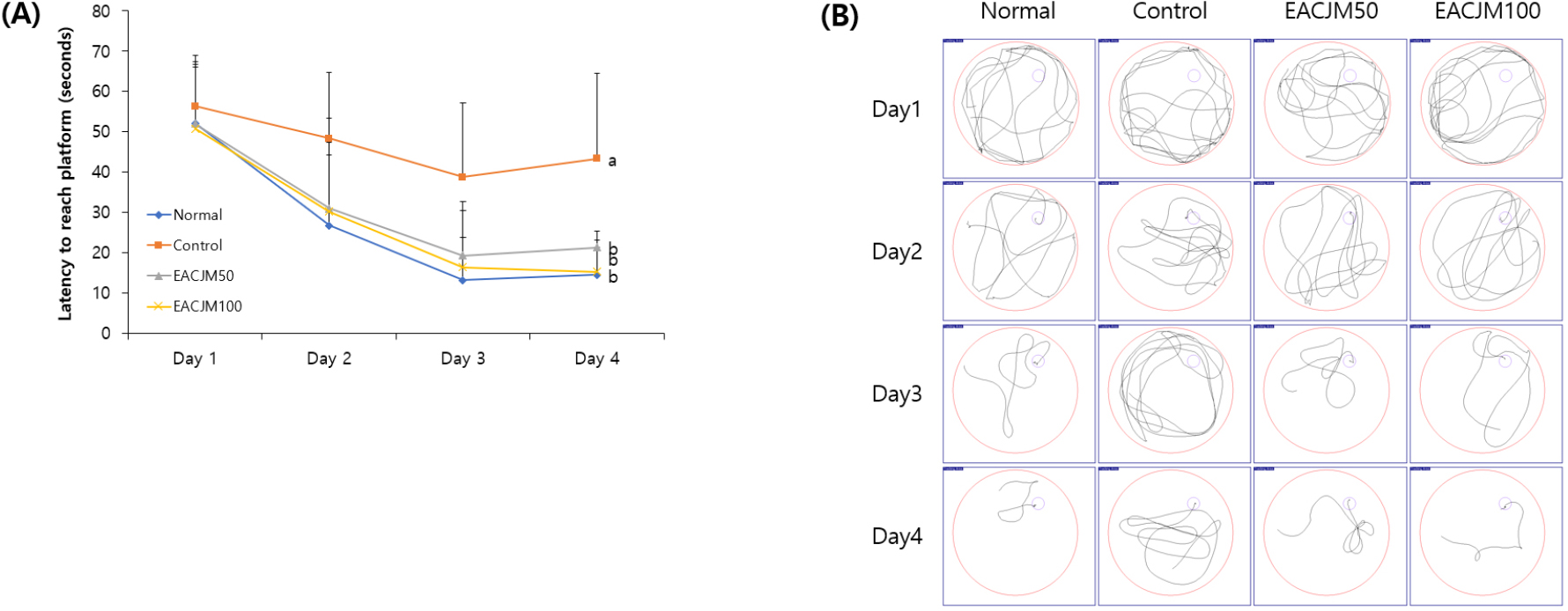
Fig. 3.
Effect of the ethyl acetate fraction of Cirsium japonicum var. maackii on latency to reach the hidden platform during the Morris water maze test. Escape latency to the hidden platform (A) and path tracing of each group to reach the hidden platform (B). Values are means ± SD. a - b: Means with different letters are significantly different (p < 0.05) as determined by Duncan’s multiple range test. Normal: 0.9% NaCl + water; Control: scopolamine + water; EACJM50: scopolamine + EACJM (50 mg/kg/day); EACJM100: scopolamine + EACJM (100 mg/kg/day).
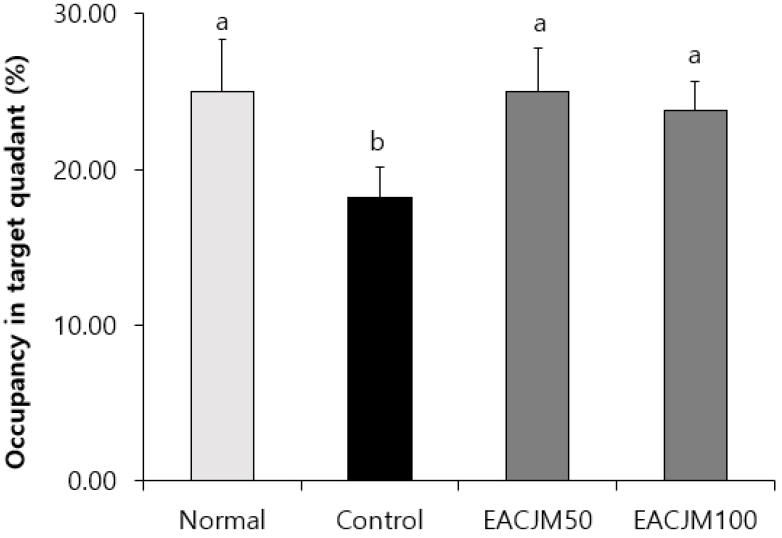
Fig. 4.
Effect of the ethyl acetate fraction of Cirsium japonicum var. maackii on occupancy in target quadrant during the Morris water maze test. Values are means ± SD. a - b: Means with different letters are significantly different (p < 0.05) as determined by Duncan’s multiple range test. Normal: 0.9% NaCl + water; Control: scopolamine + water; EACJM50: scopolamine + EACJM (50 mg/kg/day); EACJM100: scopolamine + EACJM (100 mg/kg/day).
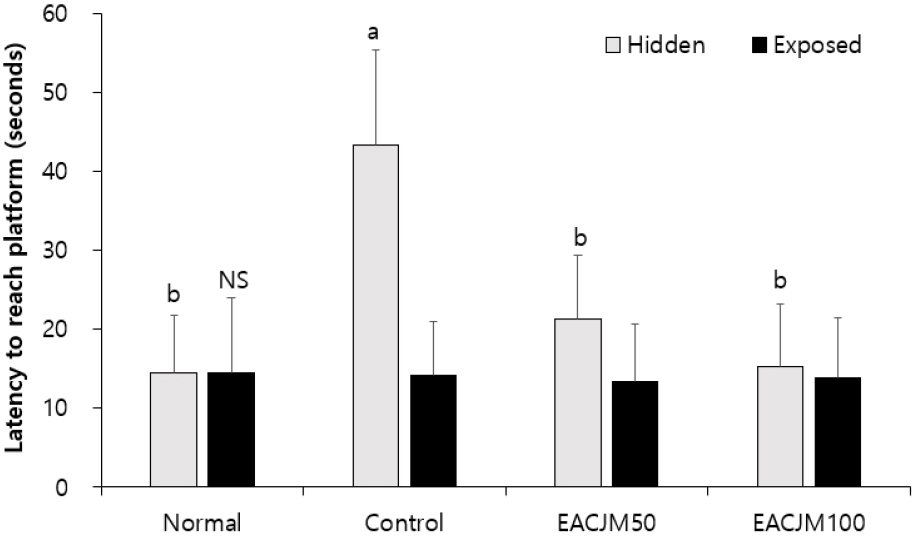
Fig. 5.
Effect of the ethyl acetate fraction of Cirsium japonicum var. maackii on latency to reach the hidden or exposed platform during the Morris water maze test. Values are means ± SD. a - b: Means with different letters are significantly different (p < 0.05) as determined by Duncan’s multiple range test. NS means no significant differences among groups. Normal: 0.9% NaCl + water; Control: scopolamine + water; EACJM50: scopolamine + EACJM (50 mg/kg/day); EACJM100: scopolamine + EACJM (100 mg/kg/day).
스코폴라민 투여 마우스에서 체중 및 조직무게에 대한 EACJM의 효과
실험기간 동안 EACJM이 실험동물의 체중 및 조직무게에 미치는 영향을 알아보기 위해 체중과 조직무게를 측정하였다(Table 1). 실험동물의 체중은 실험기간 동안 normal군 7.55 g, control군 7.32 g, EACJM50군 7.30 g, EACJM100군 7.00 g 증가하였으며, 실험시작 및 실험종료 시 각 군간 체중의 유의한 차이를 나타내지 않았다. 실험동물로부터 적출한 간과 신장 조직무게 역시 각 군간 유의적인 차이를 보이지 않았다. 그러나 뇌 조직의 경우 normal군 0.48 g에 비해 control군 0.45 g으로 뇌 조직무게가 유의적으로 감소하였으나 EACJM50 및 100군에서는 0.48 g으로 증가함을 확인하였다.
Table 1.
Effects of the ethyl acetate fraction of Cirsium japonicum var. maackii on the body and organ weights of scopolamine-injected mice
Values are means ± SD. a-b: Means with the different letters are significantly different (p < 0.05) by Duncan’s multiple range test. NS indicates no significance among experimental groups. Normal; 0.9% NaCl + water, Control; scopolamine + water, EACJM50; scopolamine + EACJM (50 mg/kg/day), EACJM100; scopolamine + EACJM (100 mg/kg/day).
스코폴라민 투여 마우스에서 혈청 AST 및 ALT에 대한 EACJM의 효과
EACJM이 생체 내에서 독성을 나타내는지 확인하기 위해 혈청 AST 및 ALT를 측정하였다(Fig. 6). 스코폴라민을 투여한 control군에서의 AST와 ALT 농도는 스코폴라민 대신 0.9% NaCl을 투여한 normal군에 비해 유의적으로 증가하였으나, 그 수치가 정상범위 내에 있음을 확인하였다(~298 U/L(AST), ~97 U/L(ALT)). 한편, EACJM를 투여했을 때 control군에 비해 AST와 ALT가 유의적으로 감소하였다.
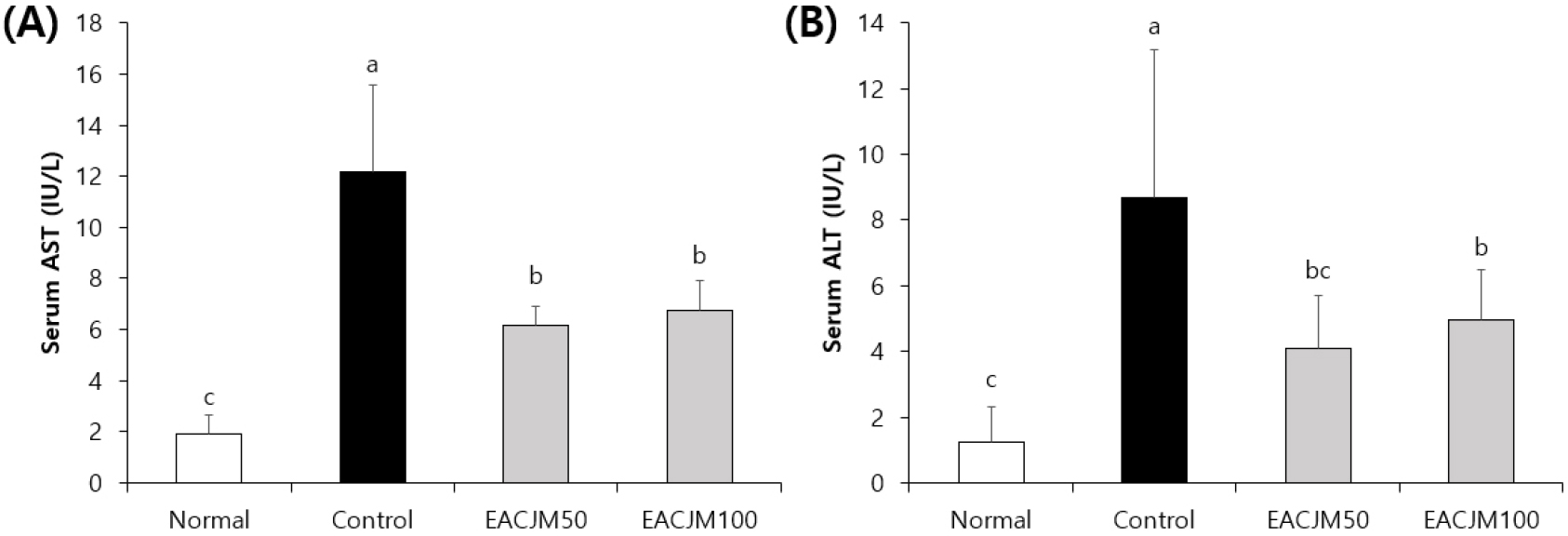
Fig. 6.
Effect of the ethyl acetate fraction of Cirsium japonicum var. maackii on aspartate aminotransferase (A) and alanine aminotransferase (B) levels in scopolamine-injected mice. Values are means ± SD. a - c: Means with different letters are significantly different (p < 0.05) as determined by Duncan’s multiple range test. Normal: 0.9% NaCl + water; Control: scopolamine + water; EACJM50: scopolamine + EACJM (50 mg/kg/day); EACJM100: scopolamine + EACJM (100 mg/kg/day).
스코폴라민 투여 마우스에서 뇌 내 AChE 및 신경영양인자 관련 단백질 발현에 대한 EACJM의 효과
EACJM이 스코폴라민 투여 실험동물의 뇌에서 AChE 및 신경영양인자의 활성에 영향을 미치는지 살펴보기 위해 관련된 단백질 발현을 측정하였다(Fig. 7). 먼저 AChE 관련 인자를 살펴보면, control군에서 AChE 단백질 발현이 normal군에 비해 유의적으로 증가함을 확인하였다. 그러나 EACJM100군에서 AChE 단백질 발현이 control군에 비해 유의적으로 감소했을 뿐만 아니라 normal군 보다 낮은 발현도를 나타내었다. 다음으로 신경영양인자를 살펴보면, control군의 뇌에서는 BDNF와 p-CREB/CREB 단백질 발현이 normal군에 비해 감소하였다(Fig. 8). 반면, EACJM 투여군에서는 control군에 비해 BDNF와 p-CREB/CREB의 발현이 유의적으로 증가하였는데, EACJM50군에서 이들 인자의 발현도가 특히 높은 것을 확인하였다.
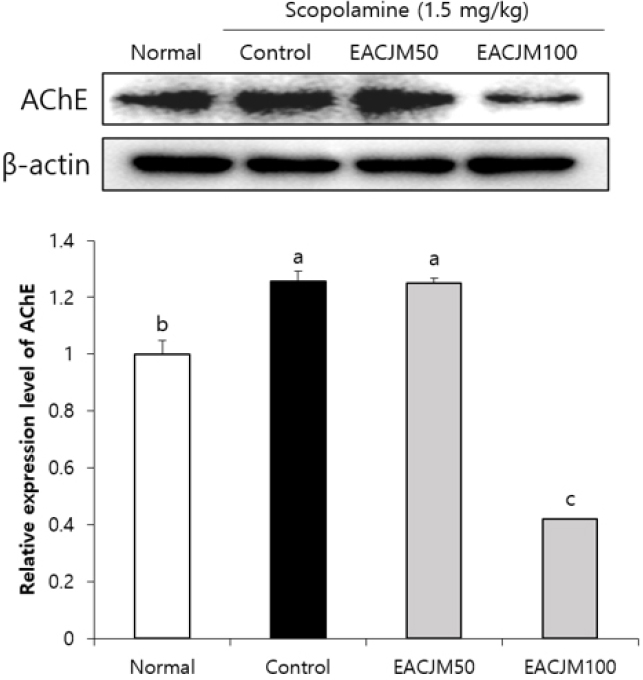
Fig. 7.
Effect of the ethyl acetate fraction of Cirsium japonicum var. maackii on acetylcholinesterase protein expression in scopolamine-injected mice. Values are means ± SD. a - c: Means with different letters are significantly different (p < 0.05) as determined by Duncan’s multiple range test. Normal: 0.9% NaCl + water; Control: scopolamine + water; EACJM50: scopolamine + EACJM (50 mg/kg/day); EACJM100: scopolamine + EACJM (100 mg/kg/day).
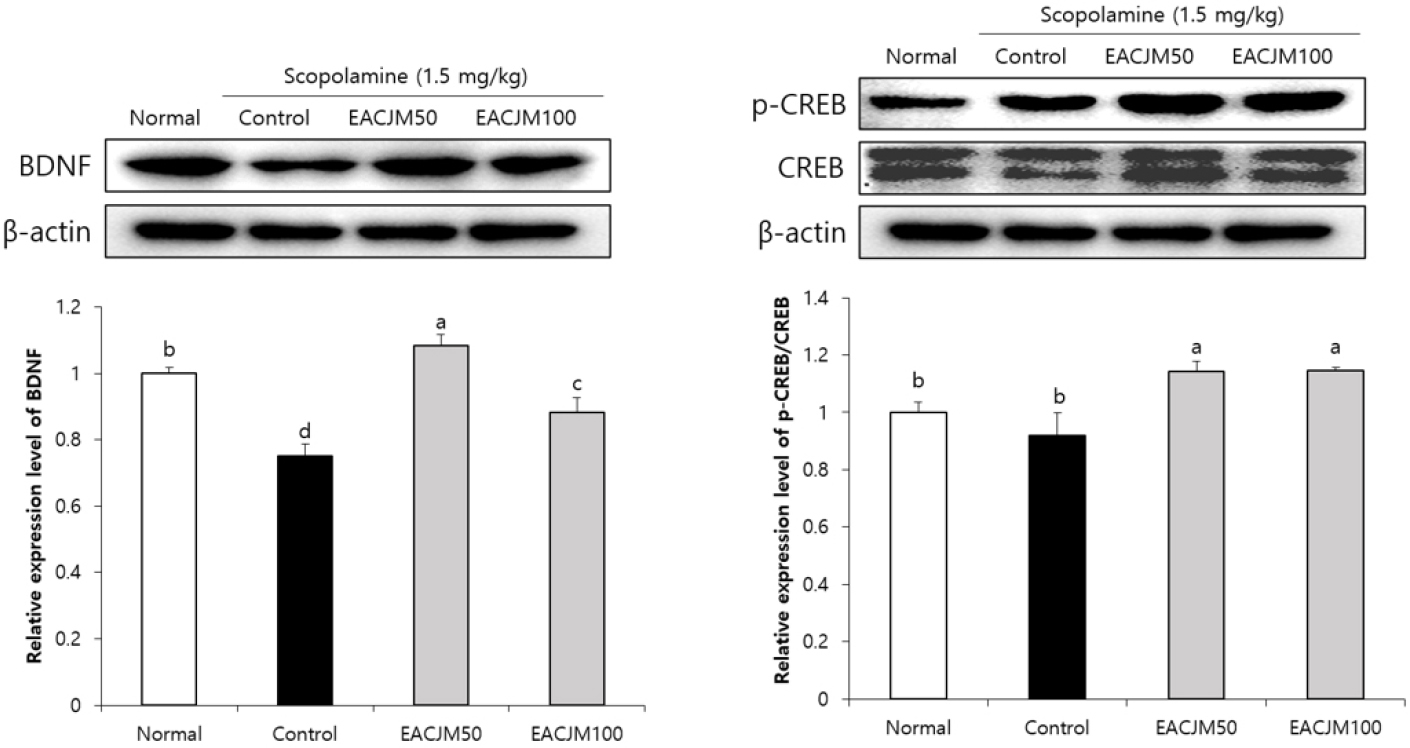
Fig. 8.
Effect of the ethyl acetate fraction of Cirsium japonicum var. maackii on brain-derived neurotrophic factor-related protein expression in scopolamine-injected mice. Values are means ± SD. a - d: Means with different letters are significantly different (p < 0.05) as determined by Duncan’s multiple range test. Normal: 0.9% NaCl + water; Control: scopolamine + water; EACJM50: scopolamine + EACJM (50 mg/kg/day); EACJM100: scopolamine + EACJM (100 mg/kg/day).
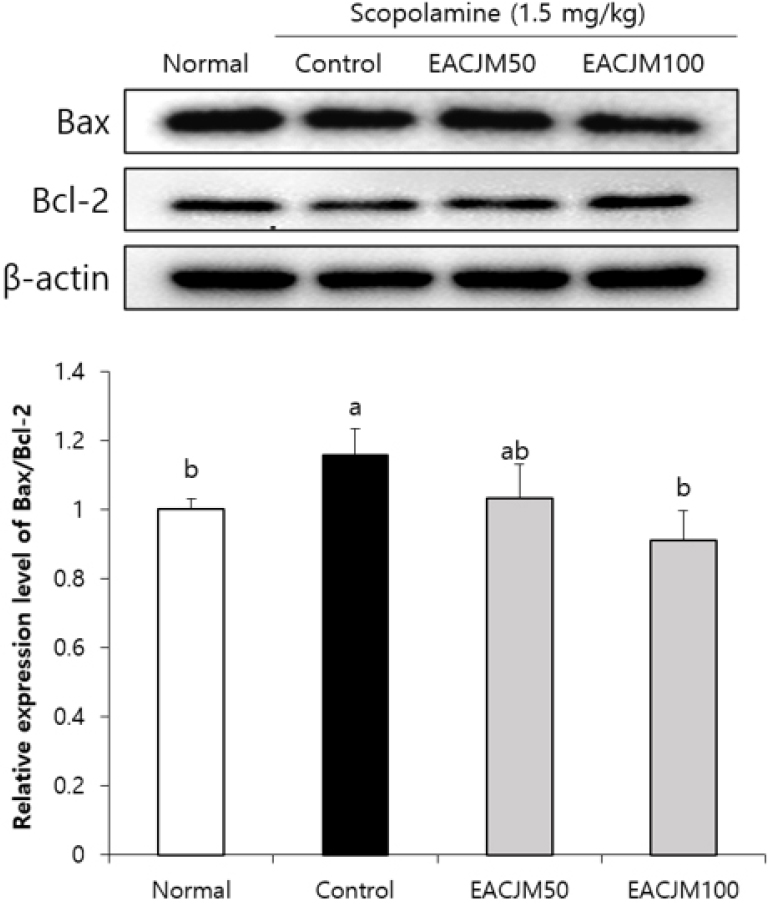
Fig. 9.
Effect of the ethyl acetate fraction of Cirsium japonicum var. maackii on apoptosis-related protein expression in scopolamine-injected mice. Values are means ± SD. a - b: Means with different letters are significantly different (p < 0.05) by Duncan’s multiple range test. Normal: 0.9% NaCl + water; Control: scopolamine + water; EACJM50: scopolamine + EACJM (50 mg/kg/day); EACJM100: scopolamine + EACJM (100 mg/kg/day).
스코폴라민 투여 마우스에서 뇌 내 세포사멸 관련 단백질 발현에 대한 EACJM의 효과
EACJM이 스코폴라민 투여 실험동물의 뇌에서 세포사멸에 영향을 미치는지 알아보기 위해 관련 단백질 발현을 측정하였다(Fig. 9). 그 결과, 스코폴라민 투여 control군의 Bax/Bcl-2 단백질 발현이 normal군과 비교했을 때 유의적으로 증가함을 확인하였다. 그러나 EACJM 투여군에서 Bax/Bcl-2 발현이 감소함을 확인하였으며, 특히 EACJM100군에서 Bax/Bcl-2 발현이 크게 억제되는 것을 확인하였다.
고찰 및 결론
본 연구에서는 스코폴라민 투여 실험동물에서 EACJM이 어떤 분자생물학적 메커니즘을 통해 인지능력 손상을 개선하였는지 확인하였다. 본 연구팀에서 수행한 선행연구에 따르면 엉겅퀴 추출 및 분획물 중 EACJM이 가장 우수한 신경교세포 보호 효과를 나타냈다(Kim et al., 2020). 이러한 결과를 바탕으로 본 연구에서도 EACJM을 사용하여 실험을 진행하였다.
스코폴라민은 무스카린 수용체(muscarinic receptor)의 길항제로서, 신경전달물질인 아세틸콜린과 무스카린 수용체 간의 결합을 저해한다. 이에 따라 뇌 내 정보전달이 일시적으로 차단되어 학습과 기억력이 손상되므로 알츠하이머 치매의 예방 및 치료 소재의 기억력 증진 효과를 검증하는 연구에 널리 이용되고 있다(Tanabe et al., 2004). 마우스는 새로운 공간에 대한 호기심이 많은 동물로, 이러한 마우스의 탐구적인 행동으로부터 착안하여 T-maze 실험이 고안되었다(Montgomery, 1952). T-maze 실험 결과, 스코폴라민을 투여한 control군은 기존의 통로와 새로운 통로를 탐색하는 비율에 유의적인 차이가 없어 normal군과 비교했을 때 공간지각능력이 손상됨을 확인하였다. 하지만 EACJM 투여군에서는 기존의 통로에 비해 새로운 통로를 탐색하는 횟수가 유의적으로 높아져 EACJM의 투여가 스코폴라민에 의해 손상된 공간인지능력을 개선할 수 있음을 확인하였다. 특히 EACJM100군에서는 새로운 통로를 탐색하는 비율이 normal군과 비슷한 수준을 나타내 우수한 공간인지능력 개선효과를 나타냈다.
새로운 물체를 접했을 때 마우스는 물체를 탐색하고 기억해둔 뒤 동일한 물체를 접하면 해당 물체에 대한 인식 시간이 줄어들며, 이러한 특성을 이용하여 NOR 실험이 고안되었다(Bevins and Besheer, 2006). NOR 실험을 실시한 결과, 스코폴라민을 처리한 control군에서 기존의 물체와 새로운 물체를 탐색하는 비율 간의 유의적인 차이는 없었다. 두 비율간 유의적 차이를 나타냈던 normal군과 비교하면 스코폴라민으로 인해 마우스의 물체인지능력이 감퇴됨을 확인하였다. 반면, EACJM을 투여했을 때 기존의 물체보다 새로운 물체를 인지하는 비율이 증가하였으며, 100 mg/kg/day 농도로 투여했을 때는 기존의 물체와 새로운 물체를 탐색하는 비율에서 통계적 유의성을 나타내어 스코폴라민으로 인해 감퇴된 물체인지능력이 EACJM에 의해 개선됨을 확인하였다.
마우스는 수중미로에서 주변에 있는 시각적 단서를 통해 자신의 위치를 인지할 수 있으며, 반복된 훈련을 통해 도피대가 있는 위치를 찾아낼 수 있다(Morris, 1984). 따라서 본 연구에서는 MWM를 통해 스코폴라민에 의해 기억력이 손상된 마우스에서 EACJM이 학습과 기억력에 미치는 영향을 평가하고자 하였다. MWM 실험 결과, 생리식염수 처리 normal군과 비교했을 때 스코폴라민 처리 control군에서 숨겨진 도피대를 찾아가는 시간이 더 오래 걸리므로 스코폴라민을 투여함으로써 학습 및 기억력에 손상이 발생함을 알 수 있었다. 반면, EACJM 처리군은 control군에 비해 더 빠르게 숨겨진 도피대를 찾아갔으며, 특히 EACJM100군은 normal군과 비슷한 속도로 숨겨진 도피대를 찾아내어 EACJM이 손상된 학습 및 기억력을 효과적으로 증진시킨다는 것을 확인하였다. 또한 도피대를 제거한 후 도피대가 있던 사분면에 머무르는 시간을 측정한 결과, control군은 normal군에 비해 해당 사분면에 머무르는 시간이 유의적으로 감소하였지만, EACJM 처리군은 control군보다 유의적으로 증가하여 학습 및 기억력 개선 효과를 확인하였다. 숨겨진 도피대를 찾아내는 MWM 실험 결과가 마우스의 시각 또는 운동능력에 영향을 받았는지 알아보기 위해 노출된 도피대에서 동일한 실험을 진행하였다. 그 결과, 모든 실험군 간의 결과에서 유의성이 나타나지 않았으므로 MWM 실험 결과는 마우스의 시각 또는 운동능력이 아닌 학습 및 기억력에 의해 나타났음을 확인하였다.
알츠하이머 치매는 뇌 내 Aβ 및 타우(tau) 단백질의 침착으로 산화적 스트레스가 발생하여 광범위한 신경세포 파괴가 일어난다. 이러한 신경세포의 파괴는 뇌 구조와 기능상의 변화를 일으켜 인지기능 저하로 이어지게 된다(Westman et al., 2011; Henneman et al., 2009). 특히 알츠하이머 치매 환자의 뇌에서는 뚜렷한 뇌 위축이 관찰되는데, 스코폴라민의 투여 역시 전반적인 인지기능의 저하와 함께 뇌 무게의 감소를 야기한다고 보고되었다(Jack et al., 2010; Memudu and Adewumi, 2021). 이에 따라 본 연구에서도 실험동물의 뇌 조직무게를 측정한 결과, 스코폴라민을 투여한 control군에서 normal군에 비해 뇌 조직무게가 유의적으로 감소하였다. 반면, EACJM을 투여했을 때 뇌 조직무게가 유의적으로 증가할 뿐만 아니라 normal군과 비슷한 수준으로 회복함을 확인하였다. 이전 연구에 따르면 EACJM은 산화적 손상으로 사멸된 신경세포 생존율을 증가시켜 세포 보호 효과를 나타낼 뿐만 아니라 전체 뇌 세포의 약 90%를 차지하는 신경교세포에서도 산화적 스트레스를 감소시켜 세포생존율을 높였으므로, EACJM이 신경 및 신경교세포의 파괴를 저해한 것으로 사료된다(Kim et al., 2021b; Lee et al., 2018). 본 연구결과를 바탕으로 엉겅퀴가 알츠하이머 치매의 주요 증상인 뇌 위축을 회복시킬 수 있는 지에 대해서는 추후 조직평가를 위한 brain atrophy 등의 추가 실험이 필요할 것으로 생각된다.
AST 및 ALT는 아미노산 합성에 관여하는 효소로, 체내에서 주로 간 세포 내에 존재한다. 독성물질 등에 의해 간 조직이 손상되면 이들 효소가 혈액으로 누출되므로 간 손상을 진단하기 위한 생화학적 지표로 널리 이용되고 있다(Fakurazi et al., 2008). 본 실험에서는 EACJM이 생체 내 독성을 유발하는 지 확인하기 위해 혈청 AST 및 ALT를 측정하였으며, 모든 군에서 AST 및 ALT 농도가 정상범위 내에 있음을 확인하였다. 다만 스코폴라민을 투여한 control군에서 normal군에 비해 AST와 ALT 농도가 유의적으로 증가하였는데, 이는 스코폴라민 복용으로 발생하는 부작용 중 하나인 간 독성이 나타난 것으로 사료된다. 그러나 EACJM을 섭취한 군에서는 control군에 비해 AST와 ALT 농도가 유의적으로 감소하였다. 이전 연구에 따르면 엉겅퀴 추출물은 tert-butyl hydroperoxide, H2O2, 그리고 EtOH로 유발한 간 손상에 대한 보호 효과를 나타냈다(Kim et al., 2017). 이들 연구결과를 토대로 EACJM은 간을 비롯한 체내에 독성을 나타내지 않음을 시사한다.
스코폴라민은 항콜린성 약물의 일종으로, 무스카린성 아세틸콜린 수용체(muscarinic acetylcholine receptor)에 길항제로 작용한다. 이를 통해 콜린 신경체계의 신호전달을 방해함으로써 기억력 및 인지능 손상을 유발하는 것으로 알려져 있다(Ebert and Kirch, 1998). 아세틸콜린은 콜린 신경체계에서 중요한 역할을 담당하는데, 그 농도를 일정하게 유지하기 위해 AChE에 의해 acetic acid와 choline으로 분해된다. 그러나 스코폴라민을 투여할 경우 AChE의 활성을 증가시켜 아세틸콜린의 분해를 촉진하여 아세틸콜린 농도를 감소시키는 것으로 보고되었다(Botton et al., 2010). 본 연구에서 Western blotting을 통해 AChE 단백질 발현을 측정한 결과, 스코폴라민을 투여한 control군에서 normal군에 비해 AChE 발현이 증가하였으나, EACJM100군에서 AChE 발현이 크게 감소함을 확인하였다. 엉겅퀴에 함유된 활성물질로 알려진 linarin은 in vitro 및 ex vivo 모델에서 AChE 활성에 대한 저해효과를 나타냈다(Feng et al., 2015). 이들 결과를 토대로 EACJM은 스코폴라민으로 유도된 AChE 활성화를 감소시켜 기억력 손상을 개선시킬 수 있을 것으로 기대된다.
BDNF는 신경세포의 성장을 조절하는 신경영양인자로, 중추신경계에서 아세틸콜린 합성효소의 활성을 증가시키고 시냅스 가소성을 강화한다(Alderson et al., 1990). 그러나 알츠하이머 치매 환자의 경우 뇌 내 BDNF 발현이 감소하는 것으로 알려져 있다(Murray et al., 1994; McAllister et al., 1999). 이러한 BDNF의 상위 조절인자인 CREB는 BDNF를 포함하여 기억 형성 및 강화와 관련된 다양한 유전자의 전사인자로 알려져 있다(Bourtchuladze et al., 1994). 뇌 조직에서 BDNF와 p-CREB/CREB의 단백질 발현을 측정한 결과, 스코폴라민을 투여한 control군에서 BDNF와 p-CREB/CREB의 발현이 감소하였다. 한편, EACJM을 투여했을 때, control군에 비해 BDNF와 p-CREB/ CREB의 발현이 모두 유의적으로 증가하였다. 엉겅퀴의 활성물질인 apigenin은 스코폴라민을 투여한 마우스에서 뇌에서 BDNF의 단백질 발현을 증가시키는 것으로 보고되었다(Kim et al., 2021a). 따라서 EACJM은 스코폴라민 투여 마우스의 뇌에서 CREB의 인산화를 촉진시켜 BDNF의 단백질 발현을 증가시킴으로써 인지능력을 회복하는 것으로 사료된다.
알츠하이머 치매 환자의 경우 뇌 내 산화적 스트레스가 증가하는데, 이 때 뇌 세포에서는 비가역적으로 세포사멸을 일으켜 세포를 손상시킨다(Paradis et al., 1996). 세포사멸에 관여하는 Bcl-2 family는 pro-apoptotic 인자인 Bax와 anti-apoptotic 인자인 Bcl-2 등으로 구성된다. 이들은 미토콘드리아에 존재하며 세포사멸 기전에 관여하는데, 산화적 스트레스 하에서 Bax는 미토콘드리아 막으로 이동하여 cytochrome C와 같은 다른 pro-apoptotic 인자를 유출시키는 역할을 한다. 반면, Bcl-2는 pro-apoptotic 인자들의 유출을 막아 세포사멸을 억제하는 역할을 담당한다(Bagci et al., 2006). 뇌 조직에서 Bax/Bcl-2 단백질 발현을 측정한 결과, 스코폴라민을 투여한 control군에서 normal군에 비해 Bax/Bcl-2 발현이 유의적으로 증가하여 세포사멸이 유도됨을 확인하였다. 반면, EACJM 투여 군에서는 Bax/Bcl-2 단백질 발현이 control군에 비해 유의적으로 감소하는 것으로 나타났다. EACJM은 Aβ를 처리한 C6 신경교세포에서도 Bax/Bcl-2 단백질 발현을 감소시켰을 뿐만 아니라 엉겅퀴 활성물질인 apigenin은 스코폴라민 투여 마우스의 뇌에서 Bax/Bcl-2 및 하위 인자인 caspase-3와 poly(ADP-ribose) polymerase의 단백질 발현도 조절하였다(Memudu and Adewumi, 2021; Kim et al., 2019). 따라서 EACJM은 스코폴라민에 의한 신경교세포와 같은 뇌 세포의 사멸을 억제함으로써 전반적인 뇌 위축을 완화하는 것으로 사료된다.
본 연구에서는 스코폴라민 투여 동물모델에서 EACJM의 인지능력 개선 메커니즘을 확인하였다. 스코폴라민을 투여한 동물모델에서 EACJM은 공간인지능력, 물체인지능력, 그리고 학습 및 기억력을 개선시킴으로써 기억력 개선 효과를 나타냈다. 또한 기억력과 관련된 AChE 단백질 발현을 감소시키고, BDNF와 p-CREB/CREB 단백질 발현을 증가시켰으며, 세포사멸과 관련된 Bax/Bcl-2 단백질 발현을 감소시킴으로써 인지능력을 향상시키고 뇌 실질 감소를 완화시킨 것으로 나타났다. 따라서 엉겅퀴는 인지능력 개선을 위한 예방 및 치료소재로 활용할 수 있을 것으로 기대된다.




