서 론
재료 및 방법
식물재료의 선발
차광수준과 환경
조사항목과 조사방법
통계분석
결과 및 고찰
차광처리에 따른 식물의 크기 변화
생체중과 수분함량 분석
엽록소 수치와 CIELAB 엽색상 평가
요 약
서 론
오랜 논의와 분류학적 연구를 통해 기린초속(Phedimus)은 돌나물속(Sedum)에서 분리되어 새로운 속으로 인정되었다(Ohba et al., 2000). 돌나물속 식물은 수염뿌리 혹은 부정근을 가지지만 기린초속 식물은 주근을 가지고 있으며 기린초속은 직립하여 생장하지만 돌나물속은 포복하거나 직립하는 특성을 모두 가졌다(Moon and Jang, 2020). 돌나물속과 기린초속의 꽃은 취산화서로 달리며 일반적으로 기린초속은 대체로 정단에서 개화하고 돌나물속은 정단과 분지에서 모두 개화하는데 이러한 점에서 약간의 차이가 있다. 기린초속 식물들은 아시아와 일부 유럽국가에서 20여 종이 다양하게 분포한다(Hart and Bleij, 2003). 그중 우리나라에서는 몇 가지 고유한 기린초속 식물들이 존재하는데 태백기린초(P. latiovalifolium)와 속리기린초(P. zokuriensis) 그리고 섬기린초(P. takesimensis)가 대표적이다. 그 중 섬기린초는 울릉도와 독도에서 자생하는 한반도의 고유종으로(Seo et al., 2020), 국가적인 차원에서 보호해야할 식물자원이다.
섬기린초는 약용식물로써의 잠재력을 가지고 있는데, 섬기린초는 14가지의 페놀성분을 함유하였으며 그중 2가지 페놀화합물은 LDL(low-density lipoprotein) 산화에 큰 억제효과가 있는 것으로 나타났다(Thuong et al., 2007). 이뿐만 아니라 섬기린초는 항염증에도 효능이 있는 것으로 나타났으며(Jang et al., 2016; Jeong et al., 2021a; Jeong et al., 2021b), 여드름 원인균(Cutibacterium acnes)에 대한 항균효과가 있는 것으로 나타났다(Jeong et al., 2021a). 섬기린초 추출물은 신경세포의 사멸을 억제하고 코티코스테론(corticosterone) 유도 신경독성으로부터 세포를 보호하는 것으로 나타났다(Yun and Jeong, 2020).
섬기린초는 돌나물과(Crassulaceae)에 속해있기 때문에 다육식물로 구분할 수 있는데, 다육식물의 특성상 혹독하고 건조한 환경에서도 재배가 가능하고(Nam et al., 2016), 병충해가 거의 없어 관리가 어렵지 않아 대량 재배도 가능할 것으로 전망된다. 분화재배는 화분의 크기에 따른 한정된 용토의 부피와 제한된 토양 수분함량을 가지고 있으며, 이에 따라 상대적으로 노지 재배에 비해 집약적인 관리 요구도가 높은 편이다. 그러나 분화재배 식물은 유통이 쉽고 적은 자원으로도 재배할 수 있다는 장점이 있다. 분화재배에 주로 사용되는 상용 플라스틱 화분은 주로 갈색이나 검은색 등 어두운 색상이 유통된다. 따라서 무차광 환경에서는 태양빛에 의해 화분 내 토양의 온도가 과도하게 오르기 쉽고 이에 따라 토양수분의 증발산은 더 커질 수 있으며 이는 식물에게 복합적인 스트레스 요인으로 작용할 수 있다. 따라서 차광재배를 적용할 경우 재배시설의 환경을 보다 안정화시킬 수 있고 식물의 스트레스를 줄이고 관리요구도를 낮추어 노동력을 절감시킬 수 있다.
과거 연구에서 식물 캐노피(plant canopy)와 같은 차광환경은 식물의 열 스트레스를 개선하고 잎의 증발산을 감소시키고(Callaway, 2007), 일부 식물의 생장을 촉진시키는 등 긍정적인 영향을 주는 것으로 나타났다(Greenlee and Callaway, 1996). 한편, 인위적인 차광환경은 차광망(shade net), 차광막(shade film) 등을 통하여 조성할 수 있는데, 과거 차광수준별 식물의 생장 반응 분석(Jang et al., 2022; Lee et al., 2021; Lee et al., 2022c; Park and Kim, 2021), 차광재료에 따른 차광효과 연구(Choi, 2016; Jung et al., 2019; Kang et al., 2020), 등 다양한 차광환경에 대한 연구가 수행되었다.
이에 본 연구에서는 섬기린초 ‘아틀란티스’(P. takesimensis cv. Atlantis) 품종을 실험식물로 공시하였으며 분화재배에서 차광처리가 식물의 생장과 엽색에 어떠한 영향을 미치는지에 관하여 조사 및 분석하였다.
재료 및 방법
식물재료의 선발
재료로 사용된 식물로는 국립농업과학원 농업유전자원센터의 식물유전자원 중 섬기린초 ‘아틀란티스’(Phedimus takesimensis cv. Atlantis, 유전자원번호 IT345943) 품종을 실험식물로 공시하였다. 실험 적용할 균일한 식물체를 생산하기 위해 25%의 차광수준을 가진 실험온실에서 식물체의 줄기를 2 cm 크기로 잘라 경삽으로 번식시켰으며, 액아가 2 cm가 발달된 것들 중 균일한 것들만 따로 선별하여 본 실험에서 사용하였다.
차광수준과 환경
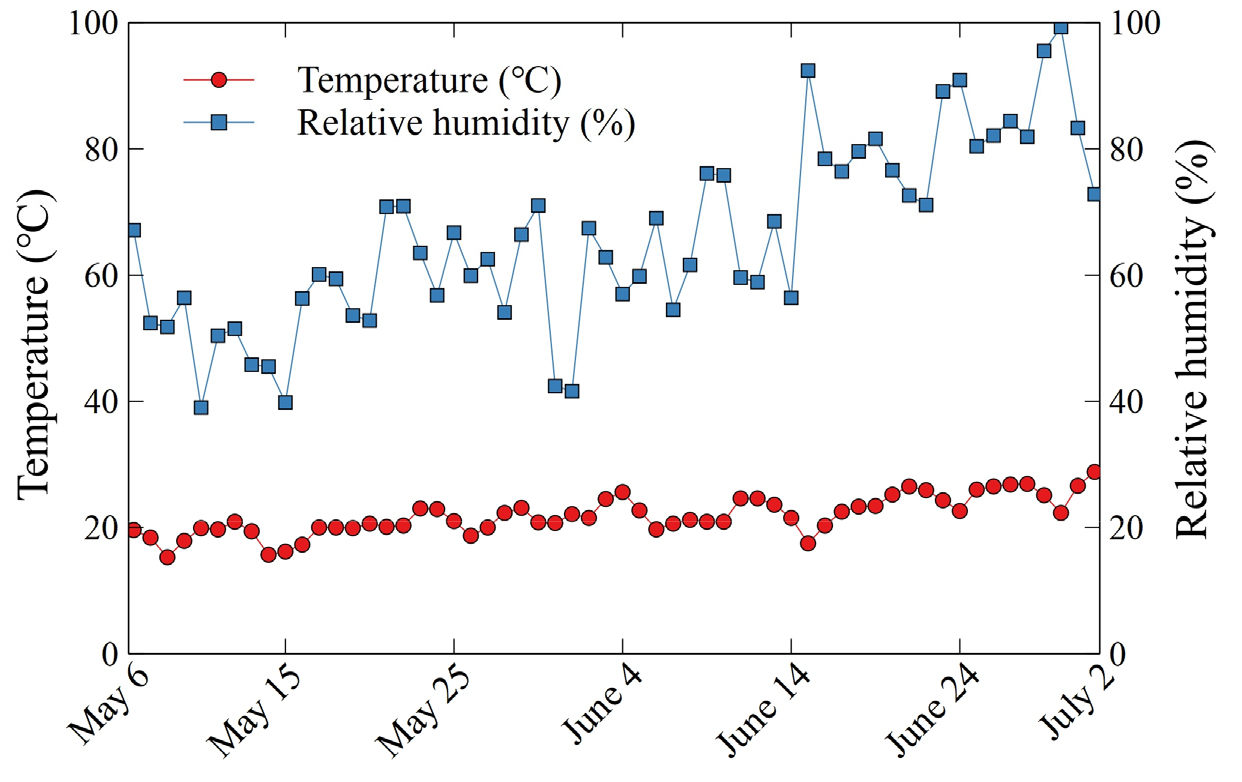
실험은 삼육대학교 환경원예학과 실험온실(37°38’40”N 127°06’25”E)에서 2022년 5월 6일부터 7월 2일까지 총 8주간 진행하였다. 지름과 높이가 각각 11 × 10.5 cm인 상용 원형 플라스틱 화분에 식물을 식재하였으며, 분용토로는 마사토와 강모래, 원예용상토(Hanareumsangto, Shinsung Mineral, South Korea)를 부피별로 각각 6 : 3 : 1(v/v/v)의 비율로 혼합시킨 다육식물용 배지를 만들어 사용하였다. 이때, 경삽을 통해 액아를 발달시킨 삽수들을 화분별로 각 한 개씩 화분의 중앙에 위치시켜 재식하였다. 본 연구에서 차광수준은 0%(무차광), 35%(온실유리), 45%(온실유리와 투명 PE 1겹), 60%(온실유리와 백색 PE 1겹), 75%(온실유리와 백색 PE 2겹), 99%(온실유리와 흑색 PE 1겹)의 여섯 단계로 나누었다. 각기 다른 차광수준에 대해서는 휴대용 분광복사계(SpectraPen mini, Photon Systems Instruments, Czech Republic)를 사용하여 측정하였다. 이때, 실험기간 동안 오후 1시에 날이 맑은 날 중 무작위로 측정하였으며 매주 1회 씩 각 차광수준별 측정하였다. 태양광이 온실유리와 차광막을 통과하여 식물에 도달하는 PPFD(photosynthetic photon flux density)를 기록하여 Table 1에 그 평균값과 표준편차를 나타내었다. 실험기간동안 평균온도는 21.8 ± 3.0°C였으며, 상대습도는 65.9 ± 14.4%였다(Fig. 1). 관수는 주 2회 살수관수 하였다. 실험은 완전임의배치법(completely randomized design)으로 5개체 3반복으로 각 처리별 배치하였다.
Table 1.
Photosynthetic photon flux density (PPFD) values of plants grown under different relative shading levels; the values were measured at 1:00 p.m. every week (37°38’40”N 127°06’25”E)
| Standard shading levels (%) | Relative shading levels (%) | PPFD (µmol m-2 s-1) |
| 0 | 0 | 1798.4 ± 183.0z |
| 35 | 36.14 | 1148.4 ± 174.3 |
| 45 | 45.84 | 974.0 ± 153.8 |
| 60 | 59.87 | 721.6 ± 94.1 |
| 75 | 74.34 | 461.4 ± 67.2 |
| 99 | 99.08 | 16.5 ± 3.8 |
조사항목과 조사방법
다양한 차광수준에 영향을 받은 섬기린초 ‘아틀란티스’ 품종의 생장과 엽색 변화를 평가하기 위해 초장, 초폭, 근장, 초장과 근장의 비율(S/R ratio), 엽장, 엽폭, 엽장과 엽폭의 비율(L/W ratio), 지상부와 지하부 생체중, 지상부 생체중과 지하부 생체중의 비율(FS/FR ratio), 지상부와 지하부 건물중, 지상부 건물중과 지하부 건물중의 비율(DS/DR ratio), 지상부 수분함량, 지하부 수분함량, CIELAB L*, a*, b*, CIE color difference (ΔE*ab), RHS 고유번호 값을 조사 및 평가하였다. 이때, 조사항목의 조사 방법에서 초장은 지면에서부터 식물체가 가장 높게 솟아있는 높이까지를 측정하였으며, 엽폭은 식물을 위에서 바라볼 때 가장 넓은 부위를 기준으로 하여 측정하였다. 근장은 식물의 뿌리 중 가장 긴 뿌리를 기준으로 하여 측정하였고, 엽장과 엽폭은 각 식물의 잎 중 3개의 잎을 무작위로 선정하여 측정하였다. 지상부와 지하부 생체중은 식물을 흐르는 물에 씻은 후 밀폐된 장소에서 24시간 동안 자연건조시킨 후 측정하였다. 지상부와 지하부 건물중은 건조기(HK-DO135F, HANKUK S&I, South Korea)를 활용하여 85°C로 설정 한 뒤 24시간 동안 가동시켜 식물체를 건조시킨 후 측정하였다. 이때, 식물체가 가진 수분함량을 알아보기 위해 생체중과 건물중을 대조하여 2차 분석하였으며 이는 식 (1)과 같다.
(는 수분함량, 는 생체중, 는 건물중을 나타낸다)
엽록소 수치(SPAD units)는 휴대용 엽록소계(SPAD-502, Konica Minolta, Japan)를 이용하여 각 식물별로 3개의 잎을 무작위로 선정하여 그 중앙부를 측정하였다. CIELAB 값의 측정은 Lee et al.(2022a)의 엽색 측정 방식을 참고하여 분광광도계(CM-2600d, Konica Minolta, Japan)를 CIELAB D65/10°로 설정한 뒤 측정하였다. 이때, CIELAB의 측정은 엽록소 수치에 대한 측정과 마찬가지로 각 식물별로 3개의 잎을 무작위로 선정하여 그 중앙부를 측정하였으며 정반사광(SCI)이 포함 된 CIELAB L*, a*, b* 값을 얻었다. 각기 다른 차광수준이 식물에게 미치는 영향을 비교하기 위해 0% 차광수준을 참조(reference)로 설정하여 나머지 차광수준에 대해 CIE76 ΔE*ab를 기준으로 각각의 처리별 색차를 계산하였다. 이때, CIE76 color difference(ΔE*ab)에 관한 식 (2)은 다음과 같다(CIE, 2004).
(이때, 이 실험에서 ΔE*ab ≤ 1.5 수준은 색차 없음 혹은 미세한 색차, 1.6-3.0 수준은 매우 적은 색차 있음, 3.1-6.0 수준은 적은 색차 있음, 6.1-9.0 수준은 색차 있음, 9.1-12.0 수준은 큰 색차 있음, ≥ 12.1 수준은 매우 큰 색차 있음 혹은 완전히 다른 색상으로 간주한다)
RHS 값은 각각의 L*, a*, b* 값을 Royal Horticultural Society Colour Chart 시스템(RHSCCS, 2022)과 대조하여 가장 근사치에 있는 2개의 고유색상 번호를 선정하여 엽색을 평가하였다. 조사된 CIELAB L*, a*, b* 값은 Zettl(2022)이 설계한 Converting Colors를 활용하여 육안평가를 위한 평가색상(converted color)으로 변환하였다.
통계분석
실험 결과의 분석은 SAS 9.4(SAS Institute, USA)을 사용하여 분산분석(ANOVA)을 수행하였다. 평균간 비교는 p < 0.05 수준의 던컨의 다중검정(Duncan’s multiple range test)으로 통계분석 하였다.
결과 및 고찰
차광처리에 따른 식물의 크기 변화
차광망(shade net) 혹은 차광막(shade film) 등을 활용한 인위적인 차광환경의 조성은 급격한 환경변화로부터 식물들을 보호하며(Fowler and Chaffee, 2010; Semchenko et al., 2012), 특히 수분과 온도에 관련된 비생물적 스트레스 요인의 제어에 효과적이다.
다양한 차광수준에 영향을 받은 섬기린초 ‘아틀란티스’(Phedimus takesimensis cv. Atlantis)의 식물체 크기는 처리별로 서로 상이한 결과를 나타내었다(Table 2 and Fig. 2). 식물의 생존율은 0-60% 차광수준에서 100%의 생존율을 나타내었으나 75% 차광수준에서는 86.6%의 생존율을 나타내었고 99% 차광수준에서는 0% 생존율을 나타내었다. 과거 연구에서 속리기린초(Sedum zokuriense)는 98% 차광수준에서 31.4% 생존율을 나타내어 본 연구와 달리 낮은 광도수준에서도 일부 개체들의 생존이 가능한 것으로 나타났는데(Lee et al., 2021), 산지의 교목 아래에서 자생하는 속리기린초의 경우 내음성이 강해 일부 개체는 높은 수준의 차광환경에서도 생존이 가능하지만 섬의 암석지대와 같은 노출된 직사광선 환경에서 주로 자생하는 섬기린초(P. takesimensis)는 높은 수준의 차광환경에서는 생존이 어려운 것으로 보이며, 특히 무늬품종(variegated cultivar)인 ‘아틀란티스’의 특성상 과도한 차광수준에서는 생존이 더욱 어려웠을 것으로 생각되었다. 차광환경으로부터 얻을 수 있는 식물의 생장 결과는 각 종의 스트레스 내성에 따라 다른데(Semchenko et al., 2012), 본 연구와 과거 연구의 비교를 통해 동일한 속 내에서도 종에 따라 내음성이 다를 수 있음을 알 수 있었다.
Table 2.
Survival rate and plant size parameters of Phedimus takesimensis cv. Atlantis plants grown under different shading levels for 8 weeks
|
Shading treatment (%) |
Survival rate (%) | Plant sizes (cm) | S/R ratioz | Leaf sizes (cm) | L/W ratioy | |||
| Shoot height | Shoot width | Root length | Length | Width | ||||
| 0 | 100 | 7.16 cx | 7.86 c | 18.62 a | 0.38 b | 2.32 b | 1.25 b | 1.85 a |
| 35 | 100 | 7.12 c | 11.22 ab | 18.45 a | 0.38 b | 2.88 a | 1.78 a | 1.64 a |
| 45 | 100 | 8.85 a | 13.98 a | 18.58 a | 0.47 ab | 2.95 a | 1.77 a | 1.66 a |
| 60 | 100 | 8.41 ab | 10.94 ab | 16.51 b | 0.51 a | 2.96 a | 1.73 a | 1.70 a |
| 75 | 86.6 | 7.56 bc | 8.9 bc | 16.73 b | 0.45 ab | 2.11 b | 1.25 b | 1.71 a |
| 99 | 0 | - | - | - | - | - | - | |
| Significancew | ** | *** | ** | *** | *** | *** | NS | |
표현형의 가소성(phenotypic plasticity)은 식물의 생장 환경이 변화할 때 그 환경에 대응 할 수 있도록 식물의 형태적 특성을 변형시키는 능력이다(Bradshaw, 1965; DeWitt et al., 1998; Sultan, 1987). 표현형의 가소성을 가장 쉽게 나타내도록 유도하는 방법 중 하나는 인위적인 차광환경을 조성해주는 것이며 이로 인해 나타나는 소성 변화를 그늘 유도 표현형(shade-induced phenotype)이라고 부른다(Weijschede et al., 2006). 이때, 일반적으로 그늘 유도 표현형의 결과로 줄기의 신장, 엽면적의 증대 등을 기대할 수 있다. 섬기린초 ‘아틀란티스’의 초장은 45% 차광수준에서 8.85 cm로 가장 큰 것으로 나타났으며, 초장과 동일하게 초폭 또한 45% 차광수준에서 13.98 cm로 가장 큰 것으로 나타나 적정 차광수준에서는 식물체 크기 증대에 긍정적인 영향을 미치는 것으로 보인다. 한편, 0-35% 차광수준에서는 45% 차광수준에 비해 낮은 초장과 초폭을 나타내었는데 직사광선이나 고광도의 환경에서는 토양 수분의 빠른 증발산, 차광처리구에 비해 높은 자외선량, 엽온도의 상승 등으로 인해 ‘아틀란티스’의 생장에 방해가 되는 것으로 보인다. 과거 연구에서 속리기린초는 65% 차광수준에서 가장 높은 초장을 나타내어(Lee et al., 2021), ‘아틀란티스’가 속리기린초 보다 그늘 회피 반응(shade avoidance response)을 더 민감하게 나타내는 것으로 보인다. 한편, 바위솔국(Delosperma cooperi)은 50% 차광 수준에서 가장 높은 초장을 나타내어(Lee et al., 2022c), 본 실험의 결과와 유사하였다. 던컨의 다중검정(Duncan’s multiple range test)에서 근장은 0-45% 차광수준에서 동등한 유의수준으로 나타났으며, 세부적인 근장의 길이는 0 > 45 > 35%(각각 18.62, 18.58, 18.45 cm) 차광수준 순으로 나타났다. 과거 열대림에서 채집된 55종의 나무 묘목들은 대체로 척박하거나 건기가 지속된 토양에서 가늘고 긴 근장을 나타내었으며 토양 심층까지 지하부를 형성하였다는 보고가 있었는데(Paz, 2006), 본 연구에서는 태양광으로 인한 화분 내 토양 수분함량 저하가 ‘아틀란티스’의 근장 증가에 영향을 미친 것으로 추측되었다.
초장과 근장의 비율을 타나내는 S/R ratio는 60% 차광수준에서 0.51로 가장 높게 나타나 해당 차광수준에서는 근장 대비 초장의 크기가 가장 큰 것으로 분석되었다. 많은 식물들은 차광환경에서 줄기 신장의 가속화, 분지의 생성 억제, 엽면적 증대, 지하부 생장 감소로 반응하는데(Ballare et al., 1994; Sultan, 2000), 이처럼 과거 연구에서 언급된 것과 같이 ‘아틀란티스’는 60% 차광수준에서 줄기의 신장 가속화, 지하부 생장 감소 등의 복합적인 요인이 가장 크게 작용했던 것으로 보인다. 엽장은 던컨의 다중검정에서 35-60% 차광수준이 동등한 유의수준으로 나타났으며 이때, 60 > 45 > 35%(각각 2.96, 2.95, 2.88 cm) 차광수준 순으로 나타났다. 엽폭 또한 엽장과 유사하게 던컨의 다중검정에서 35-60% 차광수준이 동등한 유의수준으로 나타났으며, 35 > 45 > 60%(각각 1.78, 1.77, 1.73 cm) 차광수준 순으로 나타났다. 따라서 ‘아틀란티스’는 위와 같은 적절한 차광수준에서는 수광면적을 극대화 하는 것으로 보인다. 한편, 75% 차광수준에서는 0% 차광수준에 비해 엽장이 약 9% 정도 줄어드는 것으로 나타나 75% 이상의 차광수준부터는 탄소동화작용(carbon dioxide assimilation) 수행이 어려워지는 것으로 보인다. 엽장과 엽폭의 비율을 나타내는 L/W ratio는 처리 간 유의미한 차이가 없는 것으로 나타났다.
‘아틀란티스’의 식물체 크기, 잎의 크기 등을 종합적으로 평가한 결과 식물의 크기를 유의미하게 증대시키고자 하는 경우 45% 차광수준에서 재배할 것을 권고한다.
생체중과 수분함량 분석
섬기린초 ‘아틀란티스’는 생체중과 수분함량 분석에서 다양한 결과를 나타내었다(Table 3). 식물의 지상부 생체중은 45% 차광수준에서 9.31 g로 가장 높게 나타나 초장과 초폭의 결과와 유사하였다. 과거 연구에서 속리기린초는 65% 차광수준에서 가장 높은 지상부 생체중을 나타내어(Lee et al., 2021), 초장, 초폭의 결과와 같이 동일한 속 내에서도 종에 따라 적정 차광수준이 다를 수 있음을 알 수 있었다. 지하부 생체중은 0-45% 차광수준에서 동등한 유의수준으로 나타났으며 순서대로 45 > 0 > 35%(각각 0.38, 0.37, 0.35 g) 차광수준 순으로 나타나 지하부의 건실한 생장을 유도하기 위해서는 상대적으로 높은 광도수준을 유지시켜야 함을 알 수 있었다.
Table 3.
Fresh weight, FS/FR ratio, dry weight, DS/DR ratio, and moisture content of P. takesimensis cv. Atlantis plants grown under different shading levels for 8 weeks
|
Shading treatment (%) | Fresh weight (g) | FS/FR ratioz | Dry weight (g) | DS/DR ratioy |
Shoot moisture content (%) |
Root moisture content (%) | ||
|
Shoot weight |
Root weight |
Shoot weight |
Root weight | |||||
| 0 | 5.24 bx | 0.37 a | 13.2 d | 0.45 ab | 0.12 a | 3.76 c | 90.9 c | 68.4 c |
| 35 | 6.56 b | 0.35 a | 20.8 b | 0.46 ab | 0.11 a | 4.77 b | 92.6 b | 67.3 d |
| 45 | 9.31 a | 0.38 a | 25.1 a | 0.66 a | 0.10 a | 6.21 a | 92.8 b | 71.2 b |
| 60 | 5.34 b | 0.24 b | 21.6 b | 0.34 b | 0.06 b | 5.52 ab | 93.9 a | 70.4 bc |
| 75 | 5.18 b | 0.27 b | 15.7 c | 0.30 b | 0.07 b | 4.10 bc | 88.4 d | 74.4 a |
| 99 | - | - | - | - | - | - | - | - |
| Significancew | *** | *** | ** | *** | *** | ** | ** | ** |
지상부 생체중과 지하부 생체중의 비율을 나타내는 FS/FR ratio는 45% 차광수준에서 25.1로 가장 높게 나타나 해당 차광수준에서 지하부 대비 지상부의 생장이 더 극대화 되는 것으로 보인다. 지상부 건물중은 45% 차광수준에서 0.66 g으로 가장 높게 나타나 지상부 생체중의 결과와 동일하였다. 한편, 지하부 건물중 또한 마찬가지로 지하부 생체중과 동일하게 0-45% 차광수준에서 동등한 유의수준으로 나타났으며 순서대로 0 > 35 > 45%(각각 0.12, 0.11, 0.10 g) 차광수준 순으로 나타나 0% 차광수준에서 재배하는 것이 ‘아틀란티스의’ 지하부 생장에 가장 긍정적인 결과를 유도함을 알 수 있었다. 지상부 건물중과 지하부 건물중의 비율을 나타내는 DS/DR ratio는 45% 차광수준에서 6.21로 가장 높게 나타나 앞선 조사항목들과 결과가 유사하였다. 지상부 수분함량은 60% 차광수준에서 93.9%로 가장 높게 나타나 해당 차광수준에서는 세포의 크기가 비대해지고 이에 따라 다량의 수분을 비축하는 것으로 생각되었다. 한편, 지하부 수분함량은 75% 차광수준에서 74.4%로 가장 높게 나타났다. 과거 연구에서 바위솔국은 95% 차광수준에서 가장 높은 지상부, 지하부 수분함량을 나타내어(Lee et al., 2022c), 같은 다육식물 내에서도 종에 따라 차광수준에 따른 수분함량의 변화가 다르게 나타남을 알 수 있었다.
일명 돌나물형 유기산 대사(Crassulacean acid metabolism)라 불리는 CAM 광합성은 1960년에 발견되었는데(Ranson and Thomas, 1960), 식물이 과도한 수분 스트레스를 받을 때 작동하며 대부분의 다육식물은 이와 같은 특수한 탄소동화작용으로 수분 스트레스에 저항한다. CAM 식물의 뿌리는 토양이 건조할 때는 수분 손실을 최대한으로 줄이며 강우 등으로 인해 토양이 다시 높은 수분함량을 가질 때 수분 흡수율을 빠르게 회복하는 특징이 있다(Kausch, 1965; Nobel and Cui, 1992; Nobel and Sanderson, 1984; North and Nobel, 1991; North and Nobel, 1992). CAM 광합성은 C3나 C4 광합성에 비해 최대 5배의 수분 활용 효율을 나타내지만(Drennan and Nobel, 2000), 많은 탄수화물을 생산하는 것이 아닌 생존에 초점이 맞춰져 있다. 그렇기 때문에 CAM 광합성은 C3나 C4와 비교했을 때 상대적으로 적은 양의 탄수화물을 생산하며, 이러한 특성으로 식물의 왕성한 생장이 요구되는 경우 그러한 측면에서는 불리하게 작용한다. 다육식물은 충분한 토양 수분함량 유지가 가능한 경우 C3나 C4로 전환하여 광합성을 수행하기 때문에(Wai et al., 2019), ‘아틀란티스’가 CAM 광합성으로 전환되지 않도록 차광환경 조성을 통해 토양의 온도 상승을 방지하고 토양수분의 증발산을 방지하는 등 적절한 토양 수분관리가 필요할 것으로 보인다. 과거 연구에서 CAM 식물인 아이스플랜트(Mesembryanthemum crystallinum)는 토양에 수분이 충분할 때 C3 광합성을 하지만 건조한 조건에서는 CAM 광합성 경로에 의해 탄소를 고정시키는 것으로 나타났다(Bloom and Troughton, 1979). 결론적으로 이러한 내용들을 토대로 했을 때 45% 정도의 차광수준이 토양의 수분함량 유지 및 식물의 적절한 그늘 회피 현상 발현에 긍정적인 영향을 미친 것으로 보인다. 이 보다 낮은 차광수준에서는 상대적으로 낮은 토양수분, 광 스트레스 등 복합적인 비생물적 스트레스 요인이 생장 저해에 영향을 미친 것으로 보인다. 한편, 이 보다 더 높은 차광수준에서는 광합성 수행 종류에 영향을 준 것 보다는 광합성의 총량을 저해시키는 쪽으로 영향을 미치기 시작한 것으로 생각되었으며, 이에 따라 60% 이상의 차광수준부터는 상대적으로 ‘아틀란티스’의 생체중과 건물중이 점진적으로 낮아지는 것으로 보인다.
결과적으로 생체중과 수분함량 분석의 조사항목들을 토대로 할 때, ‘아틀란티스’의 지상부 생장에 중점을 두는 경우 45% 차광수준에서 재배할 것을 권고하며 지하부 생장에 중점을 두는 경우 0-45%의 차광수준 내에서 재배할 것을 권고한다.
엽록소 수치와 CIELAB 엽색상 평가
엽록소 수치(SPAD units)와 CIELAB 엽색상 평가에서 섬기린초 ‘아틀란티스’는 다양한 결과를 나타내었다(Table 4). 엽록소 수치는 0% 차광수준에서 43.39로 가장 높게 나타났고, 0 > 35 > 45 > 60 > 75% 순으로 나타나 광도수준이 높아질수록 상대적으로 더 많은 엽록소를 나타내는 경향을 보였다. 과거 연구에서 속리기린초는 80% 차광 수준에서 가장 높은 엽록소 수치를 나타내어(Lee et al., 2021), 본 연구의 결과와 상반되었다. 한편, 산마늘(Allium victorialis var. platyphyllum)과 곤달비(Ligularia stenocephala)는 50% 차광수준에서 가장 높은 엽록소 수치를 나타내었다(Park and Bae, 2012; Park et al., 2011). 이처럼 식물의 종류에 따라 차광수준에 따른 엽록소 수치의 변화가 서로 다를 수 있음을 알 수 있었다.
Table 4.
Chlorophyll content (SPAD units), CIELAB values, CIE76 color difference (ΔE*ab), RHS values, and converted color of leaves of P. takesimensis cv. Atlantis plants grown under different shading levels for 8 weeks
|
Shading treatment (%) |
Chlorophyll content (SPAD units) | CIELAB values | ΔE*ab (CIE76) | RHS values | Converted colorz | ||
| L* | a* | b* | |||||
| 0 | 43.39 ay | 47.32 b | -5.47 a | 17.56 b | Reference | 147B, 148A |  |
| 35 | 39.68 ab | 47.06 b | -6.94 b | 17.44 b | 1.49 | 147B, 148A |  |
| 45 | 37.93 b | 47.28 b | -7.34 b | 17.92 b | 1.90 | 147B, 148A |  |
| 60 | 32.76 c | 50.01 b | -7.25 b | 19.21 a | 3.62 | 147B, 148B |  |
| 75 | 31.82 c | 54.29 a | -5.34 a | 18.80 ab | 7.08 | 147C, 148B |  |
| 99 | - | - | - | - | - | - | - |
| Significancex | *** | *** | *** | *** | |||
CIELAB는 원예분야에서 여러 방면으로 사용되며, 각각 명도(lightness)와 적색도, 황색도의 색 좌표를 나타내는 L*, a*, b*로 표기한다. CIELAB는 엽채류의 품질 평가(Kim et al., 2022; Lee et al., 2022d), 약용식물의 품질평가(Lee et al., 2022b), 관상용 식물의 품질평가(Cabahug et al., 2019; Cabahug et al., 2020; Cabahug et al., 2017; Shim et al., 2021), 등 원예 연구와 산업 전반에서 이용된다. CIELAB에서 명도 L*은 75% 차광수준에서 54.29로 가장 높게 나타나 다른 처리구에 비해 엽색이 흰색에 가까운 것으로 나타났다. 적색과 녹색의 좌표를 나타내는 a*은 75% 차광수준에서 -5.34로 가장 높게 나타나 다른 처리구에 비해 적색에 조금 더 가까운 경향을 나타내었다. b*는 60% 차광 수준에서 19.21로 가장 높게 나타나 60% 차광수준에서 황색도가 가장 높은 것으로 나타났다. 과거 몇 가지 연구에서 L*과 b*의 증가는 식물의 생장 매개변수와 음의 상관관계를 나타내는 것으로 보고되었는데(Lee et al., 2022a; Lee et al., 2022bLee et al., 2022c), 본 실험 또한 해당 보고와 유사하게 생장수준이 상대적으로 저조하였던 처리구인 60-75% 차광수준에서 L*과 b*가 증가하는 경향을 나타내었다. CIE76 색차 분석에서 무차광수준(0%)과 비교하였을 때 35% 차광수준은 ΔE*ab = 1.49로 ‘미세한 색차 있음’으로 평가되었으며 45% 차광수준은 ΔE*ab = 1.90으로 ‘매우 적은 색차 있음’으로 평가되었다. 한편 60% 차광수준과 75% 차광수준은 각각 ΔE*ab = 3.62, 7.08로 나타나 각각 ‘적은 색차 있음’, ‘색차 있음’으로 평가되었다. 0-45% 차광수준에서 RHS 값은 147B, 148A로 동등하게 평가되었으며, 60% 차광수준과 75% 차광수준에서 각각 147B, 148B 그리고 147C, 148B로 평가되어 45% 이하의 차광수준에 비해 엽색이 황화한 것으로 평가되었다. 이러한 결과에 따라 ‘아틀란티스’의 엽색품질 향상을 위해서는 0-45% 차광수준 내에서 재배할 것을 권고한다.
본 실험에서 조사된 모든 항목의 결과를 종합적으로 판단할 때 섬기린초 ‘아틀란티스’는 0%의 차광수준이나 60% 이상의 높은 차광수준에서는 대체로 생장이 저조해 지는 것으로 나타났다. 그러나 45% 차광수준에서는 우수한 생장 수준을 나타내어 ‘아틀란티스’의 식물체 크기 증대, 잎의 크기 증대와 엽색 품질의 향상을 위해 45%의 차광수준에서 재배할 것을 권고한다.
요 약
섬기린초(Phedimus takesimensis)는 울릉도와 독도에서 자생하는 한반도의 고유종이다. 섬기린초는 약용식물로 활용될 수 있는 가능성이 있으며 국내에서 보호해야할 식물 자원이다. 그러나 섬기린초의 대량재배를 위한 적정 차광수준에 대해서는 알려진 바가 없다. 따라서 본 실험에서는 섬기린초의 무늬품종인 ‘아틀란티스’(P. takesimensis cv. Atlantis)를 실험식물로 공시하였다. 차광수준은 0, 35, 45, 60, 75, 99%으로 나누어 설정하여 적용하였다. 결과적으로 초장과 초폭의 크기 증대는 45% 차광수준에서 가장 높게 나타났으며 근장의 증대는 0-45% 차광수준 범위에서 높게 나타났다. 한편, 엽장과 엽폭은 35-60% 범위의 차광수준에서 높게 나타났다. 지상부 생체중과 건물중은 45% 차광수준에서 가장 높게 나타났으며 지하부 생체중과 건물중은 0-45% 차광수준에서 높게 나타났다. 수분함량은 지상부의 경우 60% 차광수준에서 가장 높게 나타났으며 지하부의 경우 75% 차광수준에서 가장 높게 나타났다. 엽록소 수치에 대한 분석에서 차광수준이 낮아질수록 높게 나타나는 경향을 보였으며 CIELAB에서 명도 L*과 황색도 b*는 차광수준이 높아질수록 높게 나타나는 경향을 보였다. CIE76 색차 분석에서는 75% 차광수준에서 ΔE*ab = 7.08로 가장 높게 나타나 ‘색차 있음’으로 평가되었다. RHS 값의 경우 0-45% 차광수준 범위에서는 147B, 148A로 평가되었으나 60% 차광수준에서는 147B, 148B로 평가되었고 75% 차광수준에서는 147C, 148B로 평가되어 60-75% 차광수준은 상대적으로 엽색이 황화한 것으로 평가되었다. 실험의 결과를 종합적으로 평가할 때, ‘아틀란티스’의 크기를 유의미하게 증대시키고 엽 색상 품질을 유지하기 위해 45% 차광수준에서 재배할 것을 권고한다.