서 론
재료 및 방법
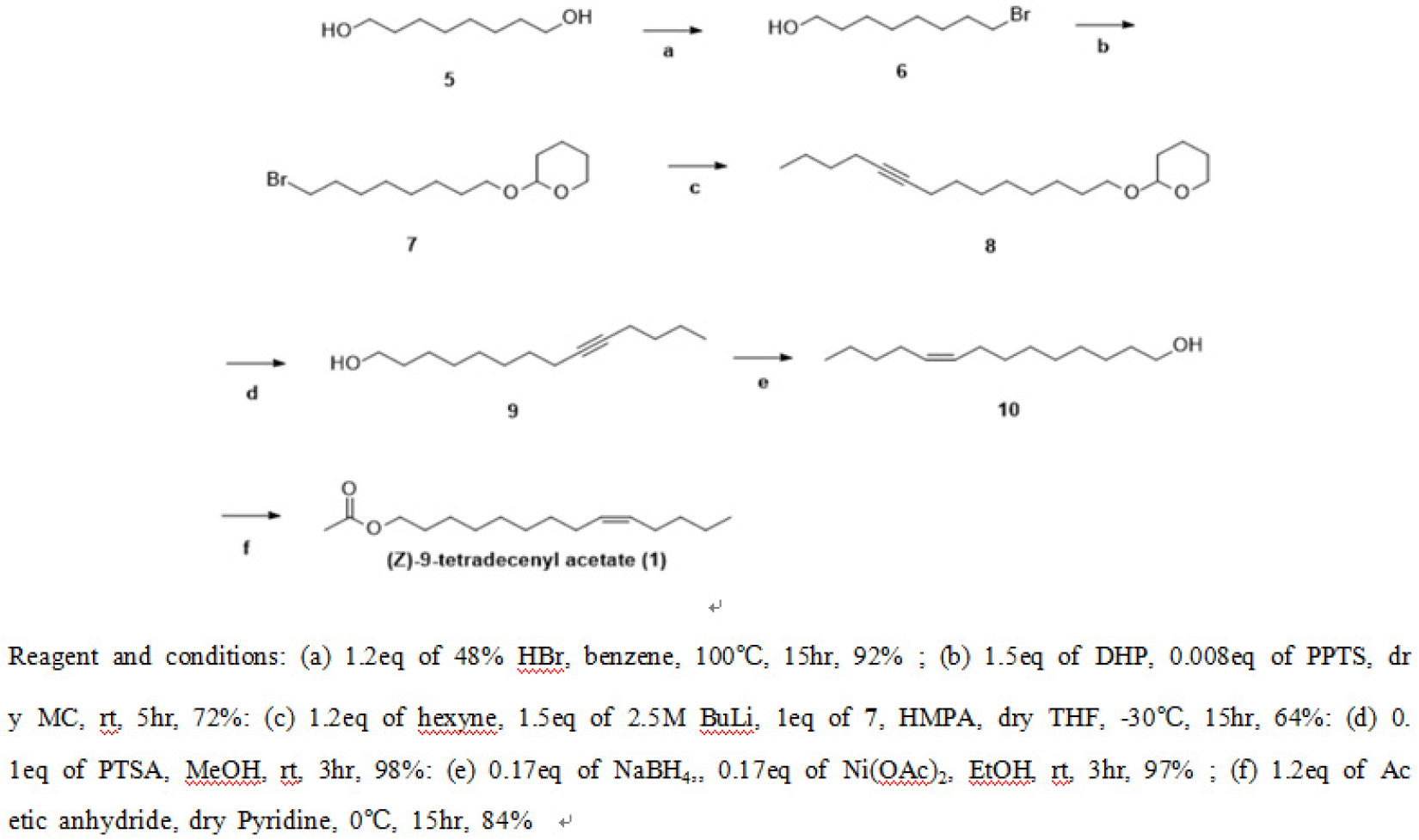
(Z)-9-tetradecenyl acetate(1) 성분의 산업적 합성
8-bromooctanol(6)의 합성
2-((8-bromooctyl)oxy)tetrahydro-2H-pyran(7)의 합성
2-(9-Tetradecynyloxy)tetrahydro-2H-pyran(8)의 합성
9-Tetradecynol(9)의 합성
(Z)-9-Tetradecenol(10)의 합성
(Z)-9-Tetradecenyl acetate(1)의 합성
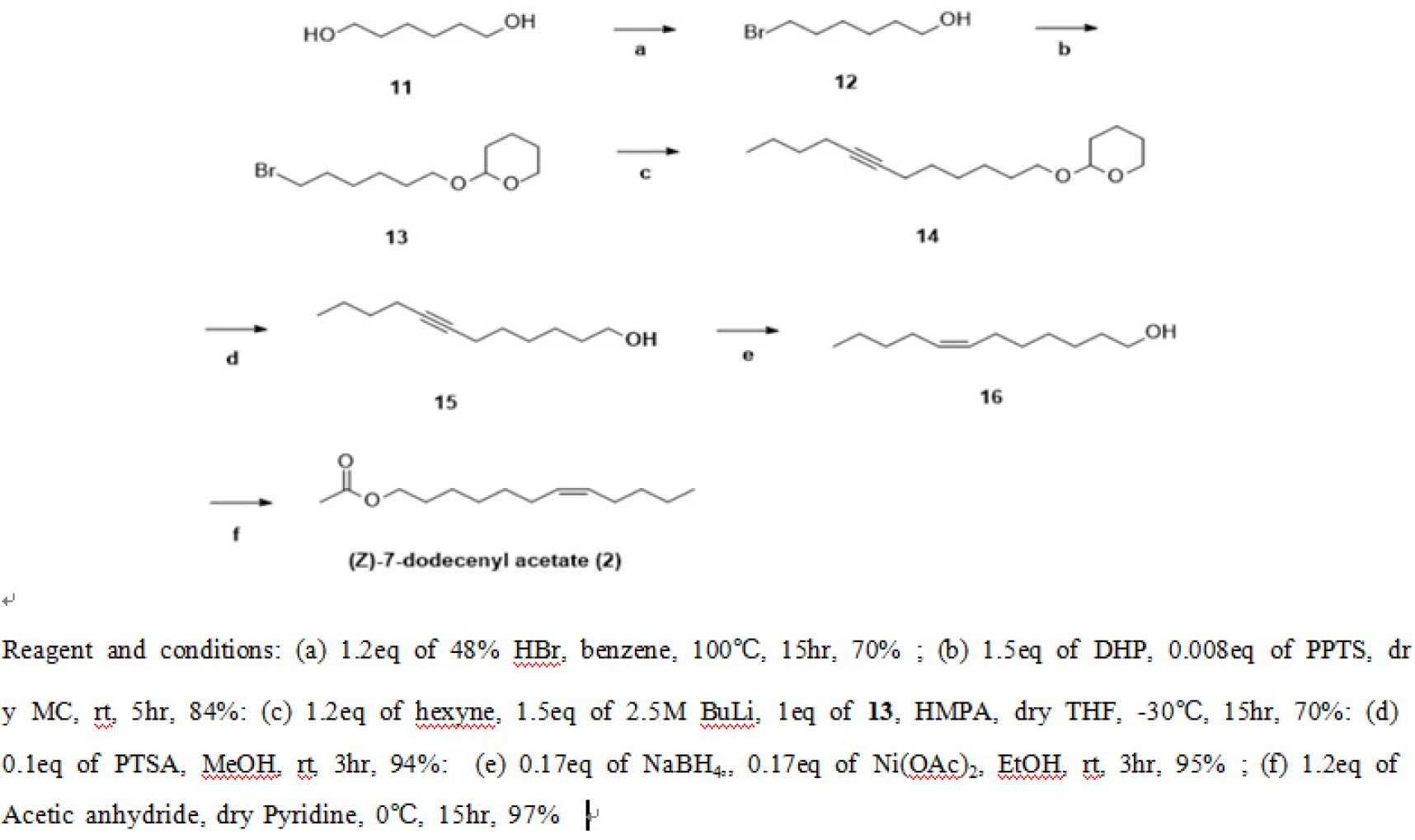
(Z)-7-dodecenyl acetate(2) 성분의 산업적 합성
6-Bromohexanol(12)의 합성
2-((6-Bromohexyl)oxy)tetrhydro-2H-pyran(13)의 합성
2-(Dodec-7-yn-1-ylaxy)tetrahydro-2H-pyran(14)의 합성
7-Dodecynol(15)의 합성
(Z)-7-Dodecenol(16)의 합성
(Z)-7-dodecenyl acetate(2)의 합성
야외 포획시험
결과 및 고찰
페로몬 성분의 산업적 합성 결과
야외 포획시험 결과
결 론
서 론
나비목 밤나방과 열대거세미나방은 아메리카 대륙의 열대 및 아열대 지역이 원산지인 농업해충으로 유충은 다양한 식물을 먹지만, 옥수수, 땅콩, 수수 등을 선호한다(Sparks, 1979). 열대거세미나방은 암컷 1마리당 900-1,000개의 알을 낳는 높은 번식률과 30일의 비교적 짧은 발육기간을 가지고 있으며, 장거리 이동성이 강하고, 성충과 유충 모두 야행성 해충이다(Johnson, 1987; Montezano et al., 2018). 2016년 서아프리카의 나이지라에서 처음 열대거세미나방의 발생이 확인되었고(Goergen et al., 2016) 최근 몇 년 사이에 아프리카 뿐만 아니라 2018년에는 서아시아, 동남아시아 대륙으로 전파된 후, 2019년에는 중국 등 동북아시아로 확산하였다(Li et al., 2019; Nagoshi et al., 2018). 우리나라에서는 2019년 제주에서 처음으로 발견되었고, 그 후 전라도, 경상남도의 여러 시/군에서 추가로 발견되었다(Lee et al., 2020). 열대거세미나방의 중국 발생 동향을 파악한 결과, 중국 남부지역 옥수수 재배지에서 열대거세미나방 발생이 전년보다 15% 증가한 것을 확인했다. 중국 남부지역의 평균기온이 높아 해충 번식과 성장에 유리한 환경이 만들어져 비래해충의 유입 시기가 빠르고 발생이 증가할 것으로 전망이 되며, 우리나라에 옥수수, 벼과 작물에 유충으로 인한 피해 발생이 우려되는 상황이다. 유기합성 기술의 발달로 많은 종류의 행동유기 페로몬들이 인공적으로 합성되어 농작물 및 수목에 피해를 주는 해충들을 방제하기 위해 사용되고 있다(Park, 2022). 곤충의 성페로몬은 종 특이적으로 특정 해충만을 대상으로 작용하고 미량으로 충분하며, 환경오염의 부작용이 없는 장점 등으로 해충의 발생예찰에 널리 이용되어 왔으며 대량포획 등 직접방제에도 이용될 수 있다(Jutusm and Gordon, 1989). 전 세계적으로 농업, 원예, 산림, 저장물 및 생활권 해충의 개체군 모니터링을 위해 페로몬이 사용되고 있으며(Witzgall et al., 2010), 침입해충의 조기 발견에 매우 효과적이다(Brockerhoff et al., 2006).
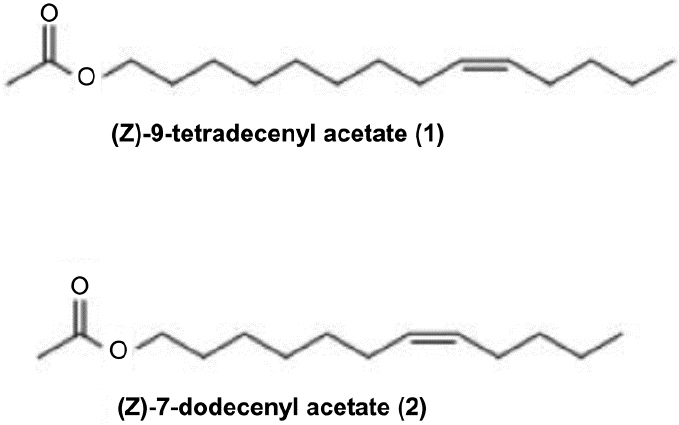
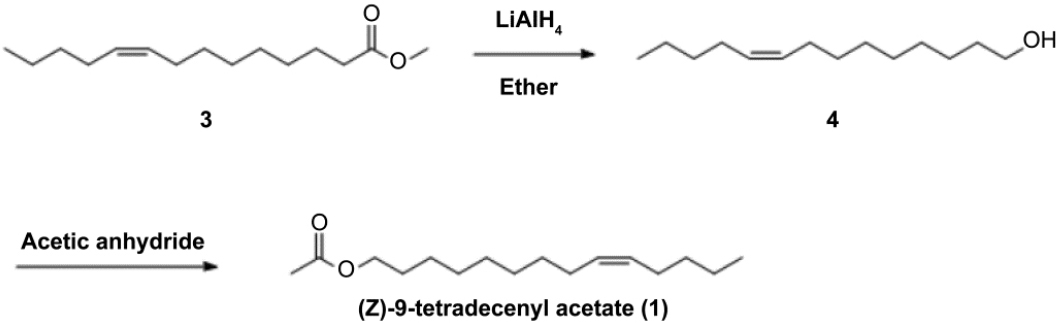
열대거세미나방 성페로몬의 유효성분은 (Z)-9-Tetradecenyl Acetate(1)와 (Z)-7-Dodecenyl Acetate(2)로 확인되었다(Fig. 1)(Andrade et al., 2000). 기존에 공개된 열대거세미나방 성페로몬 합성법은 다음과 같다(Sekul and Sparks, 1967). 먼저 Methyl Myristoleate을 출발물질로 하여 Lithium Aluminm Hydride를 이용하여 (Z)-9- Tetrdecenol을 합성한 후 아세틸화하는 방법은 고가의 출발물질과 환원제인 LAH를 사용하므로 대량합성이 쉽지 않으며, 반응의 재현생이 좋지 않아 산업적 생산이 어렵다. 그 이유는 LAH는 물 반응성 물질이라서, 합성과정 중 물과 접촉하면 수용액은 생성된 수산화 리튬과 반응하여 순식간에 끊는점까지 도달할 수 있다. 또한 수소기체가 생성되어 폭발사고를 야기할 수 있어 반응이 까다로워 재현생이 좋지 않으며, 출발물질의 가격이 비싸기 때문에 대량합성의 단가에 영향을 크게 줄 것으로 예상된다(Fig. 2). 본 연구에서는 출발물질 1,8-Octanediol, 1,6-Hexanediol을 사용하여 생산단가 절감에 기여하였다. 특히 삼중결합을 Z-이중결합으로 변환시킬 때 전형적인 촉매인 비싼 Pt 혹은 Pd 대신 Ni(OAc)2를 사용함으로써 페로몬 생산 단가를 절감할 수 있으리라 판단된다. 합성과정 중 Catalytic Hydrogenation에서의 반응조건 즉, 촉매변화 합성과정을 개선하여 최종 제품의 가격 절감에 기여하고자 도입되었다. 합성한 성페로몬을 이용하기 위해서는 열대거세미나방의 최적의 조성을 알아야 하며 그 조성에 맞게 정확하게 성페로몬 방출제를 제조해야 한다. 최근 일본에서 보고된 결과에 따르면 Z9-14Ac와 Z7-12Ac의 비율이 100:3보다 100:1 비율일 때 열대거세미나방 유인력이 더 높았다고 보고됐다(Wakamura et al., 2021). 이러한 선행 연구 결과를 바탕으로 열대거세미 성페로몬을 주성분 Z9-14Ac와 보조성분 Z7-12Ac을 선정하여 Z9-14Ac와 Z7-12Ac의 비율을 각각 100:1, 30:1, 100:0으로 정하여 야외유인력 실험을 진행하여 유인 효과를 검증하였다.
재료 및 방법
(Z)-9-tetradecenyl acetate(1) 성분의 산업적 합성
시중에서 쉽게 구할 수 있는 1,8-Octanediol(5)을 48% HBr로 Monobromination시켜 합성된 8-Bromooctanol(6)의 Hydroxy기를 Pyridine p-Toluenesulfonate(PPTS) 촉매 하에 3,4-Dihydro-2-H-pyran(DHP)으로 보호하여 화합물 2-((8-bromooctyl)oxy)tetrahydro-2H-pyran(7) 합성하였다. 계속해서 1-Hexyne과 Coupling하여 화합물 2-(9- Tetradecynyloxy)tetrahydro-2H-pyran(8)을 얻은 후 PPTS로 보호기를 제거하여 화합물 9-Tetradecynol(9) 합성한 후 Ni촉매로 환원시켜 (Z)화합물 (Z)-9-Tetradecenol(10)을 얻을 수 있다. 마지막으로 Acetylation시켜 최종 화합물 Z-9-Tetradecenyl acetate(1)을 얻을 수 있다(Fig. 3).
핵자기 공명 스펙트럼은 Avance Digital 500 MHz Spectrometer(Bruker, Ettlingen, Germany)를 이용하였다. 관 크로마토그래피는 Silica gel 60(Merck KGaA, Darmstadt, Germany)을 사용하였다. 시약은 Sigma-Aldrich(Merck KGaA, Darmstadt, Germany)와 Sejin-Ci(Tokyo chemical industry, Tokyo, Japan) 정제 없이 사용하였으며, 용매는 정제하지 않고 사용하거나 증류 정제하여 사용하였다. 합성된 페로몬 성분의 가스 크로마토그래피 분석은 YL 6500 GC(Youngin Chromass, Gyeonggi-do, Korea)와 TG-5Ms(30 m × 0.25 mm I.D., 0.25 µm), (Thermo scientific, United States of America)을 이용하여 오븐 온도 125°C, 흐름 속도 1.0 mL/min, 주입 시료량 1 µL로 분석되었다.
8-bromooctanol(6)의 합성
Dean-Stark Trap을 준비 후 1.8-Octanediol 5(10 g, 0.068 mol)을 장치되어 있는 Flask에 부가, 용매 Benzene(150 mL)을 가하여 50°C에서 약 30 min 교반하여 Diol을 녹인다. Diol이 완전 용해되면 온도를 90-100°C으로 Setting 후 서서히 48% HBr(9.28 mL, 0.082 mol)을 가하여 15 hr 교반하여 반응시킨다. 반응은 TLC(Thin-Layer Chromatography)로 진행정도를 확인한다. 반응이 종료되면 용매 Benzene을 제거하고, Silica Gel Column(hexane/ether : 4/1)로 정제하여 화합물 6(13.23 g, 공정상 회수율 92%)을 얻었다.
1H NMR(CDCl3, 500 MHz) δ 3.64(t, J = 6.8 Hz, 2H), 3.41(t, 2H), 1.90-1.81(m, 2H), 1.57(d, 2H), 1.48-1.41 (m, 2H), 1.41-1,31(m, 6H); 13C NMR(CDCl3, 126 MHz) δ 62.97, 33.92, 32.78, 29.23, 28.73, 28.11, 25.66
2-((8-bromooctyl)oxy)tetrahydro-2H-pyran(7)의 합성
8-bromooctanol 6(13.23 g, 0.063 mol)에 용매 Methylene Chloride(132.3 mL)을 부가하여 Magnetic Spin Bar를 이용하여 0°C에서 교반시킨다. 0°C를 유지한 상태에서 Pyridinium p-toluenesulfonate(0.13 g, 0.05 mmol)을 부가한 후에 3,4-Dihydro-2H-pyran(8.61 g, 0.09 mol)을 가하여 5 hr 교반하여 반응시킨다. 반응은 TLC로 진행정도를 확인한다. 반응이 종료되면 용매 Methylene Chloride를 제거 후 EtoAc / H2O / NaHCO3 / NaCl로 씻어 준 후 Na2SO4로 건조, 용매를 갑암했다. 잔여물을 Silica gel Column(hexane/ether : 9/1)로 정제하여 화합물 7(13.5 g, 공정상 회수율 72%)을 얻었다.
1H NMR(CDCl3, 500 MHz) δ 4.57(d, = 64.5 Hz, 1H), 3.87(d, 1H), 3.73(d, 1H), 3.54-3.46(m, 1H), 3.44-3.34 (m, 3H), 1.90-1.76(m, 3H), 1.76-1.67(m, 1H), 1.64-1.47(m, 6H), 1.43(d, 2H), 1.39-1.28(m, 6H); 13C NMR (CDCl3, 126 MHz) δ 98.89, 67.60, 62.36, 33.90, 32.83, 30.83, 29.73, 29.27, 28.71, 28.13, 26.16, 25.55, 19.73
2-(9-Tetradecynyloxy)tetrahydro-2H-pyran(8)의 합성
용매 THF(47.58 mL)에 녹인 1-Hexyne(7.93 g, 0.055 mol)을 -40°C로 냉각한 후 2.5M n-Butyllithium(27.62 mL, 0.069 mol)을 가하고 30 min 동안 교반하였다. 여기에 HMPA(14.85 mL)에 녹인 2-((8-Bromooctyl)oxy) tetrahydro-2H-pyran 7(13.5 g, 0.046 mol)를 부가한 후 0°C에서 15 hr 교반하여 반응시켰다. 반응은 TLC로 진행정도를 확인한다. 반응이 끝난 후 용매 THF를 제거하고, EtoAc / H2O / H2O / NaCl로 추출한 유기층을 세척하고 감압하여 농축한 잔여물을 Silica Gel Column(hexane/ether : 9/1)으로 정제하여 화합물 8(8.7 g, 공정상 회수율 64%)를 얻었다.
1H NMR(CDCl3, 500 MHz) δ 4.57(d, J = 64.5 Hz, 1H), 3.87(d, 1H), 3.73(d, 1H), 3.54-3.46(m, 1H), 3.38(d, 1H), 2.14(d, 4H), 2.04(s, 1H), 1.83(d, 1H), 1.76-1.67(m, 1H), 1.61-1.30(m, 19H), 0.90(t, 3H); 13C NMR(CDCl3, 126 MHz) δ 98.87, 80.19, 67.68, 62.33, 31.32, 30.84, 29.79, 29.48-28.65, 26.24, 25.57, 21.95, 19.73, 18.78, 18.47, 13.62
9-Tetradecynol(9)의 합성
장치한 Flask에 2-(9-Tetradecynyloxy)tetrahydro-2H-pyran 8(8.7 g, 0.029 mol)를 담아 용매 Methanol(130.5 mL)을 부가 후 교반시키며 Pyridinium p-toluenesulfonate(0.56 g, 0.2 mmol)을 부가하였다. 반응은 TLC로 진행정도를 확인한다. 약 3-4 hr 반응 후 종료 시, NaHCO3(7.83 g, 0.026 mol)를 부가 후 용매 Methanol을 제거하였다. Ether / H2O / NaCl로 추출한 유기층을 세척하고 감압하여 농축한 잔여물을 Silica Gel Column(hexane/ether : 9/1)으로 정제하여 화합물 9(6.1g, 공정상 회수율 98%)를 얻었다.
1H NMR(CDCl3, 500 MHz) δ 3.63(t, J = 6.6 Hz, 2H), 2.18-2.10(m, 4H), 1.56(d, 2H), 1.51-1.45(m, 4H), 1.45-1.41(m, 2H), 1.41-1.35(m, 4H), 1.35-1.30(m, 5H) 0.90(t, J = 7.2 Hz, 3H); 13C NMR(CDCl3, 126 MHz) δ 80.21, 63.04, 32.82, 31.32, 29.72-28.65, 25.74, 21.95, 18.77, 18.47, 13.62
(Z)-9-Tetradecenol(10)의 합성
2-neck flask를 장치하여 (가)-Ni(oAc)2(1.19 g, 0.004 mol)에 용매 EtOH(61 mL)를 부가하여 녹인 후, (나)-NaBH4 (0.18 g, 0.4 mmol)를 용매 EtOH(6.1 mL)로 녹인 용해물을 (가)-Flask에 혼합하여 약 5 min 정도 교반시켰다. (가)와 (나)가 혼합된 2-neck flask에 Ethylenediamine(0.81 mL, 0.012 mol)과 9-Tetradecyn-1-ol 9(6.1 g, 0.028 mol)를 부가한 후, 수소(H2)를 주입하여 반응시켰다. 반응은 TLC로 진행 정도를 확인한다. 약 5 hr 교반하여 반응 종료 후 Celite545를 사용하여 Ether로 여과(Filter)시킨 후 용매를 제거하여 Ether / H2O / NaCl로 추출한 유기층을 세척하고 감압하여 농축한 잔여물을 Silica Gel Column(hexane/ether : 20/1)로 정제하여 화합물 10(6 g, 공정상 회수율 97%)를 얻었다.
1H NMR(CDCl3, 500MHz) δ 5.40-5.31(m, 2H), 3.63(t, 2H), 2.07-1.98(m, 4H), 1.56(d, 2H), 1.37-1.27(m, 14H), 0.93-0.86(m, 3H); 13C NMR(CDCl3, 126 MHz) δ 129.90, 63.07, 32.85, 32.00, 29.85-29.16, 27.21, 26.95, 25.78, 22.37, 14.10
(Z)-9-Tetradecenyl acetate(1)의 합성
(Z)-9-Tetradecen-1-ol 10(6 g, 0.028 mol)이 담긴 Flask를 장치하여 Pyidine(60 mL)을 부가한 후, 0°C에서 Acetic anhydride(3.2 g, 0.033 mol)를 부가하여 약 5 min 교반시킨 후, R.T(15-25°C)에서 15 hr 교반시켜 반응시켰다. 반응은 TLC로 진행정도를 확인한다. 반응이 끝난 후 종료 시 Flask를 냉각장치하여 0°C에서 맑아질 때까지 H2O 부가, 5 min 교반시켰다. Ether / H20 / 5% HCl / NaCl / NaHCO3로 추출한 유기층을 세척하고 감압하여 농축한 잔여물을 Silica Gel Column(hexane/ether : 9/1)로 정제하여 화합물 1(6.1 g, 공정상 회수율 84%)를 얻었다.
1H NMR(CDCl3, 500 MHz) δ 5.41-5.30(m, 2H), 4.05(t, J = 6.8 Hz, 2H), 2.06-1.98(m, 7H), 1.62(m, 2H), 1.38-1.27(m, 14H), 0.93-0.86(m, 3H); 13C NMR(CDCl3, 126 MHz) δ 171.19, 129.89, 64.65, 31.99, 29.74, 29.51-28.98, 28.65, 27.19, 26.94, 25.93, 22.36, 20.99, 13.99
(Z)-7-dodecenyl acetate(2) 성분의 산업적 합성
시중에서 쉽게 구할 수 있는 1,6-Hexanediol(11)을 48% HBr로 Monobromination시켜 합성된 6-Bromohexanol (12)의 Hydroxy기를 Pyridine p-Toluenesulfonate(PPTS) 촉매 하에 3,4-Dihydro-2-H-pyran(DHP)으로 보호하여 화합물 2-((6-Bromohexyl)oxy)tetrhydro-2H-pyran(13) 합성하였다. 계속해서 1-Hexyne과 Coupling하여 화합물 2-(Dodec-7-yn-1-ylaxy)tetrahydro-2H-pyran(14) 얻은 후 PPTS로 보호기를 제거하여 화합물 7-Dodecynol(15) 합성한 후 Ni촉매로 환원시켜 (Z)화합물 (Z)-7-Dodecenol(16)을 얻을 수 있었다. 마지막으로 Acetylation시켜 최종 화합물 Z-7-Dodecenyl Acetate(2)을 얻었다(Fig. 4).
핵자기 공명 스펙트럼은 Avance Digital 500 MHz Spectrometer(Bruker, Ettlingen, Germany)를 이용하였다. 관 크로마토그래피는 Silica gel 60(Merck KGaA, Darmstadt, Germany)을 사용하였다. 시약은 Sigma-Aldrich(Merck KGaA, Darmstadt, Germany)와 Sejin-Ci(Tokyo chemical industry, Tokyo, Japan) 정제 없이 사용하였으며, 용매는 정제하지 않고 사용하거나 증류 정제하여 사용하였다. 합성된 페로몬 성분의 가스 크로마토그래피 분석은 YL 6500 GC(Youngin Chromass, Gyeonggi-do, Korea)와 TG-5Ms(30 m × 0.25 mm I.D., 0.25 µm), (Thermo scientific, United States of America)을 이용하여 오븐 온도 125°C, 흐름 속도 1.0 mL/min, 주입 시료량 1 µL로 분석되었다.
6-Bromohexanol(12)의 합성
Dean-Stark Trap을 준비 후 1,6-Hexanediol 11(10 g, 0.085 mol)을 장치되어 있는 Flask 부가, Benzene(150 mL)을 가하여 50°C에서 약 30 min 교반하여 Diol을 녹인다. Diol이 완전 용해되면 온도를 90-100°C으로 Setting 후 서서히 48% HBr(11.5 mL, 0.102 mol)을 가하여 15 hr 교반하여 반응시킨다. 반응은 TLC로 진행정도를 확인한다. 반응이 종료되면 용매 Benzene을 제거하고, Silica Gel Column(hexane/ether : 4/1)로 정제하여 화합물 12(10.59 g, 공정상 회수율 70%)을 얻었다.
1H NMR(CDCl3, 500 MHz) δ 3.64(t, 2H), 3.42(t, J = 6.8 Hz, 2H), 1.92-1.81(m, 3H), 1.58(d, 2H), 1.52-1.34 (m, 4H); 13C NMR(CDCl3, 126 MHz) δ 62.68, 33.77, 32.60, 27.93, 24.94
2-((6-Bromohexyl)oxy)tetrhydro-2H-pyran(13)의 합성
6-bromohexanol 12(10.59 g, 0.058 mol)에 용매 Methylene Chloride(105.9 mL)을 부가하여 Magnetic Spin Bar를 이용하여 0°C에서 교반시킨다. 0°C를 유지한 상태에서 Pyridinium p-Toluenesulfonate(0.12 g, 0.0004 mol)을 부가한 후에 3,4-Dihydro-2H-pyran(8 g, 0.087 mol)을 가하여 5 hr 교반하여 반응시킨다. 반응은 TLC로 진행 정도를 확인한다. 반응이 종료되면 용매 Methylene Chloride를 제거 후 EtoAc / H2O / NaHCO3 / NaCl 로 씻어 준 후 Na2SO4로 건조, 용매를 갑암했다. 잔여물을 Silica Gel Column(hexane/ether : 9/1)로 정제하여 화합물 13(13.02 g, 공정상 회수율 84%)을 얻었다.
1H NMR(CDCl3, 500 MHz) δ 4.57(d, J = 4.5 Hz, 1H), 3.86(d, 1H), 3.74(d, 1H), 3.50(d, 1H), 3.50, 3.45-3.34 ((m, 3H), 1.92-1.76(m, 3H), 1.76-1.66(m, 1H), 1.65-1.39(m, 10H); 13C NMR(CDCl3, 126MHz) δ 98.91, 67.41, 62.37, 33.79, 32.78, 30.80, 29.58, 28.03, 25.51, 19.71
2-(Dodec-7-yn-1-ylaxy)tetrahydro-2H-pyran(14)의 합성
THF(50.76 mL)에 녹인 1-Hexyne(8.46 g, 0.059 mol)을 -40°C로 냉각한 후 2.5M n-Butyllithium(39.27 mL, 0.074 mol)을 가하고 30 min 교반하였다. 여기에 HMPA(14.32 mL)에 녹인 2-((6-Bromohexyl)oxy)tetrhydro- 2H-pyran 13(13.02 g, 0.049 mol)를 부가한 후 0°C에서 15 hr 교반하였다. 반응은 TLC로 진행 정도를 확인한다. 반응이 끝난 후 용매를 제거하고, EtoAc / H2O / H2O / NaCl 추출한 유기층을 세척하고 농축한 잔여물을 Silica Gel Column(hexane/ether : 9/1)으로 정제하여 화합물 14(9.2 g, 공정상 회수율 70%)를 얻었다.
1H NMR(CDCl3, 500 MHz) δ 4.57(d, 1H), 3.87(d, J = 11.1 Hz, 1H), 3.73(d, 1H), 3.55-3.46(m, 1H), 3.38(d, 1H), 2.18-2.06(m, 4H), 1.92-1.76(m, 1H), 1.76-1.66(m, 16H), 0.90(t, 3H); 13C NMR(CDCl3, 126 MHz) δ 98.88, 80.18, 67.61, 62.33, 31.31, 30.83, 29.71, 29.16, 28.72, 25.70, 21.95, 19.27, 18.74, 18.46, 13.62
7-Dodecynol(15)의 합성
장치되어진 Flask에 2-(Dodec-7-yn-1ylaxy)tetrahydro-2H-pyran 14(3.98 g, 0.014 mol)를 담아 용매 Methanol (60 mL)을 부가 후 교반시키며 Pyridinium p-toluenesulfonate(0.23 g, 0.149 mmol)을 부가하였다. 반응은 TLC로 진행 정도를 확인한다. 약 3-4 hr 교반하여 반응 종료 시, NaHCO3(3.58 g)를 부가 후 용매 Methanol을 제거하였다. Ether / H2O / NaCl로 추출한 유기층을 세척하고 감압하여 농축한 잔여물을 Silica gel column(hexane/ether : 9/1)으로 정제하여 화합물 15(2.57 g, 공정상 회수율 94%)를 얻었다.
1H NMR(CDCl3, 500 MHz) δ 3.64(t, J = 6.6 Hz, 2H), 2.14(t, 4H), 1.58(d, 2H), 1.53-1.32(m, 11H), 0.91(t, J = 7.2 Hz, 3H); 13C NMR(CDCl3, 126 MHz) δ 80.31, 79.99, 62.92, 32.67, 31.26, 29.06, 28.57, 25.27, 21.90, 18.67, 18.41, 13.57
(Z)-7-Dodecenol(16)의 합성
2-neck flask를 장치하여 (가)-Ni(oAc)2(0.45 g, 0.183 mol)에 용매 EtOH(20 mL)를 부가하여 녹인 후, (나)-NaBH4 (0.31 g, 0.006 mol)를 용매 EtOH(2 mL)로 녹인 용해물을 (가)에 혼합하여 약 5 min 교반시켰다. (가)와 (나)가 혼합된 2-neck flask에 Ethylenediamine(0.31 mL, 0.768 mol)과 7-dodecyn-1-ol 15(2 g, 0.183 mol)를 부가 한 후, 수소(H2)를 주입하여 반응시켰다. 반응은 TLC로 진행 정도를 확인한다. 약 5 hr 교반 후 종료하여 Celite545를 사용하여 용매 Ether로 여과(Filter)시킨 후 용매를 제거하여 Ether / H2O / NaCl로 추출한 유기층을 세척하고 감압하여 농축한 잔여물을 Silica Gel Column(hexane/ether : 20/1)로 정제하여 화합물 16(1.89 g, 공정상 회수율 95%)를 얻었다.
1H NMR(CDCl3, 500 MHz) δ 5.40-5.30(m, 2H), 3.64(t, 2H), 2.02(d, 4H), 1.56(t, 2H), 1.42-1.28(m, 11H), 0.94-0.85(m, 3H); 13C NMR(CDCl3, 126 MHz) δ 130.00, 129.69, 63.01, 32.78, 31.95, 29.70, 29.06, 27.11, 26.91, 25.64, 22.32, 13.95
(Z)-7-dodecenyl acetate(2)의 합성
(Z)-7-dodecen-1-ol 16(11 g, 0.06 mol)이 담긴 Flask를 장치하여 Pyidine(110 mL)을 부가한 후, 0°C에서 Acetic anhydride(5.72 g, 0.072 mol)를 부가하여 약 5 min 교반시킨 후, R.T(15-25°C)에서 15 hr 교반시켜 반응시켰다. 반응은 TLC로 진행 정도를 확인한다. 반응이 끝난 후 종료 시 Flask를 냉각 장치하여 0°C에서 맑아질 때까지 H2O 부가, 5 min 교반시켰다. Ether / H20 / 5% HCl / NaCl / NaHCO3로 추출한 유기층을 세척하고 감압하여 농축한 잔여물을 Silica Gel Column(hexane/ether : 9/1)로 정제하여 화합물 2(13.1 g, 공정상회수율 97%)를 얻었다.
1H NMR(CDCl3, 500 MHz) δ 5.41-5.29(m, 2H), 4.05(t, 2H), 2.04(s, 7H), 1.66-1.58(m, 2H), 1.40-1.27(m, 10H), 0.94-0.85(m, 3H); 13C NMR(CDCl3, 126 MHz) δ 171.18, 130.09, 129.63, 64.63, 31.98, 29.62, 28.76, 27.02, 25.86, 22.36, 20.99, 13.98
야외 포획시험
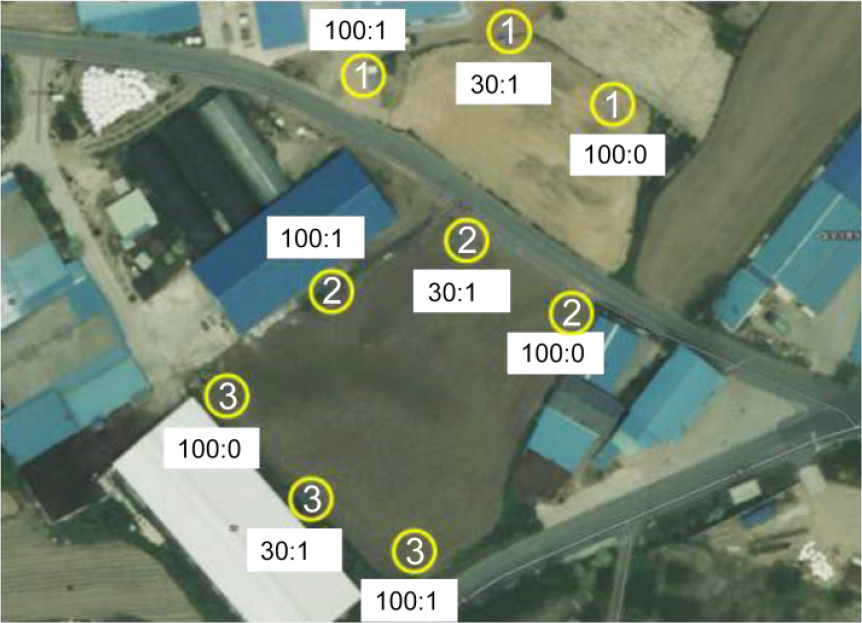
열대거세미나방 페로몬 (Z)-9-Tetradecenyl Acetate(Z9-14Ac)와 (Z)-7-Dodecenyl Acetate(Z7-12Ac)를 배합하여 Hexane에 녹인 후 고무격막(Rubber septum)에 침적시켜 제조하였으며 산화방지제로 2,6-Di-tert-butyl-4- methylphenol를 첨가하였다. 성페로몬 성분은 사용 전에 GC로 95% 이상의 순도를 확인 후 사용하였다. 미끼제조에 사용된 성페로몬의 총 양은 1 mg으로 하였다. 황색트랩(Fig. 5)을 경주시 안강읍 육통리 1068 사료용 옥수수 재배지에 각 처리별 트랩을 3개씩(Fig. 6) 설치하여 유인되는 수컷 성충 수를 조사하였다.
결과 및 고찰
페로몬 성분의 산업적 합성 결과
상업적 낮은 단가로 구입할 수 있는 출발물질 1, 8-Octanediol와 1,6-Hexanediol을 이용하여 Catalytic Hydrogenation 잘 알려진 반응을 이용하여 열대거세미나방 페로몬의 성분 (Z)-9-Tetradecenyl acetate(1), (Z)-7-Dodecenyl acetate(2)을 총 6단계로 수율이 모두 60% 이상이며, 순도 95% 이상인 성분을 제조되었다.
(Z)-9-tetradecenyl acetate(1) 성분은 1개의 이중결합과 탄소 수 16개 C, H, O로 구성되어 있으며 대체로 사슬화합물이며 Acetate로 구성되어 있는 액상의 유기화합물이다. 1개의 카르보닐기가 에테르결합으로 연결되어있는 지방족 화합물로서 총 탄소 16개, 수소 30개, 산소 2개의 원소로 이루어져 분자량이 254.41이며, 1개의 이중결합은 Z배열을 하고 있는 것이 특징이다. 이러한 구조적인 특징을 이용하여 합성된 화합물의 구조를 확인하였다. 이들 화합물의 배열형태를 구체적으로 확인하기 위해 1H NMR 및 13C NMR 분석을 실시하여 말단 CH3 2개, CH2 11개, CH 2개, 카르보닐 1개를 확인하였고, 이중결합의 위치는 1H NMR 5.25-5.45 ppm의 수소 피크를 토대로 이중결합수소를 확인하였다. 커플링 값으로 E Z 배열임을 확인하였으며, 합성되어진 화합물의 순도는 GC를 통해 분석하였으며 순도는 95% 이상이었다. 아래의 스펙트럼 분석결과 수소의 종류와 개수확인 및 수소가 존재하는 주변 환경에 대한 직접적인 정보를 확인결과 (Z)-9-tetradecenyl acetate(1) 성분의 동일한 NMR 데이터임을 확인하였다.
(Z)-7-dodecenyl acetate(2) 성분은 1개의 이중결합과 탄소 수 14개 C, H, O로 구성되어 있으며 대체로 사슬화합물이며 Acetate로 구성되어 있는 액상의 유기화합물이다. 1개의 카르보닐기가 에테르결합으로 연결되어있는 지방족 화합물로서 총 탄소 14개, 수소 26개, 산소 2개의 원소로 이루어져 분자량이 226.36이며, 1개의 이중결합은 Z 배열을 하고 있는 것이 특징이다. 이러한 구조적인 특징을 이용하여 합성된 화합물의 구조를 확인하였다. 이들 화합물의 배열형태를 구체적으로 확인하기 위해 1H NMR 및 13C NMR 분석을 실시하여 말단 CH3 2개, CH2 8개, CH 2개, 카르보닐 1개를 확인하였고, 이중결합의 위치는 1H NMR 5.25-5.45 ppm의 수소 피크를 토대로 이중결합수소를 확인하였다. 커플링 값으로 E Z 배열임을 확인하였으며, 합성되어진 화합물의 순도는 GC를 통해 분석하였으며 순도는 95%이상이었다. 아래의 스펙트럼 분석결과 수소의 종류와 개수확인 및 수소가 존재하는 주변 환경에 대한 직접적인 정보를 확인결과 (Z)-7-dodecenyl acetate(2) 성분임을 확인하였다.
야외 포획시험 결과
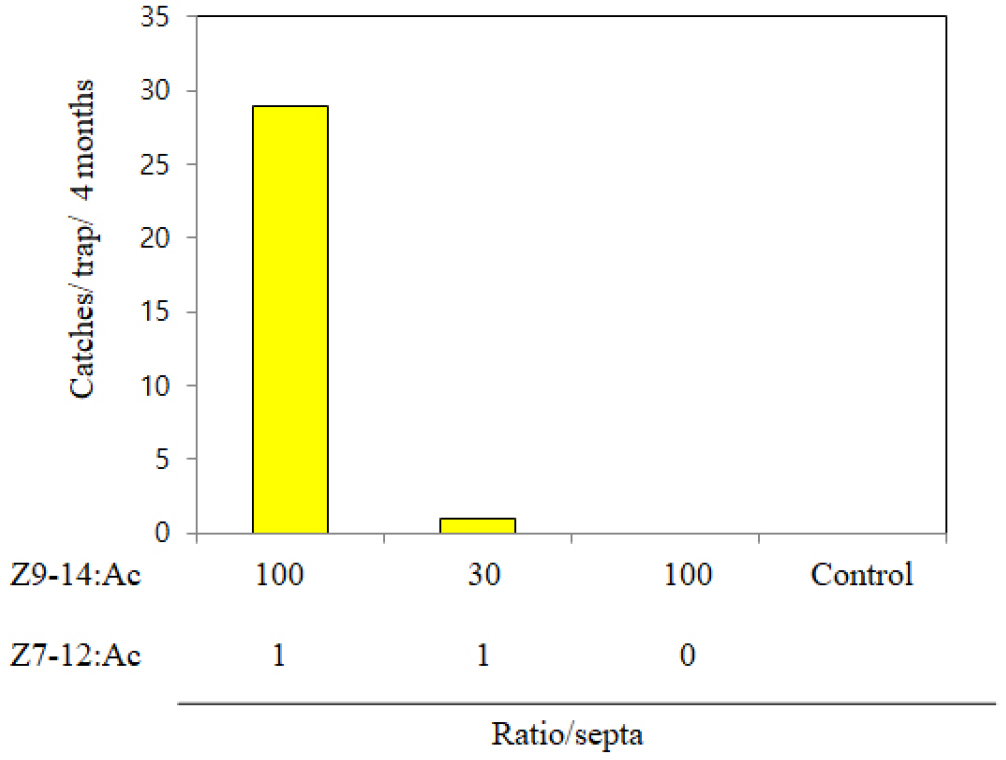
성페로몬 Z9-14Ac와 Z7-12Ac의 다른 세 가지 조성비로 열대거세미나방에 대한 유인력 실험을 진행하였고, 2021년 6월 7일에서 2021년 10월 7일까지 4개월 동안 포획된 개체수를 확인하였다. Z9-14Ac와 Z7-12Ac의 성분비가 100:1일 때 29마리 포획으로 가장 효과가 좋았으며, 30:1, 100:0의 비율에서는 각각 1마리, 0마리 포획되었다(Fig. 7). 이는 일본에서 Z9-14Ac와 Z7-12Ac의 100: 1 비율에서 열대거세미나방 유인력이 가장 뛰어나다는 결과와 동일하였다(Wakamura et al., 2021). 또한 Z7-12Ac가 보조성분이기는 하나, 성분비 100:1과 100:0의 결과를 볼 때, 미미한 함량으로 열대거세미나방 유인력에 큰 영향을 미치는 것을 알 수 있다. 야외 포획실험 결과 Z9-14Ac와 Z7-12Ac의 조성비 100:1에서 가장 효과적인 것을 확인됨에 따라 향후 열대거세미나방 성페로몬 합성 공정을 이용하여 상용화할 경우 열대거세미나방 생물학적 방제제로서 열대거세미나방 확산방지에 크게 기여할 것으로 판단된다.