서 론
재료 및 방법
기내실험 및 포장 시험에 사용된 식물 병원균 및 길항 세균의 배양 및 길항검정
수박 재배 토양의 물리적 및 화학적 특성 분석
노지 및 비닐 온실 내 수박 재배
포장 실증 실험 설계
A. citrulli 균주(140)의 표현형 확인과 PCR 및 Aac immuno strip을 통한 검출
결과 및 고찰
선발 세균의 A. citrulli 균주(140)의 억제 효과 검정
토양의 물리적, 화학적 특성 분석결과
처리구별 암꽃의 수정률
Aac immuno strip을 통한 초기 암꽃의 과실썩음병 검정
Aac immuno strip을 통한 수확된 과실의 과실썩음병 검정
PCR 분석을 통한 종자 내 A. citrulli 검출
요 약
서 론
Acidovorax citrulli (A. citrulli)는 박과류의 과실 및 종자에서 과실썩음병을 유발하는 그람 음성 세균이다(Schaad et al., 1978). A. citrulli에 감염된 작물은 시들음, 과실썩음, 종자 오염 등 다양한 증상을 나타내며, 생산량이 감소하고 품질이 저하된다(Isakeit et al., 1997; Langston Jr et al., 1999; Martin et al., 1999). A. citrulli는 종류에 따라 그룹 1과 그룹2로 나뉘며, 그룹 1은 수박(Citrullus lanatus), 멜론(Cucumis melo) 등 소수의 작물에서 강한 병원성을 나타내고, 그룹 2는 기주 범위는 넓고 병원성은 비교적 낮은 양상을 나타낸다(Walcott et al., 2004).
A. citrulli는 종자 내에서 잠복하며 발아 시 식물체에 가해하는 종자 매개 병원균이다(Rane and Latin, 1992). 이로 인해 미국, 중국, 한국을 포함한 여러 국가에서 경제적 손실을 초래하며(Jin et al., 2014; Somodi et al., 1991), 이에 따라 환경적 요인 또는 종자 매개 전염에 대한 농업인과 종자 기업 사이의 분쟁이 발생하였다(Burdman and Walcott, 2012). 결과적으로 A. citrulli에 의한 이병 종자 발생 억제에 대한 연구 및 현장 실험의 필요성이 증가하고 있다.
과실썩음병에 대한 유전적 저항성 품종은 보고되었지만, 실제로 종자 시장에서는 판매되지 않고 있고, 비용 및 품질의 문제로 농가에서 사용 가능한 것은 제한적이다(Carvalho et al., 2013; Hopkins and Thompson, 2002). 이로 인해 세균, 곰팡이, 박테리오파지 등 다양한 생물학적 방제 방법에 대한 연구가 진행되고 있으며, 그중 다양한 길항 미생물이 토양, 근권 및 식물체 내에서 분리되어 in vitro 실험에서 효과를 입증하였다(Adhikari et al., 2017; Cai et al., 2009; Gao et al., 2017; Rahimi-Midani et al., 2020).
A. citrulli가 수박을 감염시키는 경로 및 메커니즘에 대해서는 많은 연구가 있다(Dutta et al., 2015; Lessl et al., 2007). 하지만 과실 및 종자 생성 과정에서 과실썩음병을 억제하는 길항 미생물의 메커니즘에 대한 연구는 부족하다. 특히 실제 농업 환경에서 길항 미생물이 유묘수준에서 적용한 사례는 존재하지만(Adhikari et al., 2017), 과실 또는 종자 내에서 과실썩음병을 방제하는 연구는 거의 없다. 이로 인해 과실썩음병의 생물학적 방제에 있어 in vitro 실험과 실증 실험 간에 큰 격차가 있다.
이와 같은 생물학적 방제법을 실제 농업 현장에서 적용하기 위해서는 비슷한 환경의 포장 실증 시험이 필수적이다. 포장 실증 시험은 효과적인 생물학적 방제 방법의 개발과 구현에 필수적인 역할을 한다. 농업 환경과 유사한 조건에서 길항 미생물과 A. citrulli를 처리하고 접종하여 그 상호 작용을 관찰할 수 있다. 이러한 실험은 효과적인 생물학적 방제 방법의 기반이 된다.
본 연구에서는 소규모 실증 실험을 통해 실제 적용 가능성을 강조한다. 온실 내 통제된 조건과는 다르게, 농업 환경과 유사한 조건에서 길항 미생물의 A. citrulli 방제 효과를 조사하였고, 표현형 및 PCR, Aac immuno strip을 활용한 길항 미생물의 병원균 방제 효과에 대한 기초 데이터를 수집하였다. 이러한 연구는 과실과 종자에서 A. citrulli 감염 여부를 확인하는 것뿐만 아니라, 병원균이 작물에 미치는 영향을 줄이는데 도움을 주는 길항 미생물의 효과에 대한 정보를 제공한다.
재료 및 방법
기내실험 및 포장 시험에 사용된 식물 병원균 및 길항 세균의 배양 및 길항검정
A. citrulli(140)는 THE KIBAN(Anseong, Korea)에서 제공받았고. 이전 연구(Kim et al., 2022)에서 길항 효과가 확인된 Bacillus velezensis(TIPL-6-1B, TIPL-8-1B)를 실험에 사용하였다. 병원균 및 2개의 길항 세균의 활성을 높이기 위해 각 glycerol stock을 Tryptic Soy Agar(TSA)에 streaking하여 30°C에서 24시간 배양하였고, 형성된 colony를 Tryptic Soy Broth(TSB)에 접종하여 진탕배양기에 동일한 조건으로 배양하였다.
배양된A. citrulli(140)는 TSA에 배양액을 100 µl를 도말 후 paperdisk를 배지 정중앙에 치상하여 두 개의 길항균주(TIPL-6-1B, TIPL-8-1B) 및 혼합균주(1:1/v:v)를 각각 25µl 접종하여 28°C 에서 72시간 배양하였다. 이후 paper disk 주변의 clear zone 지름의 직경(cm)을 확인하여 길항효과를 검정하였다.
포장 시험을 위해 병원균 및 각 길항균은 TSB 30 ml에 seed culture 후, TSB 3L에 배양된 균주 3ml를 각각 접종하여 배양용량을 확대하였다, 각 균주는 진탕배양기에 48시간, 30°C에서 배양하였다. 배양액은 5,000 rpm으로 10분간 원심분리하였고, 상층액 제거 후 식염수(0.85%, NaCl)로 현탁하였다. 현탁액은 hemocytometer를 사용하여 농도를 측정 후, A. citrulli(140)는 1.0 × 102, 1.0 × 103, 1.0 × 104, 1.0 × 105 CFU/ml으로 희석하였고, B. velezensis(TIPL-6-1B, TIPL-8-1B)는 1.0 × 107 CFU/ml로 희석하였다. 혼합균주는 현탁 및 희석한 TIPL-6-1B와 TIPL-8-1B 균주를 1:1(v/v)로 혼합하여 준비하였다.
수박 재배 토양의 물리적 및 화학적 특성 분석
수박을 재배하는 적합한 환경인지 확인하기 위하여 노지(OF)와 온실(GH)에서 토양 시료를 채취 및 분석하였다. 토양 시료는 노지 내의 2개 지점(OF1, OF2)과 온실 내의 2개 지점(GH1, GH2)의 10cm 깊이에서 100 g 채취하였다. 토양 분석은 Agricultural soil and land research institute(ASLRI, Chuncheon, Korea)에 의뢰를 맡겨 수행하였다. 분석에는 pH, 전기 전도도(EC), 토양 질감, 총 질소(T-N), 유기물(OM), 양이온 교환 용량(CEC) 및 중금속(As, Cd, Cu, Ni, Pb, Zn)의 7가지 항목을 분석하였다.
노지 및 비닐 온실 내 수박 재배
수박(Citrullus vulgaris)의 두 품종(호피, 흑피)의 종자는 THE KIBAN(Anseong, Korea)에서 제공받아 본 연구에 활용하였다. 각 품종의 종자는 50구 플라스틱 트레이에 파종되어 4주 동안 유리온실내에서 재배하였으며, 이후 노지와 온실에 호피 및 흑피 40주를 이식하였다. 각 개체의 재식거리는 40 cm이나, A. citrulli(140) 처리구와 대조군 및 양성 대조군 사이의 거리는 3.0 m 간격으로 이식하였다. 이식 후 30일 뒤 수술의 꽃가루를 암술머리에 인공수분하였고, 그 직후 병원균과 길항균은 현탁액을 붓으로 적신 후 암술머리에 접종 및 처리하였다. 과실은 세균 처리 후 60일 뒤에 수확하였다.
포장 실증 실험 설계
수박 재배장소는 2곳(노지, 비닐온실), 품종은 2종(호피, 흑피), 총 처리구의 수는 14개로, 무처리구인 control, 길항균 단독 처리구인 postive control(TIPL-6-1B, TIPL-8-1B, 혼합균주), 병원균의 농도 별 단독 처리구인 negative control(1.0 × 102 CFU/ml, 1.0 × 103 CFU/ml, 1.0 × 104 CFU/ml, 1.0 × 105 CFU/ml), 병원균 선 처리구인 pre-inoculation(TIPL-6-1B, TIPL-8-1B, 혼합균주) 그리고 병원균 후 처리구인 post-inocualtion(TIPL-6-1B, TIPL-8-1B, 혼합균주)이다. pre-inoculation과 post-inoculation의 A. citrulli 접종 농도는 1.0 × 105 CFU/ml이고, 길항균의 처리 농도는 1.0 × 107 CFU/ml이다.
A. citrulli 균주(140)의 표현형 확인과 PCR 및 Aac immuno strip을 통한 검출
수확한 수박 과실을 과육과 종자로 나누었다. 그 후 제조업체의 지침에 따라 Aac immuno strip(Agdia Inc, USA)를 사용하여 과육 내 A. citrulli의 존재 여부를 확인하였다.
채종된 종자는 흐르는 물에 세척 후 클린벤치에서 24시간 동안 건조하였다. 건조한 종자는 70% 에탄올과, 1% 차아염소산수(HOCl)로 표면 살균하였다. 이후 종자를 분쇄하고 FastDNA kit(MP Biomedicals, USA)를 사용하여 각 세균의 gDNA를 추출하였다. 추출한 DNA는 A. citrulli의 존재 여부를 확인하기 위해 PCR을 사용하여 분석하였다. 사용한 primer AC158F과 AC158R의 amplicon size는 158 bp이며 AC158F의 염기서열은 CTTGGTGCTCCATGCTCGA(5’-3’)이고, AC158R의 염기서열은GGCTTGGTTGCGAA TTCACT(5’-3’)이다(Cho et al., 2015). PCR 조성은 멸균수 39.25 µl, 10x buffer 5 µl, dNTP 4 µl, primer mixture 1 µl, DNA 0.5 µl, Ex taq 0.25 µl으로 total 50 µl이다. PCR조건은 94°C(4분) 1 cycle, 94°C(1분), 56°C(1분), 72°C(1분) 30 cycle, 그리고 72°C(10분)에서 최종 extension하였다. PCR산물은 겔 전기영동을 통해 확인하였다.
결과 및 고찰
선발 세균의 A. citrulli 균주(140)의 억제 효과 검정
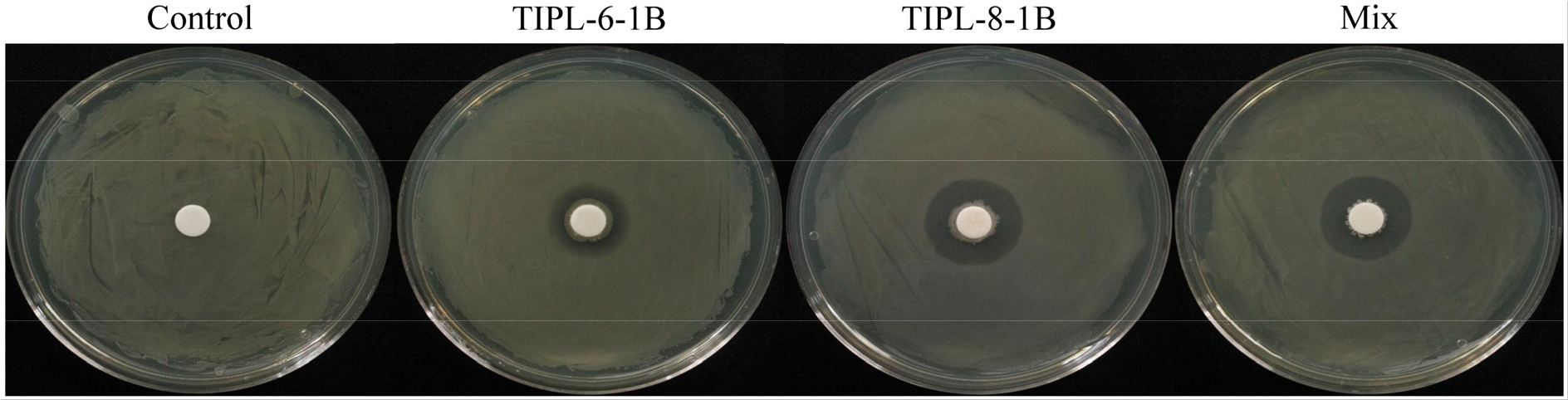
선발된 균주인 TIPL-6-1B, TIPL-8-1B, 그리고 이들 혼합 균주는 모두 A. citrulli(140)에 대한 억제 효과를 나타내었으며, clear zone을 형성하였다(Fig. 1). 각 처리구에서 형성된 clear zone의 크기는 TIPL-6-1B에서 평균 1.71 ± 0.05 cm, TIPL-8-1B에서 1.88 ± 0.03 cm, 혼합 균주에서는 1.87 ± 0.04 cm로 측정되었다. 특히 TIPL-8-1B는 가장 넓은 clear zone을 형성하며 단독 균주 중에서 가장 강력한 억제 효과를 보였다. 혼합 처리의 억제 효과는 단일 처리와 유사한 수준이었으며, 이로 인해 혼합처리가 단일 균주의 억제 효과를 크게 상회하지는 않음을 확인할 수 있었다. Bacillus 속 균주들이 기내실험에서 A. citrulli를 억제하는 효과는 이전 연구에서도 보고된 바 있으며(Fan et al., 2017; Jiang et al., 2015), 본 연구에서도 Bacillus velezensis 균주의 억제 효과가 확인되었다.
토양의 물리적, 화학적 특성 분석결과
수박 재배지 토양의 물리적, 화학적 특성을 분석한 결과이다(Table 1). pH, EC, T-N은 재배 적정 수치이며, 토양 질감의 경우 수박 재배 가능 토양 범위의 질감임을 확인하였다. 중금속의 경우 대한민국 토양환경보전법상 기준치보다 낮게 검출되었다.
Table 1.
Soil characteristics of each site
| Sample | pH |
EC (dS/m) | Texture |
T-N (g/kg) |
OM (%) | CEC | Heavy metals | |||||
| As | Cd | Cu | Ni | Pb | Zn | |||||||
| OF1)1 | 7.1 | 1.5 | Loamy Sand | 1.05 | 1.84 | 12.94 | 1.4 | 0.2 | 8.8 | 2.7 | 12.6 | 91.8 |
| OF2 | 7.5 | 0.9 | Sand | 1.27 | 1.96 | 5.06 | 1.9 | 0.2 | 8.1 | 2.6 | 12.7 | 91.5 |
| GH2)1 | 7.9 | 0.4 | Sandy Loam | 0.39 | 0.51 | 7.43 | 2.4 | 0.3 | 9.9 | 4.3 | 23.2 | 118.4 |
| GH2 | 7.1 | 0.2 | Sandy Loam | 0.34 | 0 | 11.18 | 2.3 | 0.2 | 7.1 | 4.1 | 18.7 | 97.5 |
처리구별 암꽃의 수정률
암꽃 수정률은 재배 장소, 품종, 처리구, 그리고 접종 순서에 따라 차이를 보였다. 먼저, 재배 장소별 결과를 살펴보면, 노지에서 재배된 호피 품종은 23.6%, 흑피 품종은 13.4%의 수정률을 기록했다. 반면, 비닐온실에서는 호피 품종이 27.8%, 흑피 품종이 28.8%로, 온실 재배에서 전반적으로 더 높은 수정률이 확인되었다.
품종에 따른 차이도 명확히 드러났다. 호피 품종의 총 수정률은 25.3%, 흑피 품종은 20.3%로, 노지와 온실 모두에서 호피 품종이 흑피 품종보다 더 높은 수정률이 나타났다. 특히 노지에서는 흑피 품종보다 높은 수정률을 나타났고, 온실에서는 두 품종 간 수정률 차이는 비슷한 수준이었다.
처리구에 따른 수정률 차이도 분명했다. A. citrulli의 농도가 높은 negative control 1.0 × 104 CFU/ml과 1.0 × 105 CFU/ml에서는 각각 11.1%와 8.3%의 낮은 수정률이 나타났다. 반면, post-inoculation (TIPL-8-1B) 처리구에서는 33.3%로 가장 높은 수정률이 관찰되었다.
접종 순서에 따른 수정률에서도 차이가 있었다. Pre-inoculation(TIPL-8-1B) 처리구는 19.4%의 수정률을 기록하였으며, 이는 post-inoculation(TIPL-8-1B) 처리구보다 낮은 결과였다. 다른 균주에서도 유사한 경향이 나타났다. 각 처리구의 수정률은 Table 2, Fig 2A, Fig 2B에 요약되어 있다.
Table 2.
Number of fertilized flowers compared to the number of pollinated flowers on plants treated with B. velezensis before or after the artificial inoculation of A. citrulli
| (FFF1) / PFF2)) | Control |
Negative control (CFU/ml) | Positive control | Pre-inoculation | Post-inoculation | ||||||||||||
| 102 | 103 | 104 | 105 |
TIPL- 6-1B |
TIPL- 8-1B |
Mixture of strains |
TIPL- 6-1B |
TIPL- 8-1B |
Mixture of strains |
TIPL- 6-1B |
TIPL- 8-1B |
Mixture of strains | |||||
| OF3)-Leopard skin | 3/9 | 1/9 | 3/9 | 2/9 | 1/9 | 3/9 | 1/9 | 5/9 | 2/9 | 2/9 | 2/9 | 3/9 | 1/9 | 3/9 | |||
| OF-Black skin | 3/9 | 3/9 | 1/9 | 0/9 | 0/9 | 1/9 | 2/9 | 0/9 | 2/9 | 0/9 | 1/9 | 1/9 | 2/9 | 1/9 | |||
| GH4)-Leopard skin | 3/9 | 2/9 | 3/9 | 1/9 | 1/9 | 2/9 | 3/9 | 3/9 | 3/9 | 1/9 | 4/9 | 3/9 | 3/9 | 3/9 | |||
| GH-Black skin | 3/9 | 1/9 | 1/9 | 1/9 | 1/9 | 3/9 | 3/9 | 4/9 | 0/9 | 4/9 | 2/9 | 4/9 | 6/9 | 3/9 | |||
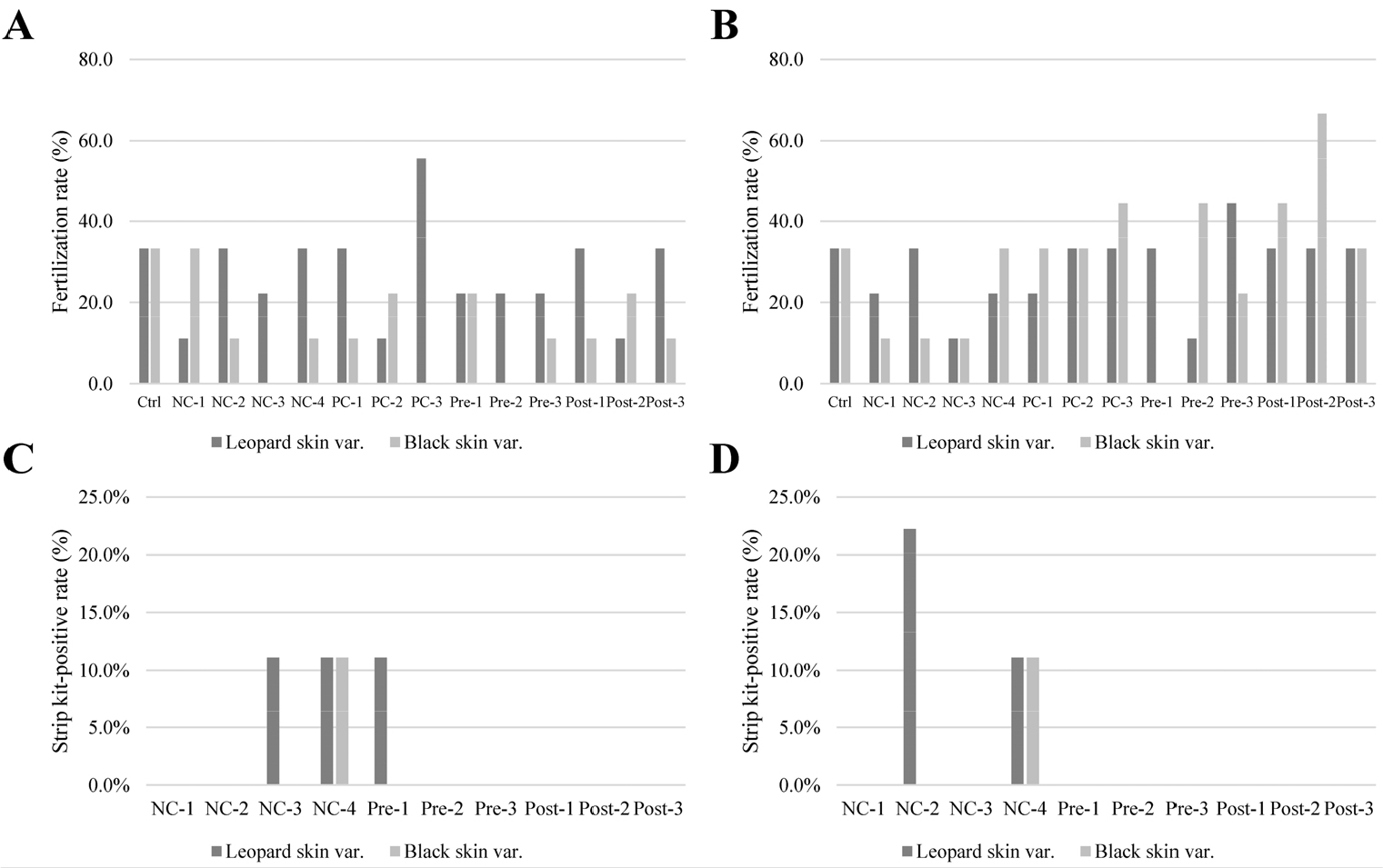
Fig. 2.
Fertilization rate and Immunostrip kit-positivity rate. Fertilization rate in (A) open field and (B) greenhouse experiments. Immunostrip kit-positivity rate in (C) open field and (D) greenhouse experiments. (Ctrl: Control, NC-1: Negative Control 1.0 x 102 (CFU/ml), NC-2: Negative Control 1.0 x 103 (CFU/ml), NC-3: Negative Control 1.0 x 104 (CFU/ml), NC-4: Negative Control 1.0 x 105 (CFU/ml), PC-1: Positive Control TIPL-6-1B, PC-2: Positive Control TIPL-8-1B, PC-3: Positive Control mix, Pre-1: Pre-inoculation TIPL-6-1B, Pre-2: Pre-inoculation TIPL-8-1B, Pre-3: Pre-inoculation mix, Post-1: Post-inoculation TIPL-6-1B, Post-2: Post-inoculation TIPL-8-1B, Post-3: Post-inoculation mix).
Note: Strip kit positive rate (%) = {(The number of strip-positive results from infected stigma) + (The number of strip-positive results from infected fruit flesh)} / The number of stigma attempted for artificial fertilization).Immunostrip-positive results were not observed in the control and positive control groups.
Aac immuno strip을 통한 초기 암꽃의 과실썩음병 검정
인공수분 후 7일 이내에, 썩음 증상으로 인해 수정되지 않은 암꽃은 총 4개체가 확인되었다(Fig. 2C, Fig. 2D, Fig. 3). 노지에서 재배된 호피 품종에서는 negative control(1.0 × 105 CFU/ml) 처리구에서 1개의 개체에서 썩음 증상이 발생하였으며, 비닐온실에서 재배된 호피 품종의 경우 같은 농도에서 2개의 개체에서 썩음 증상이 관찰되었다. 또한, 비닐온실에서 재배된 흑피 품종에서도 negative control(1.0 × 105 CFU/ml)에서 1개의 개체에서 썩음 증상이 나타났다. 반면, 길항균 처리구에서는 썩음 증상이 확인되지 않았다.

Fig. 3.
Phenotype of Acidovorax citrulli infected stigma (upper part), and the Aac immunostrip analysis results (lower part). (A) Leopard skin variety in the open field plants treated with negative control (1.0 x 105 CFU/ml). (B)-(C) Leopard skin variety in the greenhouse plants treated with negative control (1.0 x 105 CFU/ml). (D) Black skin variety in the greenhouse plants treated with negative control (1.0 x 105 CFU/ml). (E) Leopard skin variety in the open field plants treated with negative control (1.0 x 105 CFU/ml) that tested positive using the Aac immunostrip kit. (F)-(G) Leopard skin variety in the greenhouse plants treated with negative control (1.0 x 105 CFU/ml) that tested positive using the Aac immunostrip kit. (H) Black skin variety in the greenhouse plants treated with negative control (1.0 x 105 CFU/ml) that tested positive using the Aac immunostrip kit..
1.0 × 105 CFU/ml의 높은 농도로 처리된 negative control 처리구에서만 A. citrulli의 접종에 의해 암꽃의 수정이 방해되었으며, 이는 수박 생식 생장의 초기 단계에서 높은 농도의 A. citrulli가 수정 과정에 부정적인 영향을 미친다는 것을 시사한다. 이러한 결과는 이전 연구(Dutta et al., 2015)에서도 보고된 바와 같이, A. citrulli가 암술을 통해 stylar canal에 인접한 조직에 군집화하는 것으로 판단된다.
그러나 같은 농도의 A. citrulli(140)를 접종한 경우에도 길항균 처리구에서는 암꽃의 감염이 억제되었다. 이는 노지 및 비닐온실에서 Bacillus velezensis 균주(TIPL-6-1B, TIPL-8-1B)가 암꽃에서 A. citrulli(140)에 의해 발생하는 썩음 증상을 효과적으로 억제하고, 수박 생식 생장의 초기 단계에서 과실썩음병을 방제할 수 있음을 보여준다. 이러한 결과는 선발된 길항 균주들이 A. citrulli(140)가 암술 내 stylar canal에 인접한 조직으로 이동하여 군집화하는 과정을 억제하는 것으로 해석된다(Dutta et al., 2015). 따라서, B. velezensis 두 균주(TIPL-6-1B, TIPL-8-1B)는 수박의 생식 생장기 동안 과실썩음병 방제를 위한 생물학적 방제제로서의 잠재력을 확인하였다.
Aac immuno strip을 통한 수확된 과실의 과실썩음병 검정
수확된 과실 중 총 8개체에서 강한 과실썩음병 증상을 확인하였다(Fig. 2C, Fig 2D, Fig. 4). 노지에서 재배된 호피품종의 경우 negative control(1.0 × 104 CFU/ml) 1개가 과실썩음병 증상이 나타났고, 흑피품종의 경우 negative control(1.0 × 105 CFU/ml) 1 개, post-inoculation(TIPL-6-1B) 1 개에서 과실썩음병 증상이 나타났다. 비닐온실에서 재배된 호피품종의 경우 negative control(1.0 × 103 CFU/ml)에서 2 개가 과실썩음병 증상이 나타났고, 흑피품종의 경우 negative control(1.0 × 102 CFU/ml)에서 1개가 과실썩음병 증상이 나타났다. 병징이 발현된 모든 과실의 과육은 Aac immuno strip을 통해 A. citrulli 감염 여부를 확인하였고, 모두 양성이 나왔다(Fig. 4). 수확된 과실에서도 하나의 처리구를 제외하고 모두 negative control에서 과실썩음병 양성이 나왔으며, 1.0 × 102 CFU/ml, 1.0 × 103 CFU/ml 같은 낮은 농도의 A. citrulli(140)의 접종으로도 과실썩음병 증상의 발현을 확인하였다. 강한 과실썩음병 증상을 보인 처리구 대부분은 negative control이며, 길항균 처리구의 과실은 일부를 제외하고 병징이 보이지 않았다. 이는 선발 길항균이 A. citrulli(140)를 억제하여 과실썩음병 증상 과실 수를 감소시킨 것으로 판단된다.
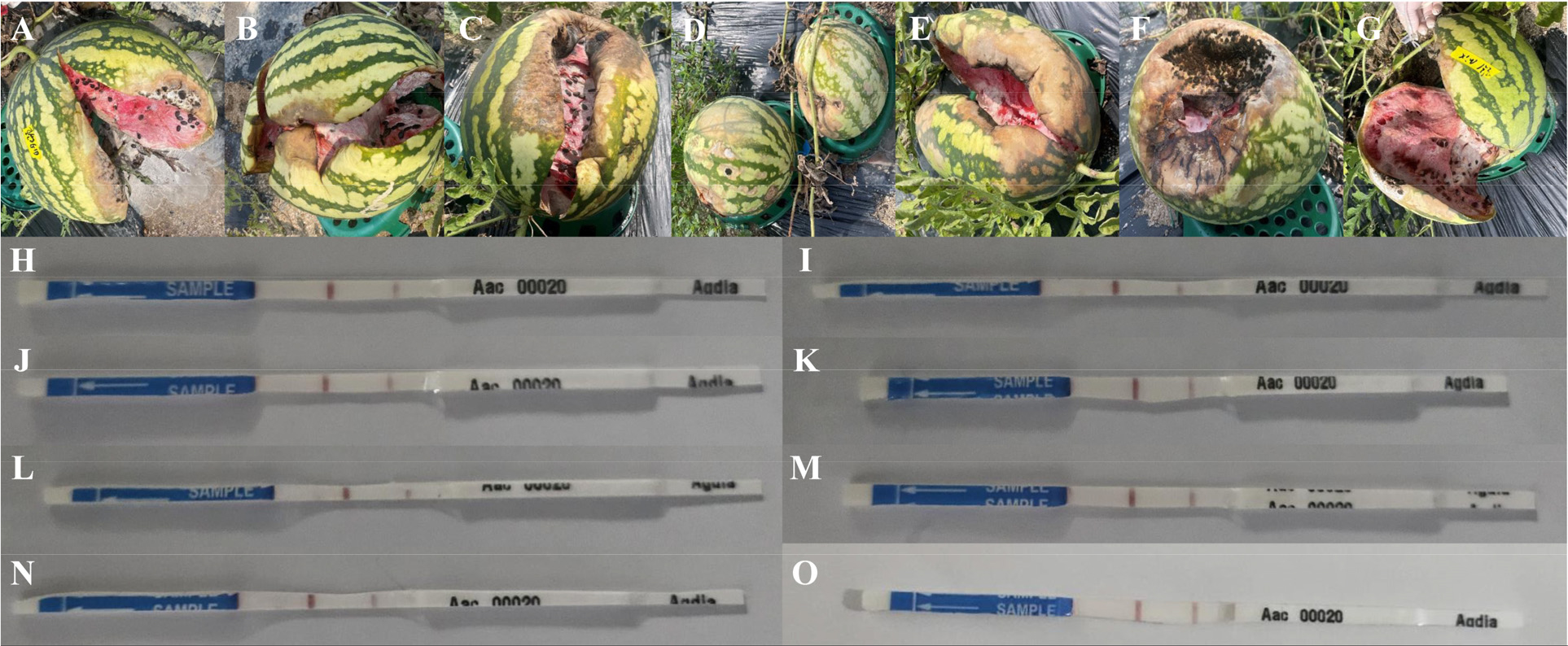
Fig. 4.
Watermelon fruits with bacterial fruit blotch (BFB) symptoms in plants grown in (A)-(C) open field and (D)-(G) green house conditions. (A), (H) Black skin variety exposed to BFB prior to treatment with TIPL-6-1B; (B), (I) Black skin variety exposed to negative control of BFB (1.0 x 105 CFU/ml); (C), (J) Leopard skin variety exposed to negative control of BFB (1.0 x 104 CFU/ml); (D),(K),(L) Two fruits of the leopard skin variety exposed to negative control of BFB (1.0 x 103 CFU/ml); (E),(M) Leopard skin variety exposed to negative control of BFB (1.0 x 105 CFU/ml); (F),(N) Black skin variety exposed to negative control of BFB (1.0 x 105 CFU/ml); (G),(O) Black skin variety exposed post-treatment with mixture.
PCR 분석을 통한 종자 내 A. citrulli 검출
Negative control 처리구에서는 A. citrulli의 농도에 따라 이병 종자율이 달라졌다. 1.0 × 102 CFU/ml 처리구에서는 57.1%로 가장 낮은 이병 종자율을 보였으며, 1.0 × 104 CFU/ml 및 1.0 × 105 CFU/ml에서는 100%의 이병 종자율이 확인되었다. Negative control 처리구 전체의 총 이병 종자율은 81.8%로 나타났다.
A. citrulli(140)를 선 접종한 후 길항균을 처리한 pre-inoculation 처리구에서는 TIPL-6-1B에서 57.1%, TIPL-8-1B에서 14.2%, 혼합균주에서는 44.4%의 이병 종자율을 기록하였으며, pre-inoculation 처리구 전체의 총 이병 종자율은 39.1%로 확인되었다. 모든 처리구에서 negative control보다 낮은 이병 종자율이 나타났다.
후접종 처리(post-inoculation)에서는 TIPL-6-1B에서 66.6%, TIPL-8-1B에서 37.5%, 혼합균주에서는 60%의 이병 종자율을 보였으며, 전체 post-inoculation 처리구의 총 이병 종자율은 52.6%로 나타났다. 이 처리구에서도 negative control보다 낮은 이병 종자율이 관찰되었다. 각 처리구 별 이병 종자율은 Fig. 5에 요약되어있다.
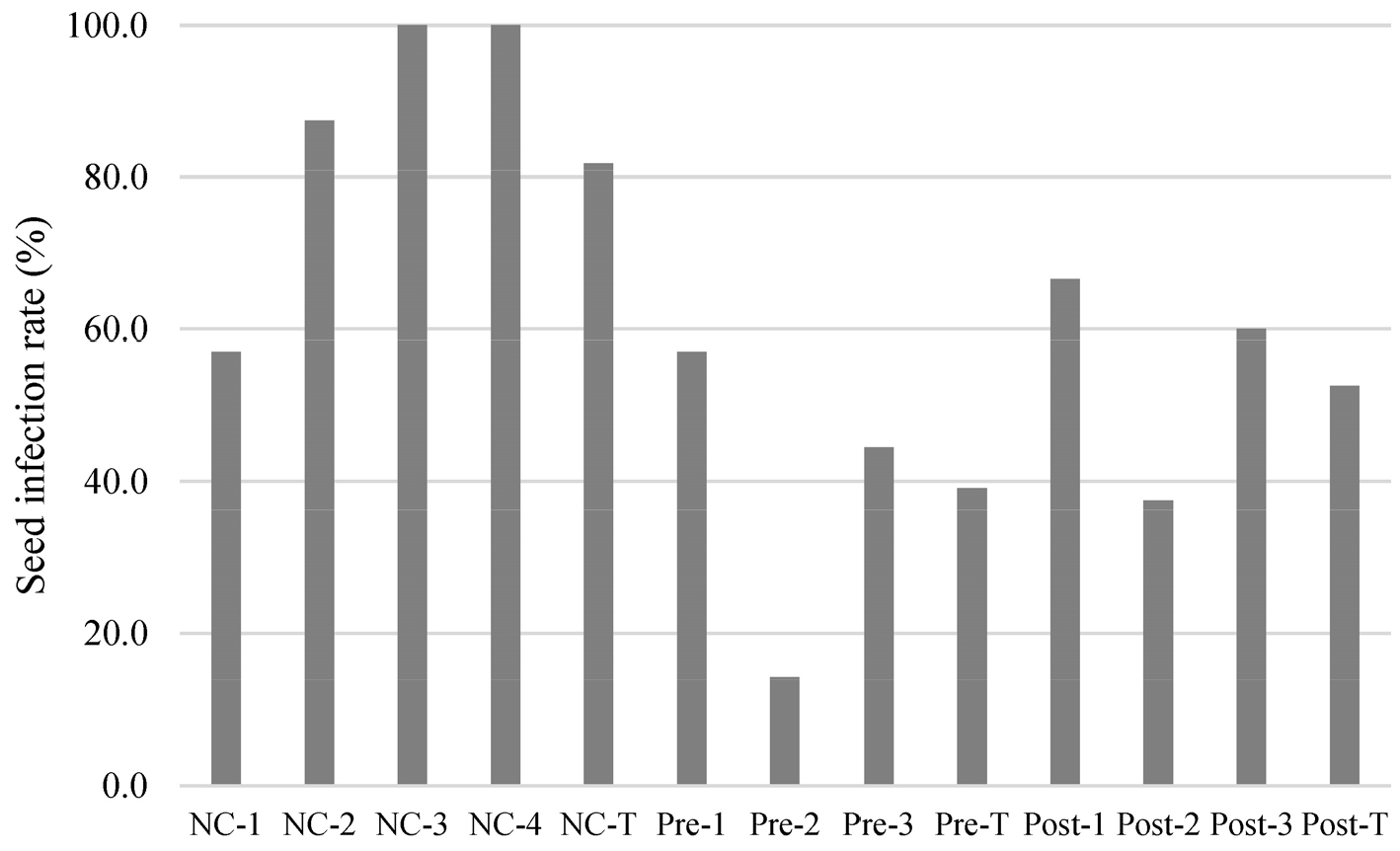
Fig. 5.
Seed infection (PCR-positive) rate (%). (NC-1: Negative control 1.0 x 102 (CFU/ml), NC-2: Negative control 1.0 x 103 (CFU/ml), NC-3: Negative control 1.0 x 104 (CFU/ml), NC-4: Negative control 1.0 x 105 (CFU/ml), NC-T: Total negative control, Pre-1: Pre-inoculation TIPL-6-1B, Pre-2: Pre-inoculation TIPL-8-1B, Pre-3: Pre-inoculation mix, Pre-T: Total pre-inoculation, Post-1: Post-inoculation TIPL-6-1B, Post-2: Post-inoculation TIPL-8-1B, Post-3: Post-inoculation mix), Post-T: Total post-inoculation).
Note: PCR-positive results were not observed in the control and positive control groups. The data was generated by combining all varieties and cultivation locations.
실험 결과에서 동일한 B. velezensis 종임에도 불구하고 길항균 간의 A. citrulli 에 의한 과실썩음병 억제 능력에서 차이가 뚜렷하게 나타났다(Fig. 3, Fig. 5, Table 3). 이러한 차이는 B. velezensis의 유전적 또는 후성유전학적 요인 때문일 수 있으며(Reva et al., 2019), 추후 연구에서 두 길항균주 간 억제 능력의 유전적 차이점을 규명하는 것이 필요하다.
Table 3.
Number of BFB-infected (PCR-positive) seeds harvested from plants treated with B. velezensis, before or after the artificial inoculation of A. citrulli in open-field and greenhouse experiments
|
(NSP1) / NFT2)) | Control |
Negative control (CFU/ml) | Positive control | Pre-inoculation | Post-inoculation | ||||||||||||||||
| 102 | 103 | 104 | 105 | Total |
TIPL- 6-1B |
TIPL- 8-1B | Mix | Total |
TIPL- 6-1B |
TIPL- 8-1B |
Mixture of strains | Total |
TIPL- 6-1B |
TIPL- 8-1B |
Mixture of strains | Total | |||||
|
OF- Leopard skin | 0/3 | 1/1 | 3/3 | 2/2 | 1/1 | 7/7 | 0/3 | 0/1 | 0/5 | 0/9 | 1/2 | 1/2 | 1/2 | 3/6 | 1/3 | 0/1 | 2/3 | 3/7 | |||
|
OF- Black skin | 0/3 | 1/3 | 1/1 | - | - | 2/4 | 0/1 | 0/2 | - | 0/3 | 2/2 | - | 0/1 | 2/3 | 1/1 | 0/6 | 0/1 | 2/8 | |||
|
GH- Leopard skin | 0/3 | 1/2 | 2/3 | 1/1 | 1/1 | 5/7 | 0/2 | 0/3 | 0/3 | 0/8 | 1/3 | 0/1 | 3/4 | 4/8 | 3/4 | 3/3 | 2/3 | 8/10 | |||
|
GH- Black skin | 0/3 | 1/1 | 1/1 | 1/1 | 1/1 | 4/4 | 0/3 | 0/3 | 0/4 | 0/10 | - | 0/4 | 0/2 | 0/6 | 3/4 | 3/6 | 2/3 | 8/13 | |||
| Total | 0/12 | 4/7 | 7/8 | 4/4 | 3/3 | 18/22 | 0/9 | 0/9 | 0/12 | 0/30 | 4/7 | 1/7 | 4/9 | 9/23 | 8/12 | 6/16 | 6/10 | 23/38 | |||
Note: In each treatment involving the treatment of B. velezensis and the inoculation of A. citrulli, nine replicates were tested. However, due to various environmental and physiological factors, there were instances of unsuccessful fertilization resulting in a reduced or even complete absence of seed formation.
A. citrulli(140)의 농도를 1.0 × 102 CFU/ml부터 1.0 × 105 CFU/ml까지 달리하여 인위적으로 과실썩음병을 유도한 결과, 병원균의 농도가 높을수록 암꽃 및 과실에서 더 강한 병징이 발생하는 것을 확인하였다(Fig. 3, Fig. 4). 반면, 낮은 농도에서는 병징이 나타나지 않았지만 종자 내에서 병원균이 검출되었다(Fig. 5, Table 3). 이는 이전 연구(Dutta et al., 2015)와 일치하며, 낮은 농도에서도 충분한 감염이 발생한다는 사실을 확인하였다.
한편, 본 연구에서 수확된 과실 수가 상대적으로 적었기 때문에, 이병 종자율 결과는 해석에 있어 다소 제한적일 수 있다. 각 처리구의 결과 차이는 더 많은 반복 실험을 통해 추가적으로 검증될 필요가 있다. 그럼에도 불구하고, 본 연구는 길항균이 수박 종자의 A. citrulli 감염을 방제하는 데 유의미한 정보를 제공하였으며, 후속 연구에서는 더 많은 샘플을 대상으로 한 실험이 필요하다.
요 약
Acidovorax citrulli는 세계적으로 박과 식물에서 과실썩음병을 유발하는 식물 병원성 세균이다. 이 병원균은 과실뿐만 아니라 종자에도 잠복하여 이후 세대에서 감염을 일으킨다. A. citrulli에 대한 연구는 주로 기내실험에서 진행되었기 때문에 실제 농업 환경을 재현하거나 과실과 종자에 미치는 영향을 연구는 희박하다. 본 연구에서는 기내실험에서 A. citrulli(140)에 대해 높은 억제 능력이 있는 길항균주(TIPL-6-1B, TIPL-8-1B)를 선발하였고, 이를 포장 실증 시험에 사용하였다. 노지 및 비닐온실에서 병원균(140) 및 길항세균(TIPL-6-1B, TIPL-8-1B)을 접종 및 처리한 결과, 길항세균을 처리한 식물은 음성 대조군에 비해 과실에서 BFB 발생률이 현저히 감소했으며, 이병종자율도 감소했다. 이 연구 결과를 토대로, Bacillus velezensis(TIPL-6-1B, TIPL-8-1B)가 실제 농업 현장에서 효과적인 A. citrulli (140)의 감염 억제를 나타내어 수박 재배에 도움이 될 수 있을 것으로 제안된다.