서 론
효모는 단세포 진핵미생물로서 오래전부터 빵, 주류, 장류 등의 발효식품 제조에 이용되어 왔으며(Lee et al., 1997; Lee et al., 2003; Lee, 1972), 상대적으로 저렴한 배지에서 배양이 가능한 효모는 진핵미생물을 연구하기 위한 모델로서 중요한 역할을 하고 있다(Oslan et al., 2012). 혈전분해능(Yi et al., 2014), 유해미생물 생육 억제능(Lee, 2005), 향기 성분 생성능(Rollero et al., 2018), 알코올 생성능(Choi et al., 2016) 또는 열내성 우수 균주(Choi et al., 2017) 등이 보고되었으며, 이 중 일부는 산업적으로 이용되고 있다. 덴마크 코펜하겐의 Carlsberg 양조장에서는 Saccharomyces cerevisiae 균주를 사용하여, 맥주를 생산하고 있으며(Hansen, 1883), 망고에서 분리된 S. boulardii 균주는 프로바이오틱스 효과가 입증되어 의약품으로 사용되고 있다(Rajkowska et al., 2012; Soccol et al., 2010; Toma et al., 2005). 이러한 효모의 고부가가치 산업 활용을 위해 새로운 효모의 분리 및 동정, 유용 특성을 탐색하기 위한 연구가 필요하다. 효모는 식품의 잎, 꽃, 나무줄기, 곤충, 토양, 동물의 배설물, 바다, 강 등 다양한 곳에서 분리되며, 국내에서는 전통발효식품 유래의 효모 균주에 대한 연구가 활발히 보고되어 있다(Choi et al., 2016; Choi et al., 2017; Jung et al., 2019; Park et al., 2013; Yoo et al., 2016).
Jung 등(Jung et al., 2019)은 누룩으로부터 46°C에서 자일로스를 대사하여 자일리톨을 생산하는 Millerozyma farinose MBY/L1597 균주를 분리한 바 있으며, Choi 등(Choi et al., 2016)은 누룩으로부터 맥아당을 이용하여 에탄올을 생산하는 S. cerevisiae MBYK45 균주를 분리 및 보고한 바 있다.
최근에는 국내외에서 식품 외의 자연환경으로부터 다양한 효모를 확보하기 위한 연구들이 수행되고 있으며(Hyun et al., 2014; Hyun et al., 2013; Lopes et al., 2018; Yoo et al., 2016; Yoon et al., 2020), Lopes 등(Lopes et al., 2018)은 브라질 생태계의 썩은 나무로부터 셀로비오스 발효 효율이 우수한 Candida jaroonii와 Yamadazyma sp1. 균주를 분리 및 보고하였다. Han 등(Han et al., 2017)은 대한민국 충남 서천군 토양으로부터 분리한 20점의 효모 균주를 동정하고 배양학적 특성을 확인하였으며, 선유도 일대의 야생화에서 분리된 Kazachstania servazzii SY14-3 균주는 98.6%으로 높은 α-glucosidase 저해활성을 나타냈으며(Hyun et al., 2014), 서울 구로동에서 분리된 Pseudozyma hubeiensis 228-S-1 균주의 경우 xanthine oxidase 저해물질을 생성하여 야생화에서 분리한 효모의 산업적 활용가능성을 확인한 바 있다(Hyun et al., 2013). 또한 Yoon 등(Yoon et al., 2020)의 연구에서 춘천에서 수집한 시네라리아 꽃으로부터 40°C의 온도에서 10.05 ± 0.06 g의 에탄올을 생산하는 Hanseniaspora opuntiae MBY/L6793 균주를 분리하여 동시당화 활용가능성을 확인한 바 있다.
Starmerella vaccinii 균주는 일본의 블루베리 꽃으로부터 처음 분리되었고(Santos et al., 2018), 유전자 계통 발생학적 분석에 따라 2018년 Candida vaccinii에서 Starmerella vaccinii로 새롭게 명명되었다(Santos et al., 2018). S. vaccinii 균주는 시리아의 아욱꽃으로부터 분리된 S. syriaca 균주(Sipiczki, 2015), 한국의 대둔산에서 분리된 Asterotremella humicola 등과 같은 희귀 균주들의 생리적 특성을 확인하기위해 비교된 바 있으나(Han et al., 2017), S. vaccinii 균주의 자체 특성을 확인하기 위한 연구는 미비한 상황이다. 따라서 S. vaccinii 균주에 대한 생육특성, 배양특성에 대한 연구 및 산업적 이용가능성에 대한 검토가 필요하다.
본 연구에서는 춘천의 패랭이꽃(Dianthus chinensis)으로부터 분리한 S. vaccinii 균주의 탄소원 대사 및 배양특성을 확인하여 산업적 응용 가능성을 확보하고자 하였다.
재료 및 방법
강원도 춘천시에서 수집한 10종의 야생화를 chloramphenicol(100 mg/l, Sigma-Aldrich, USA)이 첨가된 YEPD (yeast extract 10 g/l, peptone 20 g/l, glucose 20 g/l, BD Diagnostic, USA) 배지에 현탁하여 30°C에서 24시간 동안 배양한 후, YEPD 평판 배지에 도말하여 단일집락을 확보하였다.
다양한 탄소원을 대사할 수 있는 효모를 선발하기 위해 단일집락을 YEPD 배지에 접종하고 24시간 동안 배양한 후, 원심분리(5,000 ×g, 2 min)하여 균체를 회수하였다. 균체는 멸균 증류수로 3회 세척하고 세포흡광도(OD600)가 1.0이 되도록 한 후, 연속적으로 10배씩 희석하여 2%의 글루코스, 자일로스, 셀로비오스, 갈락토스를 각각 포함하는 YEP 고체 배지에 8 ㎕씩 점적하고 40°C에서 배양하였다.
선발된 균주의 염색체 유전자는 ExiPrep™ Tissue Genomic DNA Kit(Bioneer, Korea)를 이용하여 추출하였으며, 프라이머 NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')과 NL4(5'-GGTCCGTGTTTCAAGACGG-3') (Reynolds and Taylor, 1993)를 사용하여 26S rRNA 유전자 단편을 증폭하였다. 분석된 염기서열은 Blast(https://blast.ncbi.nlm. nih.gov/ Blast.cgi)를 통해 NCBI(https://www.ncbi.nlm.nih.gov/)에 등록되어 있는 염기서열과의 상동성을 비교하여 분리균주를 동정하였으며, MEGA-X(Kumar et al., 2018)의 이웃연결방법(neighbor joining method)(Saitou and Nei, 1987)을 사용하여 계통수를 분석하였다.
탄소원 대사특성은 API 20C AUX kit(BioMérieux, France)(Davey et al., 1995)를 사용하여 확인하였다. 또한, 균주 배양액을 원심분리(5,000 ×g, 2 min)한 후, 균체를 회수하여 멸균 증류수로 3회 세척하고, 2%의 글루코스, 수크로스, 갈락토스, 자일로스, 자일란, 전분, 셀로비오스를 각각 포함하는 YEP 배지에 세포흡광도(OD600)가 0.1이 되도록 접종하였다. 배양액은 30°C에서 200 rpm으로 교반하며, 세포흡광도(OD600)와 에탄올 농도를 측정하였다.
배양 온도와 배지의 산도에 따른 균체성장을 확인하기 위해 균주 배양액을 원심분리(5,000 ×g, 2 min)하여 균체를 회수하였으며, 멸균 증류수로 3회 세척한 후 YEPD 배지에 세포흡광도(OD600)가 0.1이 되도록 접종하였다. 배양액은 200 rpm으로 교반하며 2시간 마다 세포흡광도(OD600)를 측정하였다. 배지의 산도는 완충용액(pH 4.0, 5.0: citrate buffer, pH 6.0, 7.0: potassium phosphate buffer, pH 8.0: tris-HCl buffer)을 사용하여 조정하였다.
세포흡광도(OD600)는 분광광도계(Mecasys, Korea)를 사용하여 측정하였으며, 에탄올 농도는 굴절률 검출기(Shimadzu, Japan)가 장착된 고성능 액체 크로마토 그래프(High Performance Liquid Chromatograph, Shimadzu, Japan)를 사용하여 측정하였다. 컬럼은 Rezex ROA-Organic Acid H+(Phenomenex, USA)를 65°C로 유지하여 사용하였으며, 이동상인 0.005 N의 황산용액은 0.6 ml/min의 유속으로 흘려주었다. 모든 측정은 3회 반복하였으며, SPSS Statistics(v22, IBM, USA)를 이용하여 Duncan의 다중범위 검정법(Duncan, 1955)으로 유의성을 검증하였다.
결 과
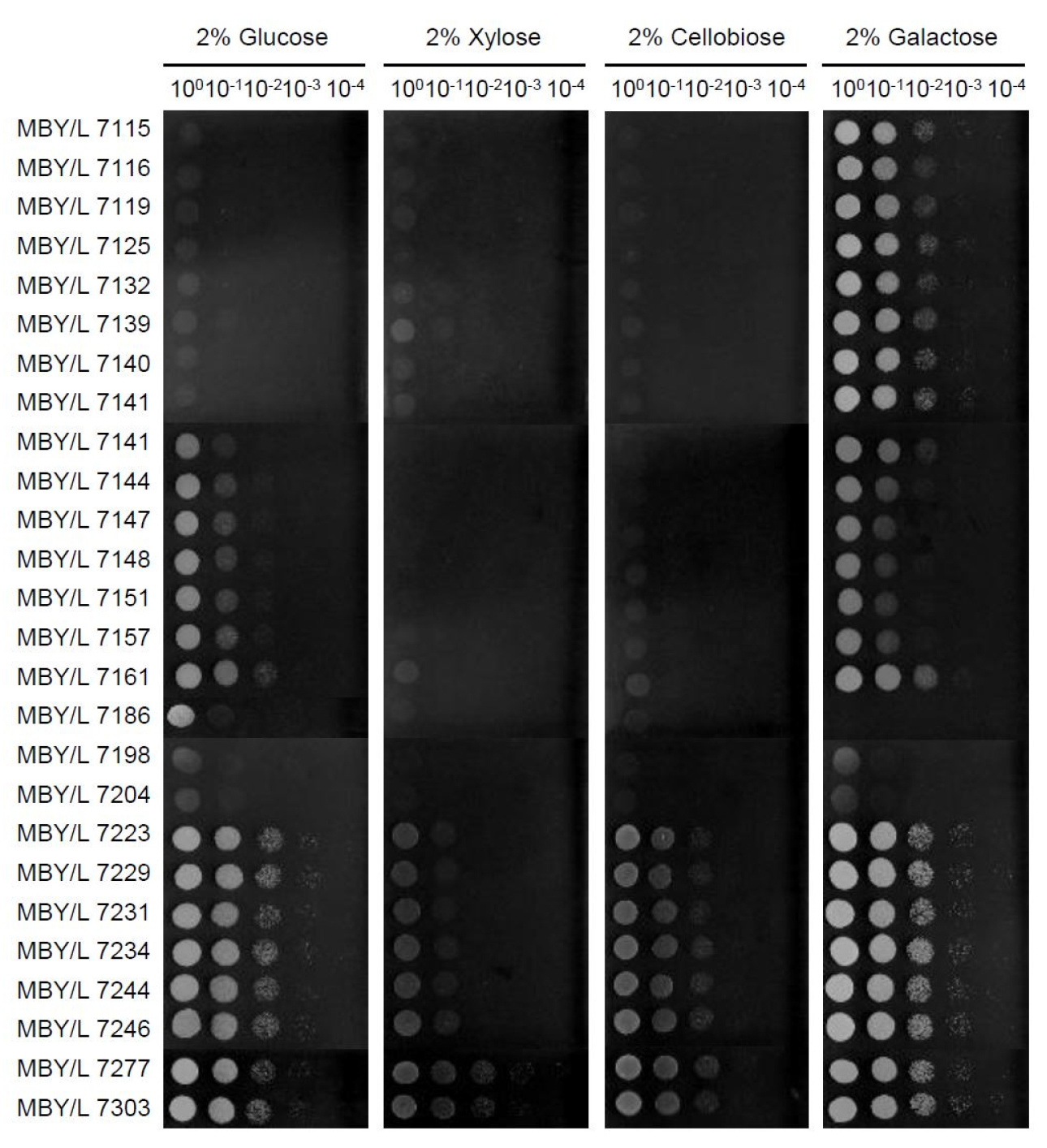
강원도 춘천시에서 수집한 10종의 야생화로부터 258점의 균주를 분리하였으며, 그 중 37°C에서 생육하는 균주 26점을 선별하여 배지 탄소원에 따른 생육을 40°C에서 비교하였다(Fig. 1). MBY/L7198과 MBY/L7204를 제외한 대부분의 균주들은 갈락토스가 첨가된 배지에서 우수한 생육을 나타냈으며, MBY/L7277과 MBY/L7303을 제외한 균주들은 자일로스가 첨가된 배지에서 잘 생육하지 못하였다. 패랭이꽃으로부터 분리된 MBY/L7303 균주의 26S rRNA 유전자 염기서열을 분석한 결과, Starmerella vaccinii(KY106857) 균주와 99%의 상동성을 나타냈으며, 분석된 염기서열은 GenBank(https://www.ncbi.nlm.nih.gov/nuccore/)에 등록하여 Starmerella vaccinii MBY/L7303 (MW465704)으로 명명하였다(Fig. 2, Table 1).

Fig. 2
Phylogenetic relationships of the 26S rRNA region of Starmerella vaccinii MBY/L7303 with other yeast strains. One segment corresponds to an evolution distance of 0.005 and is indicated by bars. The number shown is the bootstrap value, and the GenBank accession numbers are shown in parentheses.
Table 1.
The homology cross table of the 26S rRNA region of the Starmerella vaccinii MBY/L7303 and other yeast strains
S. vaccinii 균주는 블루베리 꽃에서 분리된 바 있으나 국내외에 잘 보고되지 않은 희귀 미생물이며(Santos et al., 2018), 야생화에서 분리된 미생물로는 K. servazzi(Hyun et al., 2014), P. hubeiensis(Hyun et al., 2013), H. opuntiae (Yoon et al., 2020), S. syriaca(Sipiczki, 2015) 등이 보고된 바 있다.
Starmerella 속 균주들의 유전적 상동성을 비교한 결과(Table 1), S. vaccinii MBY/L7303(MW465704)은 S. vaccinii(KY106857) 균주와 98.57%으로 가장 높은 유전적 상동성을 나타냈으며, S. magnoliae(NG060814) 균주와는 95.95%의 상동성을 나타냈다. S. magnoliae(NG060814)와 S. sorbosivorans 균주, S. sorbosivorans와 S. geochares(NG060806) 균주는 98.41%와 98.27%으로 다른 종의 균주이나 유전적으로 유사한 것으로 사료된다.
다양한 탄소원에 대한 대사특성을 확인하였다(Table 2). Sipiczki(Sipiczki, 2015)의 연구에 따르면 S. vaccinii CBS7318 균주의 경우, 자일로스와 갈락토스를 대사하지 못하였으며, 셀로비오스를 천천히 대사하였다(Table 2). 또한, 꽃으로부터 분리된 S. syriaca 2-1362 균주(Sipiczki, 2010)는 자일로스는 대사하였지만 갈락토스와 셀로비오스를 대사하지 못하였으며, C. stigmatis 11-469 균주(Sipiczki, 2010)는 자일로스와 갈락토스를 대사하지 못하고 셀로비오스에서 적은 생육을 나타냈다. S. vaccinii MBY/L7303 균주는 꽃으로부터 분리된 다른 균주들과 비교하여 더 많은 탄소원을 이용하였다. 특히 동종인 S. vaccinii CBS7318와 비교하여 자일로스, 갈락토스를 대사할 수 있을 뿐만 아니라 셀로비오스에 대해 더 우수한 대사능을 나타냈다.
Table 2.
Characteristics of carbohydrate utilization in Starmerella vaccinii MBY/L7303 and other yeast strains
| Characteristics | S. vaccinii MBY/L7303 | S. vaccinii CBS7318 | S. syriaca 2-1362 | C. stigmatis 11-469 |
| Glucose | + | + | + | + |
| Glycerol | + | + | + | + |
| 2-Keto-D-gluconate | - | d | + | - |
| L-Arabinose | - | - | - | - |
| D-Xylose | + | - | + | - |
| Adonitol | - | - | - | + |
| Xylitol | - | d | + | - |
| D-Galactose | + | - | - | - |
| Inositol | - | - | - | - |
| D-Sorbitol | + | n | n | n |
| ɑ-Methyl-D-glucoside | - | - | - | - |
| N-Acetyl-D-glucosamine | - | n | n | n |
| D-Cellobiose | + | w, d | - | w |
| D-Lactose | - | - | - | - |
| D-Maltose | - | - | - | - |
| D-Saccharose | + | w | - | + |
| D-Trehalose | - | n | - | - |
| D-Melezitose | - | n | - | - |
| D-Raffinose | - | - | - | + |
| Reference | This study | (Sipiczki, 2015) | (Sipiczki, 2010) | (Sipiczki, 2010) |
각각의 탄소원을 첨가한 배지에서 S. vaccinii MBY/L7303 균주의 배양특성을 확인하였다(Fig. 3). 배양 20 시간 후, 셀로비오스를 첨가한 배지에서 S. vaccinii MBY/L7303 균주의 세포흡광도(OD600)는 21.93 ± 0.09으로 가장 높은 성장을 나타냈으며, 글루코스를 탄소원으로 사용한 경우 세포성장은 세포흡광도(OD600) 15.00 ± 0.08이었다. 이러한 결과는 표 2의 결과와도 일치하였으며, S. vaccinii CBS7318 균주(Sipiczki, 2015)와 비교하여 셀로비오스 대사능이 우수할 것으로 판단된다. S. vaccinii MBY/L7303 균주의 자일란과 전분 대사속도는 다른 탄소원의 대사속도와 비교하여 더뎠으나, 최대 세포흡광도(OD600)는 16.23 ± 0.05와 17.17 ± 0.05으로 셀로비오스를 제외한 다른 탄소원들과 유사하게 나타났다. 모든 탄소원을 첨가한 배지에서 에탄올은 측정되지 않았다. S. vaccinii 균주의 배양특성에 대한 연구는 보고 된 바 없으며, Ha 등(Ha et al., 2011)의 연구에서 S. cerevisiae D452-2 균주는 셀로비오스 40 g/l와 갈락토스 40 g/l를 각각 첨가한 배지에서 36시간 동안 최대 세포흡광도(OD600) 약 13과 10까지 성장하여 S. vaccinii MBY/L7303 균주보다 상대적으로 낮은 균체성장을 나타냈다.
S. vaccinii MBY/L7303 균주는 기존에 보고된 균주들과 비교하여 다양한 탄소원을 대사할 수 있으며, 균체성장 또한 우수한것으로 판단된다. 에탄올을 생산하지 않아 대사한 탄소원 대부분은 균체성장에 이용된 것으로 추정되며, 추가 연구를 통해 균체 또는 유용 단백질 생산을 위한 균주로 사용될 가능성을 검토할 필요가 있을 것으로 판단된다.
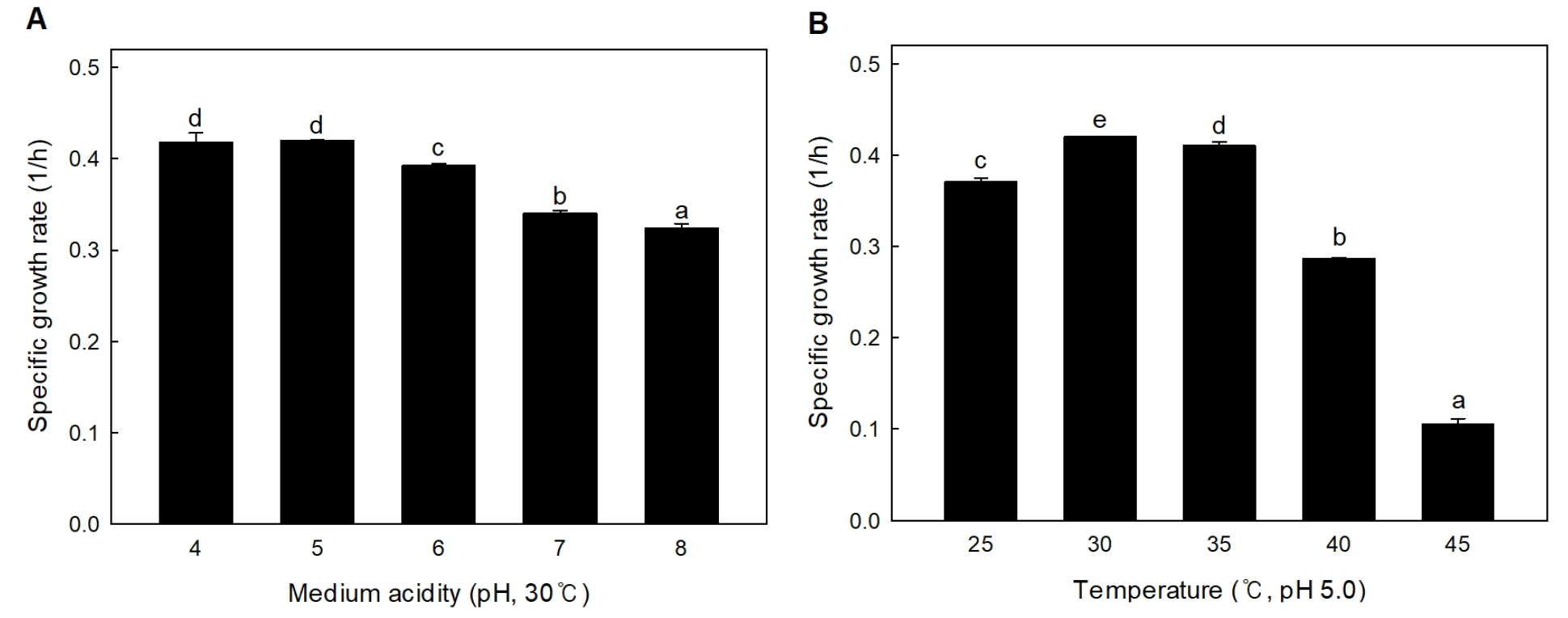
S. vaccinii MBY/L7303 균주의 배양온도와 배지산도에 따른 생육특성을 확인하기위해 비성장속도를 측정하였다(Fig. 4). S. vaccinii MBY/L7303 균주는 pH 5.0에서 0.41 ± 0.00 1/h으로 가장 높은 비성장속도를 나타내어 내산성이 우수할 것으로 판단되며, pH 4.0과의 유의적인 차이는 나타나지 않았다. 배양온도 30°C에서 0.42 ± 0.00 1/h로 가장 높은 비성장속도를 나타냈으나, 0.41 ± 0.00 1/h의 비성장속도를 나타낸 35°C와의 차이는 미미하였다. 배양온도 45°C에서의 비성장속도는 30°C에서의 약 24% 수준으로 가장 낮은 비성장속도를 나타냈다. 따라서, S. vaccinii MBY/L7303 균주는 배양온도 30°C, 초기 pH 5.0에서 가장 우수한 비성장속도를 나타냈다.
본 연구 결과는 희귀 미생물인 S. vaccinii 균주를 분리하고 특성을 확인하였으며, 효소 활성 및 유용 단백질 생산성 평가 등 추가 연구를 통해 바이오산업에 응용하기 위한 기초자료로 활용될 수 있을 것으로 사료된다.
요 약
강원도 춘천시에 서식하는 야생화로부터 258점의 효모 균주를 분리하였다. 분리된 균주 중 40°C에서 글루코스, 자일로스, 셀로비오스, 갈락토스를 탄소원으로 사용하고 생육이 우수한 MBY/L7303 균주를 선발하였다. 균주의 26S rRNA 유전자 염기서열을 분석한 결과 Starmerella vaccinii로 동정되어 GenBank(MW465704)에 등록하였다. S. vaccinii MBY/L7303 균주는 글루코스, 셀로비오스, 수크로스, 갈락토스, 자일로스, 자일란, 전분을 탄소원으로 이용하는 것이 확인되었으며, 배지에 첨가된 2% 셀로비오스로부터 에탄올은 생산하지 않았으나 세포흡광도(OD600) 21.93 ± 0.09까지 성장하였다. 배양온도와 pH에 따른 S. vaccinii MBY/L7303 균주의 생육특성을 확인한 결과 30°C, pH 5.0 에서 가장 높은 비성장속도(0.41 ± 0.00 1/h)를 나타냈다. 본 연구를 통해 확보된 결과는 S. vaccinii 균주의 산업적 응용을 위한 기초자료로서 활용될 수 있을 것으로 사료된다.