서 론
재료 및 방법
L. plantarum L-14
동물실험
채혈 및 백색 지방조직 적출
혈액학적 분석
간 조직액의 항산화 활성
조직의 병리학적 분석
통계 방법
연구결과 및 고찰
체중증가, 식이섭취량 및 식이효율
변 무게 및 변의 수분함량
복부 백색지방 조직
혈액학적 분석
혈중 metabolic parameters
간조직의 총 항산화능 및 조직염색
결 론
서 론
비만은 장기적 치료가 필요한 만성질환이며, 서구화된 식습관과 코로나 여파로 비만 인구가 급속이 증가하고 있다. 세계보건기구(WHO)에서는 2030년까지 전 세계적으로 10억 명 이상의 성인이 비만이 될 것으로 추정하고 있어 공중보건에 큰 위협이 되고 있다(Busebee et al., 2023). 비만은 웰빙과 삶의 질에 매우 중요한 영향을 미치며, 심혈관 질환, 당뇨, 호흡기 질환, 암 등과 같은 비전염성 질환의 주요 위험요인이다. 비만의 근본적인 원인은 칼로리 섭취와 소비의 불균형에 있으나, 고칼로리 섭취, 생활습관, 장내 미생물 균총, 내분비 장애, 유전적 요인 등 다양한 원인에 의해 발생할 수 있다(Kaila and Raman, 2008). 현재, 사용되고 있는 비만 치료제는 고도 비만인 경우에 효과를 제공하지만, 메스꺼움, 설사, 구토 등의 부작용과 일부 암의 발병 사례가 보고되어(Mehta et al., 2017), 안전하고 효과적인 대체약물 확보를 위해 다양한 소재개발 연구가 진행되고 있으며, 그 가운데에서도 미생물을 기반한 소재가 주목을 받고 있다(Sorbara and Parmer, 2022).
위장관에 존재하는 500-1000여 종의 장내 미생물 균총은 영양소대사, 약물대사, 병원성 미생물의 집락억제, 장벽보호, 면역강화 등 다양한 생리반응에 작용하여 인체에 중요한 영향을 미친다(Jandhyala et al., 2015). 건강한 사람의 장내 미생물은 Bacteroidetes 문과 Firmicutes 문의 구성이 70% 이상을 차지한다. 그러나, 비만인의 경우에는 상대적으로 Firmicutes 문의 비율이 증가하고, Bacteroidetes 문의 비율은 감소하게 된다(Turnbaugh et al., 2009). Bäckhed et al.(2004)은 무균 마우스에 비만 마우스의 장내 미생물을 정착시켰을 때, 식이섭취량을 늘리지 않고도 14일 이내에 체지방이 60%이상 증가하고, 지방조직에서 에너지 저장에 관여하는 유전자의 발현이 증가되었다고 보고하였다. 이전 연구에서 장내 미생물 균총 변화가 체중과 지방량을 감소시키고 인슐린 감수성을 개선한다는 사실이 입증되었다(Ellulu et al., 2017). 따라서, 장내 미생물군은 비만 발병에 근본적인 역할을 한다고 볼 수 있다.
프로바이오틱스는 적당량을 섭취하였을 때, 인체에 이로움을 주는 살아있는 균으로 Lactobacillus sp., Bifidobacterium sp., Bacillus sutillus, Enterococcus faecium 등이 이에 속하며, 항균・항산화・항암・면역강화 등 다양한 기능이 보고되었다(Tang and Lu, 2019). 또한, 프로바이오틱스는 장내 미생물 균총의 구성을 변경하여 비만으로 인한 대사 장애와 체중 증가를 개선하는 효과가 규명되었으며, 새로운 균주의 항비만 기능성 검증 연구를 위해 식이성 비만 모델을 활용하고 있다(Tang et al., 2021). 대표적인 프로바이오틱스 균주인 Lactobacillus 균은 발효 식품의 풍미, 질감, 관능적 특성을 향상시키는 발효 종균으로 오랫동안 사용하고 있으며, 미국식품의약국(FDA)에서는 GRAS(Generally Recognized as Safe), 유럽식품안전청(EFSA)에서는 QPS(Qualified Presumption of Safety) 규격으로 Lactobacillus 균의 안전성이 오랜 기간 인정되고 있다(Behera et al., 2018). 최근에는 프로바이오틱스 생균뿐만 아니라, 불활성화된 상태의 파라바이오틱스, 세포외 다당류(EPS), 단쇄지방산 등 프로바이오틱스 대사산물인 포스트바이오틱스에 대한 기능성 연구로 확대되고 있다(Nataraj et al., 2020).
L. plantarum은 lactobacillus 종에 속하는 그람 양성세균으로 발효과정에서 젖산(lactic acid)을 생성하는 전형적인 통성 혐기성균이며, 인간과 포유류의 소화기관 및 비뇨생식기에서 분리된다. L. plantarum은 천연발효식품에서 잘 자라는 특성이 있어 식품발효, 보존제, 의료용 치료제로 다양하게 활용되고 있다(Torino et al., 2015). 또한, L. plantarum이 생성하는 EPS는 물리・화학적 특성을 이용한 식품, 제약산업에서의 활용도가 높고, L. plantarum의 bacteriocin은 plantaricin으로 식품산업에서 생물 보존제로 활용되고 있다(Settanni and Corsetti, 2008). 게다가, EPS는 프로바이오틱스의 기능성을 가지고 있어 장내 미생물군 개선, 면역체계 조절, 혈중 콜레스테롤 조절, 암의 위험성 감소 등 각종 질병 예방 및 치료를 위한 새로운 전략 소재가 될 수 있다(Abdelazez et al., 2018).
L. plantarum L-14(L-14)는 2018년에 한국생명과학연구원 생물자원센터에 기탁된 균주(KTCT13497BP)로 L-14 추출물과 EPS 성분의 항암(Park et al., 2020), 항비만(Lee et al., 2021), 항염증 효과(Kwon et al., 2020)가 보고되었다. 본 연구는 이전 연구에서 사용하지 않은 L-14 배양액과 생균을 분말화하여 고지방식이로 유도한 비만 마우스에서 체중, 혈중 지질농도, 인슐린 저항성을 분석하여 L-14의 체지방 감소효과를 평가하고자 하였다.
재료 및 방법
L. plantarum L-14
L-14 배양액과 생균 원말시료는 ㈜비피도에서 제공받아 사용하였다. L-14 배양액 원말에는 유산균 대사체와 생균이 포함되었다. 건조된 원말은 그룹별로 하루 투여량씩 분주한 후, 냉동보관하여 사용하였다.
동물실험
5주령 수컷 C57BL/6J 마우스를 ㈜대한바이오링크(Eumseong, Korea)에서 공급받아 (재)홍천메디칼허브연구소 동물실험실에서 1주간 일반사료(2918C Diets, Envigo, USA)를 제공하여 적응시킨 후, 실험에 사용하였다. 동물 실험실은 온도 23 ± 2°C, 습도 50 ± 5%, 12시간 자동으로 명암을 조절을 하였다. 실험군은 대조군(NC, normal control), 비만군(HF, HFD), 저용량 L-14 배양액 투여군(ML, HFD + 2.5 × 108 cfu/mouse), 고용량 L-14 배양액 투여군(MH, HFD + 5.0 × 108 cfu/mouse), 저용량 L-14 생균 투여군(PL, HFD + 5 × 108 cfu/mouse), 고용량 L-14 생균 투여군(PH, HFD + 2 × 109 cfu/mouse)으로 나누었고, 각 군당 8마리로 구성하였다. 대조군은 10 kcal% fat diet(D12450J, Research Diets Inc. New Brunswick, NJ, USA)를, 나머지 실험군은 60 kcal% fat diet(D12492B, Research Diets Inc.)를 자유급이하였다. L-14 원말의 투여농도는 고지방식이 유도 비만 마우스 모델을 활용한 연구에서 L. plantarum 균주가 효능을 나타낸 유효농도인 108-1010 cfu/(mL・day) 범위를 참고하여 결정하였다(Tian et al., 2023). L-14 원말은 그룹별로 하루 투여량씩 분주해 놓은 튜브에 PBS를 넣어 균주를 현탁하여 7주간 매일 경구투여를 실시하였고, NC과 HF군은 vehicle로 PBS를 투여하였다. 식이 섭취량과 체중은 주 2-3회 측정하였다. 본 연구는 (재)홍천메디칼허브연구소 실험동물운영위원회 승인(HIMH A23-04)을 받아 수행하였다.
채혈 및 백색 지방조직 적출
실험종료 하루 전 케이지의 사료를 제거하여 12시간 이상 금식을 실시하였다. 이소플루란을 이용하여 심마취한 후 안와채혈을 실시하였다. 채혈한 혈액은 2,000 × g, 4°C에서 15분간 원심분리하여 혈장을 분리하였고, 분석 전까지 -80°C 냉동고에 보관하였다. 백색 지방조직은 부고환지방, 신장지방, 복막하지방, 피하지방, 내장지방을 적출하였다.
혈액학적 분석
Total cholesterol(TC), LDL-cholesterol(LDL-C), triglyceride(TG), glucose, asparate aminotransferase(AST), alanine aminotransferase(ALT)는 자동분석기를 이용하여 분석하였다(Konelab 20XT, Thermo Fisher Scientific, Waltham, MA, USA). Insulin(Millipore, Billerica, MA, USA), adiponectin, leptin(R&D systems, Minneapolis, MN, USA)은 ELISA kit을 사용하였고, Free fatty acid는 효소기반 방법을 사용한 분석 kit(DogenBio, Seoul, Korea)를 사용하였다.
간 조직액의 항산화 활성
간조직 100 mg에 차가운 PBS(pH 7.0) 1 mL을 넣고 균질화하여 10,000 × g, 4°C에서 20분간 원심분리하여 상등액을 사용하였다. 총항산화능(Total antioxidant capacity)과 지질과산화 생성물인 malonadehyde(MDA)는 DoGenBio사의 분석 kit를 사용하였다.
조직의 병리학적 분석
간과 부고환지방은 10% formaldehyde 용액에 고정한 후, 탈수와 파라핀 포매 전처리 과정을 거친 후, 3 µm 두께로 박절하여 Hematoxylin and Eosin 염색을 실시하였다. 간조직의 지방침착 정도는 5점 척도로 평가하였으며, 지방세포의 크기는 슬라이드에서 임의로 3곳을 선택하여 5개의 지방구 크기를 이미지 분석장치(i-Solution Lite)를 이용하여 측정하였다.
통계 방법
실험결과는 mean ± standard deviation (SD)으로 나타내었고, 통계처리는 Graphpad 7.05를 이용하여 one-way ANOVA로 분석하였다. 기간에 따른 체중변화는 two-way ANOVA을 사용하였다. 처리군간의 유의성은 Dunnett’s multiple comparison test로 P < 0.05 수준에서 유의성 검정을 실시하였다.
연구결과 및 고찰
체중증가, 식이섭취량 및 식이효율
고지방식이로 유도한 비만 마우스에 유산균 L-14를 투여한 7주간의 체중변화, 식이섭취량, 식이효율은 Table 1과 Fig. 1에 제시하였다. HF군은 고지방식이 섭취 시작부터 체중이 빠르게 증가하여 실험 2주차부터 NC군과 유의적인 차이를 보였고, 실험종료일까지 NC군과 현저한 차이를 나타내었다(Fig. 1A). 실험동물을 이용한 식이성 비만을 평가할 때, 체중이 정상 식이군보다 10-25% 이상이면 중증비만, 40% 이상 증가할 경우에는 고도비만으로 평가한다(Levin and Dunn-Meynell, 2002). HF군의 최종 체중은 35.94 ± 1.42 g으로 7주 동안 14.67 g 증가하였고, NC군 26.97 ± 1.29 g보다 34.25% 유의적으로 증가하여 중증이상의 비만증 모델을 확립하였다(P < 0.001). HF군과 비교하였을 때, L-14 투여군의 체중감소율은 PH군 17.44% > MH군 12.50% > ML군 10.35% > PL군 8.26% 순으로 체중감소 효과를 나타내었다. 고지방식이를 장기간 섭취하면 장내미생물 불균형이 일어나 firmicutes/bacteroidetes 비율이 증가하는데, Cai et al.(2022)은 L. plantarum FRT4가 식이성 비만 마우스의 장내미생물을 재구성하여 유익한 미생물의 대사산물 작용으로 비만의 위험성이 개선되었다고 보고하였다. 최근에는 다양한 발효식품에서 분리한 신규 L. plantarum 균주의 비만과 만성 대사성 질환에 대한 효능검증과 작용기전을 규명하는 연구들이 보고되고 있다(Hao et al., 2024).
Table 1.
Effect of L. plantarum L-14 on body weight, food intake, and food efficiency ratio in HFD-induced obese mice
| Group | Initial weight (g) | Final weight (g) | Food intake (g/day) | FER (%) |
| NC | 20.58 ± 1.21 | 26.97 ±1.29 | 2.59 ± 0.38 | 5.14 ± 0.98 |
| HF | 20.93 ± 0.68 | 35.94 ± 1.42### | 2.26 ± 0.39### | 13.53 ± 2.24### |
| ML | 20.40 ± 0.92 | 32.01 ± 2.33** | 2.18 ± 0.29 | 11.18 ± 2.34** |
| MH | 20.53 ± 0.88 | 32.01 ± 2.12** | 2.00 ± 0.24** | 12.08 ± 2.62 |
| PL | 20.67 ± 1.26 | 32.96 ±2.28** | 2.24 ± 0.27 | 11.88 ± 2.24* |
| PH | 20.49 ± 0.76 | 29.81 ± 1.91*** | 2.08 ± 0.44* | 9.55 ± 2.37*** |
NC, normal control; HF, HFD group; ML, HFD + 2.5 × 108 cfu of L-14 medium; MH, HFD + 5 × 108 cfu of L-14 medium; PL, HFD + 5 × 108 cfu of L-14 cells; PH, HFD + 2 × 109 cfu of L-14 cells. FER, food efficiency ratio = body weight gain (g) / food intake (g) × 100. Data represent mean ± SD (n = 8). ###P < 0.001 vs NC; *P < 0.05, **P < 0.01, ***P < 0.001 vs HF.

Fig. 1.
Effect of L. plantarum L-14 on body weight changes in HFD-fed mice. (A) Body weight changes, (B) Representative images of mice in each group. NC, normal control; HF, HFD group; ML, HFD + 2.5 × 108 cfu of L-14 medium; MH, HFD + 5 × 108 cfu of L-14 medium; PL, HFD + 5 × 108 cfu of L-14 cells; PH, HFD + 2 × 109 cfu of L-14 cells. Data represent mean ± SD (n = 8). ##P < 0.01, ###P < 0.001 vs NC; *P < 0.05, **P < 0.01, ***P < 0.001 vs HF.
식이섭취량은 HF군이 2.26 ± 0.39 g/day로 NC군 2.59 ± 0.38 g/day보다 유의적으로 감소하였으나(P < 0.001), 식이효율은 HF군이 13.53 ± 2.24%로 NC군 5.14 ± 0.98%보다 2.6배 증가하였다(P < 0.001). L-14 투여군의 식이효율은 MH군을 제외하고 HF군보다 유의적으로 감소하여 식이섭취당 체중증가를 억제하는 효과를 나타내었다. 식이효율에 따른 체중감소 효과는 미생물 대사체가 함유된 L-14 배양액보다는 L-14 균수가 높은 PH군에서 체중증가 억제효과가 크게 나타났다. 본 연구에서 L-14 배양액과 생균은 비만 마우스의 체중증가를 억제하는 효과적인 소재임을 확인하였다.
변 무게 및 변의 수분함량
실험 종료 전 3일간 수거한 변의 평균무게는 HF군이 272.75 ± 26.68 mg/day로 NC군 261.35 ± 36.19 mg/day와 차이가 없었다(Table 2). 반면, MH군은 327.64 ± 24.00 mg/day(P < 0.01), PL군은 300.24 ± 16.70 mg/day(P < 0.05)로 HF군보다 유의적으로 증가하였다. 변의 수분함량은 HF군이 5.96 ± 1.10%로 NC군 10.24 ± 2.83%보다 41.76% 감소하였으며(P < 0.05), PL군을 제외한 L-14 투여군에서는 변의 수분함량이 HF군보다 유의적으로 증가하였다. 특히, PH군의 변 수분함량은 13.62 ± 2.90%로 NC군보다 33.13% 증가하였다. 변 수분량은 같은 균수를 투여하였을 때, 미생물 대사체를 포함한 배양액 투여군인 MH군이 생균투여군 PL군보다 변의 수분함량이 높게 나타났다. 본 연구결과는 Yoo et al.(2013)의 항비만 실험에서 고지방식이군보다 유산균 투여군에서 변 배설량이 유의적으로 증가한 결과와 일치하였다.
Table 2.
Effect of L. plantarum L-14 on fecal weight and fecal water content in HFD-induced obese mice
| Group | Fecal wet weight (mg/day) | Fecal dry weight (mg/day) | Fecal water content (%) |
| NC | 261.35 ± 36.19 | 236.57 ± 33.32 | 10.24 ± 2.83 |
| HF | 272.75 ± 26.68 | 254.31 ± 25.69 | 5.96 ± 1.10# |
| ML | 298.67 ± 43.55 | 269.49 ± 39.59 | 9.76 ± 1.58* |
| MH | 327.64 ± 24.00** | 283.29 ± 41.15 | 10.30 ± 2.71* |
| PL | 300.24 ± 16.70* | 277.53 ± 18.47 | 8.48 ± 2.24 |
| PH | 274.51 ± 51.05 | 246.77 ± 50.24 | 13.62 ± 2.90*** |
복부 백색지방 조직
L-14 유산균이 고지방식이 유도 비만 마우스 모델에서 백색 지방조직 증가에 미치는 영향을 평가하기 위해 주요 지방조직을 적출하여 무게를 측정하였다(Table 3). 고지방식이를 7주간 섭취한 HF군은 NC군보다 부고환 지방 2.69배, 신장지방 2.50배, 복막하지방 3.57배, 내장지방 2.04배, 피하지방 2.42배 유의적으로 증가하였다(P < 0.001). 고지방식이는 지방산 흡수를 증가시키고, 지방합성 결과로 지방세포 증식과 비대증이 나타난다. Boqué et al.(2009)는 고지방식이를 섭취한 Wistar rat의 피하지방에서는 지방 세포수가 증가하였고, 내장지방에서는 지방세포가 비대해졌다고 보고하였다. L-14 투여군에서는 고지방식이 섭취로 증가한 백색지방 조직량이 전체적으로 감소하였으며, ML군과 PH군에서는 모든 백색지방 조직량이 HF군보다 유의적으로 감소하였다.
Table 3.
Effect of L. plantarum L-14 on abdominal white adipose tissues in HFD-induced obese mice (mg/g bw)
| Group | Epididymal fat | Peri-renal fat | Retroperitoneal fat | Mesenteric fat | Inguinal fat |
| NC | 17.68 ± 5.92 | 1.88 ± 0.79 | 4.02 ± 1.35 | 6.34 ± 2.64 | 8.89 ± 3.38 |
| HF | 47.59 ± 6.83### | 4.71 ± 1.02### | 14.36 ± 2.58### | 12.90 ± 2.07### | 20.40 ± 6.89### |
| ML | 33.36 ± 5.86*** | 3.53 ± 0.91* | 10.70 ± 2.58** | 9.89 ± 1.12* | 13.00 ± 3.64** |
| MH | 43.26 ± 9.93 | 4.55 ± 0.82 | 12.13 ± 2.88 | 12.00 ± 2.51 | 17.87 ± 3.67 |
| PL | 46.62 ± 4.79 | 4.28 ± 0.99 | 14.69 ± 0.96 | 12.32 ± 1.69 | 17.52 ± 3.58 |
| PH | 30.33 ± 5.34*** | 3.02 ± 0.59** | 9.52 ± 1.91*** | 9.91 ± 1.40* | 11.65 ± 2.41*** |
혈액학적 분석
고지방식이와 L-14를 7주간 투여하였을 때, 비만으로 인한 간 기능 개선과 혈중 지질 변화를 Table 4에 나타내었다. 장기간 고지방식이를 섭취하면 신체의 스트레스와 간조직의 지방축적으로 간이 비대해지고 간 기능이 저하될 수 있다. 간세포가 손상되면 AST와 ALT가 혈액순환으로 유입되어 혈청효소가 증가한다(Purcell et al., 2013). HF군의 AST(144.75 ± 32.15 U/L)와 ALT(57.11 ± 13.22 U/L) 농도는 NC군에 비해 각각 1.41배(102.50 ± 38.57 U/L, P < 0.05), 2.59배(22.00 ± 7.77 U/L, P < 0.001) 유의적으로 증가하였다. L-14 배양액과 생균 투여는 고지방식이 섭취로 증가한 AST와 ALT 농도를 NC군의 수준으로까지 개선하는 효과를 나타내었다.
Table 4.
Effect of L. plantarum L-14 on plasma hepatotoxicity biomarker and plasma lipids in HFD-induced obese mice
| Group |
AST (U/L) |
ALT (U/L) |
Triglyceride (mg/dL) |
Total cholesterol (mg/dL) |
LDL-cholesterol (mg/dL) |
| NC | 102.50 ± 38.57 | 22.00 ± 7.77 | 67.50 ± 23.36 | 125.80 ± 7.63 | 20.20 ± 1.94 |
| HF | 144.75 ± 32.15# | 57.11 ± 13.22### | 121.29 ± 22.46### | 155.83 ± 18.09### | 27.17 ± 4.64# |
| ML | 99.38 ± 17.44** | 31.50 ± 6.27*** | 65.00 ± 24.30*** | 127.33 ± 9.18** | 17.29 ± 2.93*** |
| MH | 95.13 ± 19.53** | 29.63 ± 6.61*** | 61.40 ± 27.23*** | 135.33 ± 9.27* | 23.94 ± 5.11 |
| PL | 99.78 ± 12.23** | 27.63 ± 5.04*** | 58.88 ± 23.97*** | 134.50 ± 15.52* | 24.00 ± 3.54 |
| PH | 87.56 ± 18.19*** | 25.00 ± 8.49*** | 52.44 ± 16.42*** | 117.17 ± 10.21*** | 19.29 ± 3.70** |
HF군의 TG 농도는 121.29 ± 22.46 mg/dL로 NC군 67.50 ± 23.36 mg/dL보다 1.80배 현저히 증가하였으며(P < 0.001), TC와 LDL-C 농도도 NC군보다 각각 1.24배, 1.32배 유의적으로 증가하였다. 반면, L-14 투여는 고지방식이 섭취로 증가된 TG 농도를 NC군보다 낮은 수준으로 감소시켰고, TC 농도는 11.9-23.8%까지 현저하게 억제하였다. LDL-C 농도는 ML군과 PH군에서 HF군보다 유의적인 감소를 나타내었다. 식이성 비만모델에서 체중 증가는 혈중지질 이상증과 관련되어 심장질환의 위험성을 높이고 인슐린 저항성을 유발한다(Dixon et al., 2012). 최근 연구에서 프로바이오틱스의 지질대사는 단쇄 지방산 증가, 담즙산 합성 촉진, 콜레스테롤 분변 배설 등 다양한 메카니즘이 작용하는 것으로 보고되었다(Chao et al., 2021). Shao et al.(2017)은 장내 미생물 대사경로 분석에서 고지혈증 마우스에서는 2차 담즙산과 지질다당류 합성이 증가하였고, L. plantarum를 투여한 마우스에서는 LDL-콜레스테롤 형성이 억제되고, 중성지방과 콜레스테롤 분해를 촉진하는 pyrubate, glycerolipid, propionic acid 대사와 fatty acid 생합성이 증가하였다고 보고하였다. 본 연구 결과에서 L-14의 투여균수가 낮은 ML군이 L-14 균수가 많은 PH군과 비슷하게 혈중지질 농도 개선 효과를 보인 것은 배양액에 함유된 EPS나 단쇄 지방산 같은 미생물 대사체의 추가적인 작용에 의한 것으로 생각된다. 또한, 고지방식이 유도 비만 마우스에서 L-14 배양액과 생균 투여는 고지방식이 섭취로 인해 손상된 간기능을 회복시키고, 혈중지질 이상증을 효과적으로 개선하였다.
혈중 metabolic parameters
L-14 배양액과 생균 투여가 고지방식이 유도 비만 마우스의 혈중 glucose, insulin, 그리고, 에너지 항상성 유지에 관여하는 leptin과 adiponectin을 분석하여 Fig. 2에 나타내었다. HF군의 혈중 glucose 농도는 156.71 ± 71.70 mg/dL로 NC군 55.33 ± 8.29 mg/dL보다 2.83배 증가하였고(P < 0.001), L-14 투여군에서는 MH군을 제외하고 통계적으로 유의하게 혈중 glucose 상승을 억제하였다(Fig. 2A). Insulin 농도는 HF군이 0.92 ± 0.40 ng/mL로 NC군 0.44 ± 0.15 ng/mL보다 2.1배 현저히 증가하였으나(P < 0.001), L-14 투여는 고지방식이 섭취로 증가한 insulin 농도를 NC군과 비슷한 수준으로 개선시키는 효과를 나타내었다(Fig. 2B). 혈중 glucose와 insulin 분석에서 L-14 배양액과 생균 투여군간의 차이는 보이지 않았으며, L-14 균수도 크게 영향을 주지 않았다. 고지방식이로 장기간 고칼로리를 섭취하게 되면 인슐린 활성이 점차적으로 저하되어 인슐린 저항성과 그에 따른 제2형 당뇨가 발생한다. 본 연구 결과는 고지방식이로 유도한 비만 마우스 모델에서 L. plantarum SKO-001(Choi et al., 2023)와 L. plantarum S9(Zhao et al., 2022) 투여 마우스에서 인슐린 농도가 감소한 결과와 일치하였다.
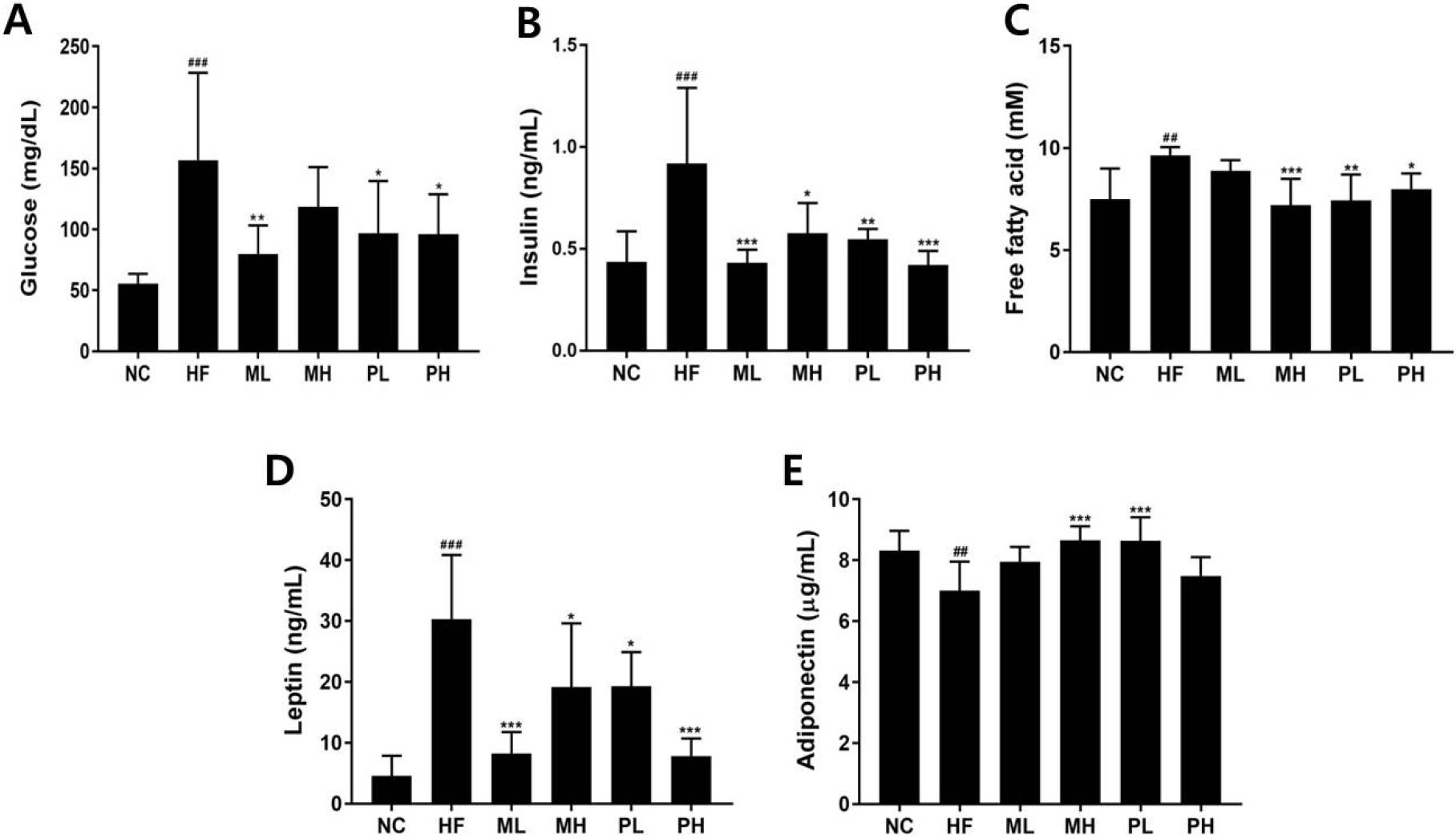
Fig. 2.
Effect of L. plantarum L-14 on blood metabolic parameters in HFD-induced obese mice. (A) Glucose, (B) Insulin, (C) Free fatty acid, (D) Leptin, (E) Adiponectin. NC, normal control; HF, HFD group; ML, HFD + 2.5 × 108 cfu of L-14 medium; MH, HFD + 5 × 108 cfu of L-14 medium; PL, HFD + 5 × 108 cfu of L-14 cells; PH, HFD + 2 × 109 cfu of L-14 cells. Data represent mean ± SD (n = 8). ##P < 0.01, ###P < 0.001 vs NC; *P < 0.05, **P < 0.01, ***P < 0.001 vs HF.
Free fatty acid 농도는 HF군이 9.64 ± 0.40 mM로 NC군 7.49 ± 1.51 mM보다 28.93% 증가하였고(P < 0.01), L-14 투여군에서는 ML군을 제외하고 Free fatty acid 농도가 유의적으로 감소하였다(Fig. 2C). Leptin 농도는 HF군이 30.32 ± 10.54 ng/mL로 NC군 4.54 ± 3.33 ng/mL보다 6.67배 증가하였다(P < 0.001). L-14는 고지방식이 섭취로 증가한 leptin 농도를 36.35-74.15% 감소시켰다. Adiponectin은 HF군이 7.00 ± 0.94 µg/mL로 NC군 8.32 ± 0.65 µg/mL보다 15.81% 유의적으로 감소하였다(P < 0.01). L-14 투여군에서는 adiponectin 농도가 HF군보다 증가하는 경향을 보였으며, MH군과 PL군에서는 통계적 유의성을 나타냈다(P < 0.001). Leptin은 에너지 과잉 섭취시 식욕억제를 위해 증가하는 물질로 지방세포에서 혈액으로 분비되며, leptin 분비량은 체내 지방량과 비례한다고 알려졌다(Neyrinck et al., 2021). Adiponectin은 근육과 간조직에서 인슐린 민감성을 향상시키고, 지방산 산화를 증가시켜 체중을 감소시킨다(Antoniades et al., 2009). 위의 결과를 통하여 볼 때, L-14는 비만 마우스의 혈중 leptin과 adiponectin 농도를 조절하여 인슐린 저항성을 개선하고, 에너지 소비를 증가시켜 고지방식이 유도 비만 마우스에서 체지방 개선효과를 나타내었다.
간조직의 총 항산화능 및 조직염색
최근에는 발효식품에서 분리한 신규 L. plantarum 프로바이오틱스 소재의 자유라디컬 소거활성 뿐만 아니라, in vivo 실험을 통하여 항산화 관련 유전자 발현과 항산화 효소 활성이 규명되었다(Prete et al., 2020). 활성산소의 과잉생성은 심각한 산화적 스트레스를 발생시켜 산화적 손상을 초래할 수 있다. 간 조직액의 지질과산화물인 MDA와 총 항산화능을 측정하여 Fig. 3A-B에 나타내었다. 간조직의 MDA 농도는 HF군이 1.38 ± 0.40 µM로 NC군 0.55 ± 0.17 µM보다 2.52배 증가하였다(P < 0.001). L-14 투여는 간조직의 지질과산화물 생성을 현저히 억제하였으며, MDA 생성억제 효과는 PL군 > PH군 > MH군 > ML군 순으로 나타났다.
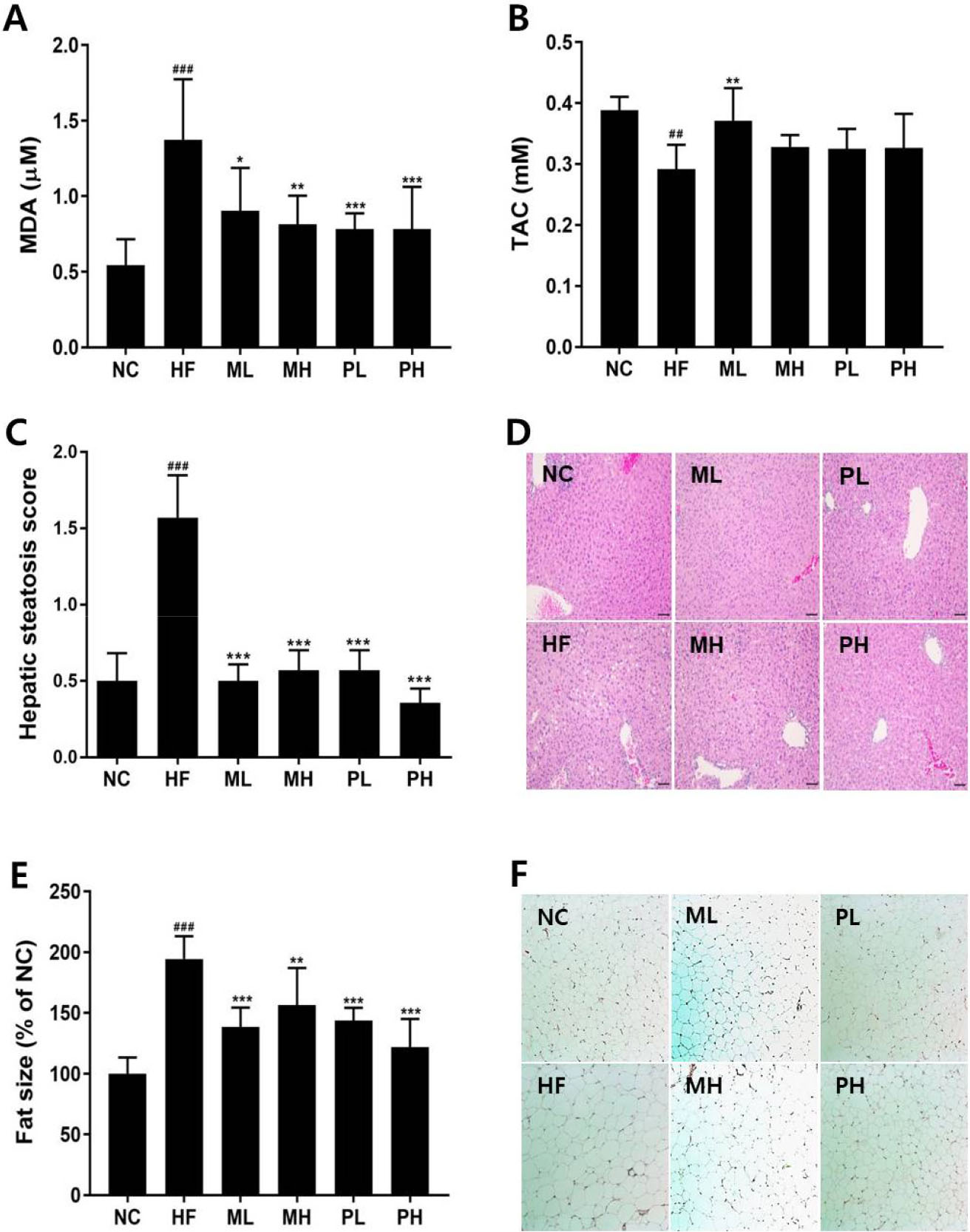
Fig. 3.
Effect of L. plantarum L-14 on antioxidant effect in liver homogenate and histological analysis of liver and adipose tissue with hematoxylin and eosin staining. (A) MDA levels, (B) TAC (Total antioxidant capacity), (C) Hepatic steatosis score, (D) Representative H&E staining of liver sections, (E) White adipose cell size of epididymal fat pad, (F) H&E staining of epididymal white adipose tissue. NC, normal control; HF, HFD group; ML, HFD + 2.5 × 108 cfu of L-14 medium; MH, HFD + 5 × 108 cfu of L-14 medium; PL, HFD + 5 × 108 cfu of L-14 cells; PH, HFD + 2 × 109 cfu of L-14 cells. Data represent mean ± SD (n = 8). ##P < 0.01, ###P < 0.001 vs NC; *P < 0.05, **P < 0.01, ***P < 0.001 vs HF.
총 항산화능은 NC군과 비교하였을 때, HF군에서 유의적으로 감소하였다(P < 0.01). L-14 투여군에서는 간조직의 총 항산화능이 HF군보다 증가하는 경향을 보였으나, ML군에서만 통계적으로 유의하였다(P < 0.01). 본 연구결과는 Song et al.(2016)이 비만 마우스에서 산화적 스트레스 수준과 지질과산화 생성물인 MDA가 현저히 증가하였다고 보고한 결과와 일치하였다.
간과 부고환 지방을 염색하여 조직 내 지방침착과 지방구 크기를 측정하였다(Fig. 3C-F). 5점 척도(50% 이상 지방침착)로 평가한 간 지방증 점수는 NC군이 0.5 ± 0.45로 지방침착이 5% 미만이었으며, HF군은 1.6 ± 0.73로 지방축적이 10-30% 미만의 지방간 증세를 나타내었다(Fig. 3C-D). L-14 투여군에서는 고지방식이 섭취로 인한 지방간증이 개선되어 간세포의 지방축적이 NC 수준으로 회복되었으며, L-14 배양액과 생균 처리군간의 차이는 보이지 않았다. 비만한 상태에서는 지방조직에서 분해된 유리지방산이 간으로 유입되어 중성지방으로 합성되고, 결국 간의 지방축적 초래하여 지방간을 형성한다(Klop et al., 2013).
고지방식이를 섭취한 비만 마우스에서는 체중증가와 지방축적으로 지방세포의 수와 크기가 증가하는데, 본 연구에서 HF군의 부고환 지방조직의 지방세포가 NC군보다 1.95배 비대해진 반면, L-14 투여군에서는 HF군보다 지방세포 크기가 각각 28.78%, 15.26%, 26.02%, 37.41% 유의적으로 감소하였다(Fig. 3E-F). 비만으로 인한 지방세포 비대증은 염증과 인슐린 저항성을 유발하는데, 본 연구에서 L-14 투여는 고지방식이로 유도한 비만 마우스의 지방세포 비대증을 억제하고, 에너지 대사를 자극함으로써 체지방 감소에 기여한다고 볼 수 있다.
결 론
본 연구는 L. plantarum L-14 유산균 배양액과 생균의 체지방 감소효능을 알아보기 위하여 고지방식이로 유도한 비만 마우스 모델을 활용하여 7주간 투여하였다. HF군은 NC군보다 체중과 백색지방 조직량이 유의적으로 증가하였다. 반면, L-14 유산균 투여군에서는 HF군과 비교하였을 때, 체중과 백색지방 조직량이 현저하게 감소하였다. 특히, L-14 생균 고농도 투여군인 PH군에서는 체중증가와 지방 조직량이 가장 크게 감소하였다. L-14 투여군에서는 고지방 식이 섭취로 증가한 ALT와 AST, 그리고 혈중 지질농도를 NC군 수준으로 회복하였으며, 혈중 glucose, insulin, leptin 상승을 억제하였고, adiponectin 농도를 증가시켰다. 또한, HF군에서는 지질과산화 생성물인 MDA가 현저히 증가하였으나, L-14 투여는 비만 마우스에서 간조직의 총 항산화능을 개선하여 지질과산화물 형성을 억제하였다. L-14는 고지방식이 섭취에 의한 지방간 형성과 부고환 지방조직의 지방세포 비대화를 억제하였다. 따라서, L. plantarum L-14는 고지방식이 유도 비만모델에서 체중증가, 간 손상, 인슐린 저항성 등을 개선하여 비만 및 만성 대사성 질환에 효과적인 소재임을 확인하였다. 그러나, 본 연구가 고지방 식이 비만 마우스의 체중변화와 혈액분석 결과 위주로 전개되어 체지방 감소 효능에 대한 작용기전 규명이 필요하다. 이를 위해 지질대사에 관여하는 주요 장기의 바이오마커를 분석함으로써, L-14의 체지방 감소 기능성소재 개발 가능성을 기대할 수 있다.




