서 론
재료 및 방법
식물재료
유리아미노산
항산화 물질 추출
총 플라보노이드 함량 분석
총 페놀화합물 함량 분석
항산화능 분석
통계처리
결과 및 고찰
유리아미노산
총플라보노이드
총폴리페놀
항산화 능력
항산화 활성과 항산화 물질 관계 분석
결 론
서 론
우리나라는 삼면이 바다로 둘러싸여 있고 간척지와 해안은 토양의 높은 염농도로 인하여 식물의 분포가 제한되는 독특한 지역이다(Yang, 1999). 특히 우리나라 해안 은 복원사업으로 조성된 간척지가 많고 염농도가 높아 식물 생육이 불리한 조건으로 현재까지 목본 조경수에 의한 녹화사업도 부진한 형편이다. 일반적으로 작물 생육한계 염농도가 0.3% 이하인 것을 고려할 때 대부분의 간척지 염농도가 0.1-2.5%로 큰 변이를 보이기 때문에, 내염성이 약한 초본성 조경식물의 식재는 현실적으로 불가능하고 일부 염생식물과 갈대 서식 외에 뚜렷한 대안이 없으므로 적합한 경관성 초본류의 연구가 절실히 필요하며(Lee et al., 2007; National Forest Science Academy, 2014) 따라서 염농도가 높은 간척지 토양에서도 안정적 생육이 가능한 식물의 선발은 매우 중요하다고 볼 수 있다.
퉁퉁마디, 나문재, 갈대, 갯조풀, 개미자리 등 약 40-100종의 다양한 염생식물이 해안염습지에서 자생하고 있으나 이는 단순히 간척지 특용자원으로 미미하게 재배되고 있을 뿐이며 토양조건이 불량한 간척지 등의 녹화대상지에서는 토양 적응성, 내건성, 내습성, 내염성 등이 녹화공사의 성패를 결정짓는 요인이 되므로, 경관녹화식물의 내환경 적응성에 관한 연구는 중요한 의미를 갖는다. 이러한 맥락에서 개정향풀(Apocynum lancifolium, Apocynum venetum)은 개펄 바닷가에서 자라는 식물로 “개”는 갯펄을 뜻하는 접두어로 맹아력이 강하고 내한성, 내염성 내공해성이 모두 강한 식물로 국립생물자원관 발간의 한국의 멸종위기 야생동·식물 적색자료집관속식물(An, 2012)에서는 취약(Vulnerable, VU) 110종의 하나로 분류된 자생식물이다. 개정향풀은 여러해살이풀로 높이 40-80 cm로 자라며, 가지는 가늘고 분백색으로 타원형 또는 피침형 잎이 원줄기에서는 엇갈려 달리나 가지에서는 서로 마주보며 달리고 자주색 꽃은 6월에 줄기 끝에 원추화서로 무리지어 피며 그 경관성이 매우 뛰어나다. 우리나라 서해안을 따라 남쪽에서부터 경기도에 이르는 지역에 생육하며, 내륙으로는 충북 단양에서도 분포한다고 알려져 있고 러시아, 몽골, 중앙아시아 등에까지 퍼져 분포하며 도로 또는 밭둑, 또는 갯벌 등 약간 습한 곳에서 잘 자라는 것으로 알려져 있다(Korea Forest Service National Arboretum, 2008; Son et al., 2011). 중국의 신강 , 내몽골 , 백두산 등에 자생하는 종은 나포마(羅布麻)로 불리며 오래 전부터 개화 전에 전초를 수확하고 음건하여 그 잎을 고혈압과 고지혈 치료용 차(茶)로 애용하는 약용작물로 재배해 왔다. 특히 flavonoid 등의 항산화 성분이 다량 함유되어 우울증 등의 치료에 도움이 되는 고부가가치 약용자원으로 알려져 있으며(Wenyan et al., 2012) 이 flavonoid는 polyphenol에 속하는 성분으로, 노란색 또는 담황색을 나타내는 phenol계 화합물의 총칭으로 꽃, 잎, 줄기 등 식물체의 모든 부위에 함유되어 있고, 항염증, 항바이러스, 항암 효과도 있는 것으로 보고되었다(Heim et al., 2002; Tsao, 2010). 이러한 다양한 약용적 가치와 기능성분을 함유한 개정향풀에 대하여 국내에서는 활성산소를 소거할 수 있는 항산화 물질의 탐색과 천연물질의 생리활성에 대한 연구가 미미하게 진행되고 있는 것에 비추어 볼 때(Park and Lee, 2021) 국내 자생종 개정향풀의 생리활성물질의 탐색은 매우 중요하며 더 나아가 염적응성이 높아 염생지에 적합한 경관자원식물로의 가능성도 기대되는 부분이다. 따라서 간척지 등 염생지에 적합 경관식물로 선발되기 위해서는 염농도 처리에 따른 내염성 및 내건성의 특성을 가진 식물들에게서 나타나는 대표적인 유리아미노산인 proline 성분 분석이 병행되어질 필요가 있다. 염생식물에 대한 유리아미노산 분석 연구들에서 대부분 식물체는 proline이 대량 함유되어 있다고 알려져 있는데 proline은 염생지에서 세포질성 삼투물질로 작용하는 것으로 보고되었으며 proline은 해안식물의 유리아미노산 풀(pool)에서 유의한 몫을 차지하지 않는 것으로 여겨진다고 하였다(Chu et al., 1999).
따라서 자생 개정향풀(A. lancifolium)을 간척지 등에 경관식물로 적용할 뿐만 아니라 그 수확물을 약용소득자원으로 활용하기 위해서는 개정향풀에 대한 다양한 염농도에 따른 유리아미노산 및 항산화 성분 변화에 대한 연구가 절실히 필요하며 이에 그 기초자료를 얻기 위해 이에 본 연구를 수행하였다.
재료 및 방법
식물재료
재료식물은 인천 영종도에서 2019년 10월 종자를 수집하여 이듬해 화성시 비봉면 포장에서 봄 파종 후 2020년 10월 종자를 다시 수확하고 2021년 2월 가온 온실(15 ± 5°C)에서 직경 6 cm 화분에 원예용상토(수분함량40 ± 10%, 용적밀도 0.3 mg/m3, pH 5.5-7.7, EC 0.6)를 넣어 3-5립 종자 파종 후 초장 5cm 이상 자란 식물을 골라 NaCl 0.00, 0.25, 0.50, 1.00, 그리고 2.00% 농도별로 10반복씩 처리하였다. 식재 토양으로 원예용상토를 사용한 것은 개정향풀이 기후 및 토양환경 적응범위가 매우 넓고 다양하며 척박한 생태지역에서의 서식이 우수하고 갯벌매립지도 생육이 가능하며 현재 갯벌에서도 서식이 발견되고 있어 특별히 염생지 생육조건에 적합한 토양선발 연구는 이 실험에서 고려하지 않고 실험이 용이한 원예용 상토를 사용하였다(Korea Forest Service National Arboretum, 2008; Son et al., 2011). 관수는 매일 1회로 하였고 관수 대신 주 2회 관수량 정도의 농도별 NaCl액을 두 달간 식물에 처리하였으며 약용가치가 주로 영양기관인 잎으로 알려져 있어 개화 전 단계에서 전초를 수확하여 -20°C 냉동고에 보관 및 분석에 사용하였다.
유리아미노산
NaCl의 농도별 처리에 따른 개정향풀의 유리아미노산 추출을 위한 전처리 과정은 샘플을 75% EtOH에 넣고 1시간동안 초음파추출 후 1시간 상온에서 지속적으로 흔들어 주었다. 이후 0.2 um pore size의 membrane filter로 필터 후 분석에 이용하였다. HPLC기기는 Dionex Ultimate 3000(USA)와 Column은 Inno C18 column(4.6 mm × 150 mm, 5 um / Younjin biochrom, Korea)를 이용하여 분석하였다(Table 1). 표준품은 1 nmol/uL Amino acids 17종(0.1N-HCL 용해농도 1000, 500, 100, 10 pmol/uL, 3차 증류수로 희석하여 만듬)으로 하였다. Pre Amino acids반응이 자동 수행되며 적은 양의 Borate buffer, OPA/MPA, FMOC 시약과 함께 시료를 단계적으로 혼합한 후 반응을 종결하였다. 시약은 Amino acid standard(agilent 5061-3330, agilent 5062-2478), Borate buffer(agilent 5061-3339), OPA reagent(agilent 5061-3335), FMOC solution(agilent 5061-3337), Na2HPO4, Na2B4O7(Sigma), MeOH(Merck)를 사용하였다.
Table 1.
HPLC operating conditions for the determination of amino acid content.
항산화 물질 추출
항산화물질을 알아보기 위해 식물 샘플 일정량을 취해 80% MeOH로 homogenizing하고 60분간 방치 후 60분간 흔들어 준 뒤 얻어진 추출물을 Whatman #2 여과지에 여과하였다. 회전농축기(N-1000, Eyela, Tokyo, Japan)를 이용하여 농축 시켜준 후, 농축이 완료된 추출물은 1 mL씩 분주하여, -4°C 이하에서 보관하였으며 DPPH radical cation과 flavonoid 함량, total phenol량의 측정에 이용하였다.
표준시료를 농도별로 측정하여 나온 값에 blank를 측정하여 나온 값을 뺀 후 의 값으로 일차방정식을 그리고 일차방정식에 시료측정값에 blank를 뺀 값을 적용시켜 정량값을 구하였다. 사용기기는 Thermo Biomate 5 UV-Visible Spectrophotometer(Thermo, USA)를 실험에 이용하였다. 표준검량곡선 모형이 주어진 분석에 적합한 정도를 재는 척도인 결정계수(coefficient of determination ) R²는 0.99 이상의 값이 되는 것으로 하였다.
총 플라보노이드 함량 분석
Flavonoid 함량의 측정은 1 mL 증류수에 200uL 표준시료를 넣고 5% NaNO2 50 uL 넣어 6분 가량 방치 후 10% AlCl3·6H2O 150 uL 넣고 다시 5분 후 1 M NaOH 0.5 mL 넣어 즉시 510 nm에서 흡광도를 측정하였다. 표준원액은 (+)—catechin을 사용하였고 분석물질의 정량 단위는 mg/kg CE(catechin equivalent)로 표기하였다(Shwetha et al. 2011).
총 페놀화합물 함량 분석
Phenol 함량의 분석은 0.5 ml 3차 증류수에 100 uL 표준시료를 넣고 Folin-Ciocalteu(발색제)를 100 uL 넣은 후 7% carbonate 용액을 1 mL 추가하여 상온에서 30분간 방치 후 760 nm에서 흡광도를 측정하였다. 표준용액은 gallic acid를 사용하였고 단위는 mg/kg GAE(gallic acid equivalent)로 표기하였으며 사용기기는 위의 분석에 이용된 동일한 기기를 사용하였다(Singleton et al., 1999). 이때 표준검량곡선은 표준물질로 gallic acid를 사용하여 동일한 방법으로 작성된 표준곡선으로부터 총 polyphenol 함량으로 환산하였다.
항산화능 분석
DPPH radical cation 측정을 위해 DPPH 시약을 100% methanol로 용해시킨 50 ppm에 시료를 추출하여 0.25 mL의 양을 10초간 votexing 후 30분간 암소(30°C)에서 방치하여 반응 후 Thermo Biomate 5 UV-Visible Spectrophotometer(Thermo, USA) 517 nm에서 흡광도를 측정하였다. 표준용액은 vitamin C(ascorbic acid)를 대조군으로 사용하였고 단위는 mg/kg AAE(ascorbic acid equivalent)로 표기하였다(Sadhu et al., 2003).
통계처리
본 실험의 결과 자료는 유리아미노산 분석을 제외하고 모든 분석은 3회 반복 측정하여 얻은 결과를 평균 ± 표준편차로 나타내었으며 통계적 분석은 SPSS WIN Program(Version 12.0)을 이용한 일원배치분산분석을 하였고 사후검정은 Duncan's multiple range test p < 0.05 수준에서 통계적 유의성을 검정하였다.
결과 및 고찰
유리아미노산
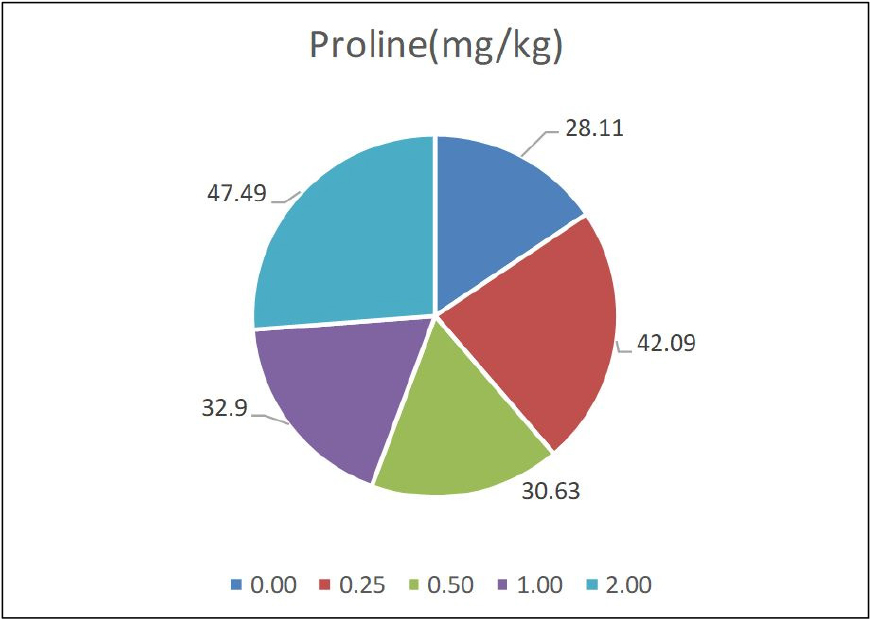
NaCl처리를 통한 개정향풀 전초에서(Fig. 1) aspartic acid, glutamic acid, asparagine, serine, glutamine, histidine, glycine, threonine, citrulline, arginine, alanine, GABA(gamma-aminobutyric acid), tyrosine, valine, methionine, tryptophane, phenylalanine, isoleucine, leucine, lysine, proline 총 21개 성분이 분석되었다(Table 2). 이 성분 중 모든 염농도 처리구에서 glutamine 또는 arginine 성분이 가장 많이 함유된 것으로 나타났다. 대조구와 0.25, 2.0 NaCl 처리농도(%)에서는 glutamine의 양이 가장 많았고 그 양은 555.95, 1338.91, 3138.43 mg/kg이었다. 반면에 0.5%와 1.0% 농도에는 arginine성분이 3434.9, 850.65 mg/kg으로 각각의 농도 처리에서 54.02%와 26.81%를 차지하였고 glutamic acid포함한 glutamine함량도 26.05%, 37.02%로 두 번째로 많아 전반적으로 모든 처리구에서 glutamine과 arginine성분 함량이 많이 분석되었다.
Table 2.
Integration of amino acid and each amount (mg/kg)
|
Integration (mg/kg) | % of NaCl concentration | ||||
| Control | 0.25 | 0.50 | 1.00 | 2.00 | |
| Aspartic acid | 183.74 | 196.40 | 185.14 | 171.88 | 211.78 |
| Glutamic acid | 385.53 | 626.28 | 452.90 | 400.77 | 535.43 |
| Asparagine | 57.03 | 353.10 | 164.21 | 91.96 | 369.15 |
| Serine | 56.58 | 91.00 | 61.77 | 69.12 | 131.45 |
| Glutamine | 555.95 | 1338.91 | 1203.73 | 773.98 | 3138.43 |
| Histidine | 12.42 | 33.92 | 67.74 | 37.14 | 57.09 |
| Glycine | 5.24 | 7.47 | 6.00 | 5.40 | 8.62 |
| Threonine | 41.93 | 69.02 | 48.20 | 70.92 | 85.95 |
| Citrulline | 14.63 | 18.08 | 65.34 | 44.31 | 90.30 |
| Arginine | 317.55 | 763.87 | 3434.92 | 850.65 | 1912.53 |
| Alanine | 242.12 | 232.34 | 201.35 | 160.96 | 271.02 |
| GABA1) | 160.25 | 138.34 | 126.57 | 141.61 | 201.21 |
| Tyrosine | 20.42 | 27.49 | 26.60 | 26.44 | 23.15 |
| Valine | 29.33 | 65.75 | 33.78 | 68.95 | 79.27 |
| Methionine | 3.52 | 9.23 | 4.46 | 8.01 | 7.18 |
| Tryptophane | 25.54 | 61.46 | 70.94 | 72.19 | 66.58 |
| Phenylalanine | 20.46 | 34.65 | 20.06 | 26.81 | 31.35 |
| Isoleucine | 13.92 | 36.46 | 17.68 | 35.34 | 38.04 |
| Leucine | 14.25 | 29.54 | 17.66 | 29.60 | 34.42 |
| Lysine | 30.42 | 60.10 | 119.23 | 53.83 | 88.50 |
| Proline | 28.11 | 42.09 | 30.63 | 32.90 | 47.49 |
| SUM | 2218.94 | 4235.50 | 6358.91 | 3172.77 | 7428.94 |
유리아미노산은 아미노산끼리 peptide 결합하거나 다른 분자와의 사이에서 ester결합 등을 하지 않는 유리상태의 아미노산으로 녹차 잎에는 theanine, glutamic acid, aspartic acid, anginine, serine 등이 많고 개정향풀의 유리아미노산 성분 중 주요 아미노산은 glutamic acid, aspartic acid, asparagine 성분 등이 분석되어 녹차의 성분과 유사한 그 약용적 가치를 뒷받침하고 있다. 이상의 결과에서 대조구와 저농도의 0.25%, 고농도 2.0% NaCl처리에서 glutamine 성분이 전체 유리아마노산 중 가장 높았으나 이는 특히 고농도 NaCl 처리구에서 많은 양의 glutamine이 정량되었다. 또한 arginine의 경우 0.5% 처리에서 3434.9 mg/kg으로 정량되어 모든 NaCl처리의 아미노산 분석 정량 중 가장 많은 양의 결과를 보였다. 전체 유리아미노산의 총량의 경우는 2.0% > 0.5% > 0.25% > 1.0% > 대조구 순의 결과를 보였고(Table 1) 특히 2.0% 고농도 NaCl처리의 7428.94 mg/kg 값은 대조구 2218.94 mg/kg의 약 3.4배 이상 높았다.
Glutamine의 약효는 근손실을 막아주고 뇌 건강에 도움을 주며 면역력 증가와 우울증 개선 등의 효과가 알려진 물질이며 glutamic acid 등은 포유류의 중추 신경계에서 가장 일반적으로 쓰이는 신경 전달 물질 중 하나이다. 또한 GABA(gamma-aminobutyric acid)는 뇌척수액(cerebrospinal fluid, CSF)에 포함된 중추신경계의 중요한 억제성 신경전달물질로, 뇌의 대사와 순환 촉진작용을 하는 물질로 알려져 있는데 이는 개정향풀의 전초가 뇌활성 및 면역력 증가와 우울증 개선 등의 효과를 입증하는 것이라 할 수 있으며 특히 glutamine, n-3 지방산, arginine 및 다양한 항산화제라고 보고된 바에 근거한다고 볼 수 있다(Jung and Cho, 2013).
NaCl을 처리하였을 때 벼의 잎과 뿌리에서 proline을 포함한 아미노산 함량은 내염성 품종의 잎에서 proline 함량은 더 많이 축적되었으며 aminobutyric acid, aminoapidic acid, alanine, serine, isoleucine, leucine, phenylalanine, tyrosine 및 valine 등의 아미노산 함량은 내염성이 낮은 품종에서 더 높은 함량을 보였다고 보고되었으며(Sin et al., 2004) 본 연구에서도 NaCl 처리농도가 가장 높을 때 proline 함량이 47.49 mg/kg으로 나타났고 대조구의 경우 가장 낮았으며 0.25%의 농도에서 두 번째로 높은 42.09 mg/kg의 proline 함량을 보여 개정향풀의 내염성을 확인 할 수 있었다(Fig. 2). 또한 alanine, serine, leucine, phenylalanine, tyrosine 및 valine의 경우는 Sin et al.(2004)의 보고에서 내염성이 낮은 품종에서 더 높은 함량을 보였다면 염처리를 하지 않는 대조구의 경우는 상대적으로 그 함량이 적게 나왔는데 이는 대조구 기준만으로 볼 때 개정향풀의 내염성을 반증한다고 할 수 있다. 우리나라 서해안 자생 내염성식물 proline 함량은 Cl 함량 간 상호반비례 하는 경향을 나타냈고 갈대는 높은 proline 함유와 낮은 Cl 함유 식물로 proline 함량은 염처리 농도에 비례 증가하였는데 이는 개정향풀의 경우도 비슷한 결과를 나타내었다(Jo, 1977). Proline 함량은 높은 염농도에서 자라는 식물이 낮은 수분포텐셜을 나타내는 토양에서 수분을 흡수하기 위해서는 토양보다 더 낮은 수분포텐셜을 가져야하므로 체내에 유기용질이나 무기용질 등을 축적하게 되며 이중에서 proline은 식물이 염스트레스와 수분스트레스를 받을 때 증가하는 아미노산의 일종으로 많은 연구자들에 의해 구명되었고(Kim et al., 2019), 염생식물인 나문재, 해홍나물, 퉁퉁마디에서 염처리구가 대조구에 비해 급격한 proline 함량의 증가가 측정되었으며(Lee et al., 1998; Nam et al., 2007) 본 실험에서도 처리농도가 높아질수록 함량이 증가됨을 보여 기존의 보고와 동일한 경향을 나타냈다. 이들 식물들에서 체내 방어기작으로 proline합성이 증가하여 수분포텐셜을 조절하는 삼투조절제로 작용하는 것으로 사료된다(Binzel et al.,1985).
총플라보노이드
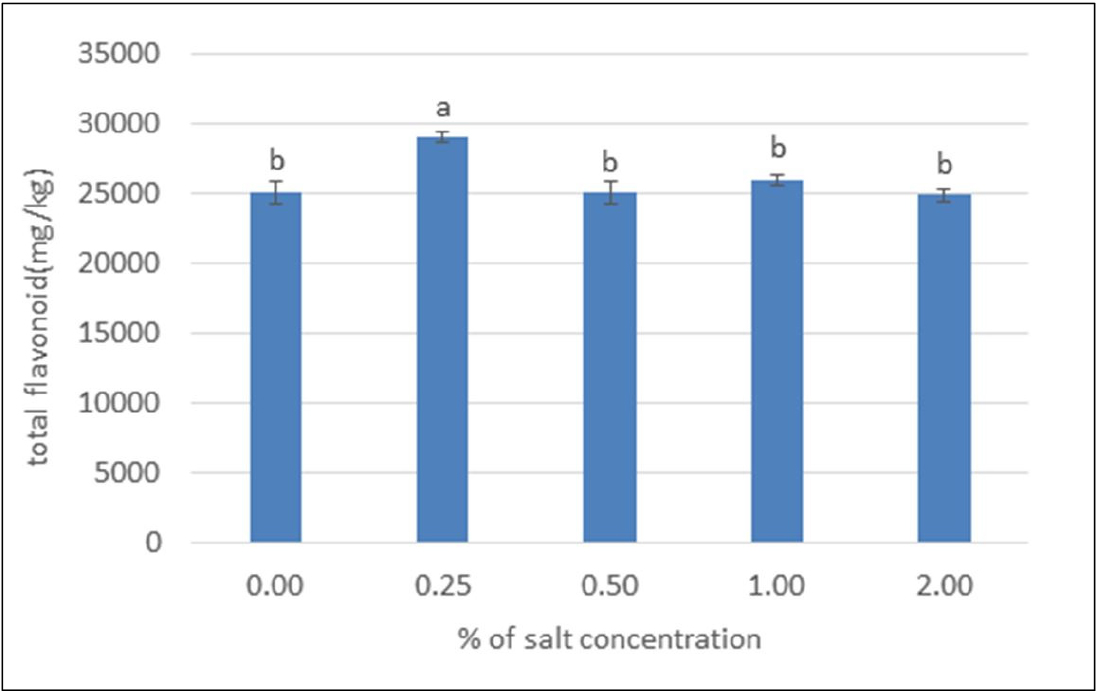
항산화 물질 탐색 및 분석에서 표준원액은 (+)—catechin를 사용하여 표준검량곡선 함수식(y = 0.0008x + 0.0363) 및 결정계수 R²(0.9937)로 플라보노이드를 분석한 결과 총플라보노이드(catechin equivalent)의 경우 0.25% 농도에서 29034.17 ± 398.40 mg CE/kg 로 가장 높게 나타났으며 2.00% NaCl처리에서 24890.00 ± 410.04 mg CE/kg 로 가장 낮았으며(Fig. 3) 0.25% 농도 처리구는 대조구와 0.50-2.00% 농도의 NaCl처리에 대해 유의적인 차이를 보였다(p < 0.05). 녹차 등에 함유되어 있는 catechin 화합물로 알려진 flavonol인 polyphenol류가 보고되었고, 플라보노이드는 페놀류에서 가장 중요한 화합물로 유리기를 제거하거나, 유리기의 연쇄반응을 중지시키는 강력한 항산화 능력의 기전을 통해 심혈관계 질환과 암 발생의 위험을 감소하는 작용 등이 연구되었다(Jia et al., 1999; Hong and Ahn, 2005).
총폴리페놀
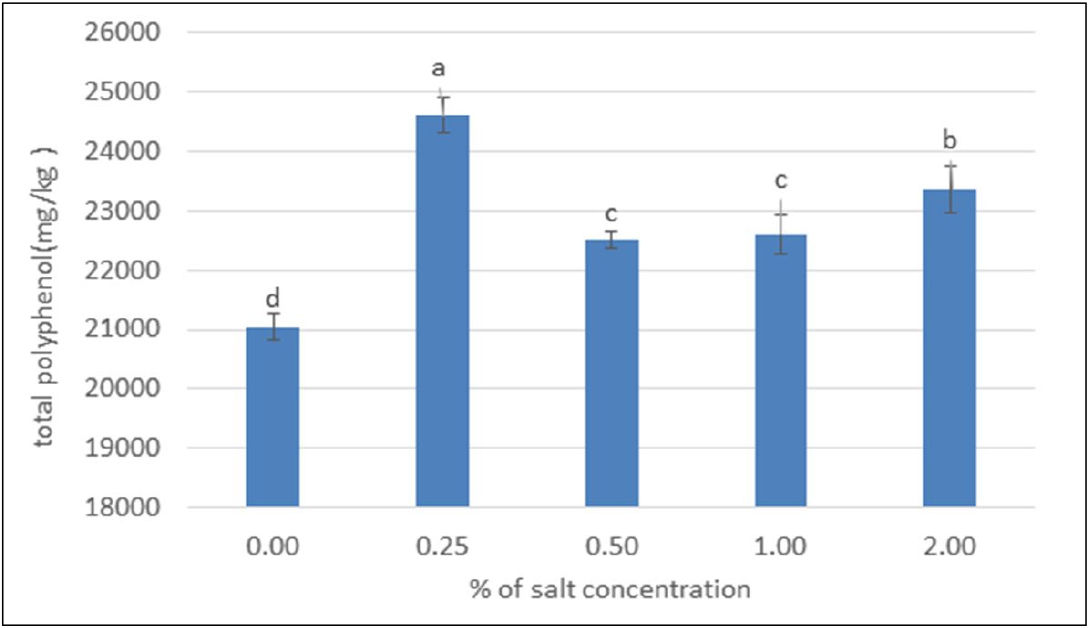
총폴리페놀의 경우 표준원액은 gallic acid를 사용하여 표준검량곡선 함수식(y = 0.0033x - 0.0323) 및 결정계수 R²(0.9998)로 분석한 결과 총폴리페놀의 경우 대조구의 경우 21050.51 ± 210.93 mg GAE/kg로 나타났으며 0.25% 농도에서 24607.68 ± 301.69 mg GAE/kg로 가장 높게 나타났고 0.50%에서 22498.53 ± 139.02 mg GAE/kg, 1.00%처리에서 22617.37 ± 333.85 mg GAE/kg , 그리고 2.00% NaCl처리에서 23366.06 ± 383.84 mg GAE/kg 로 분석되었으며 따라서 모든 농도의 염처리구에 비해 대조구의 값이 가장 낮았다(Fig. 4). 대조구와 모든 염농도 처리구는 통계적 유의성을 보였다(p < 0.05). 일반적으로 총 페놀 화합물은 차로 이용되고 있는 다양한 꽃차(Jung and Cho, 2013)에서도 함유된 것으로 이는 개정향풀의 차로서의 유사한 가치를 뒷받침하며 염처리 시 대조구에 비해 높은 양이 분석되어 간척지 등의 고부가 가치 재배식물로도 기대가 된다.
항산화 능력
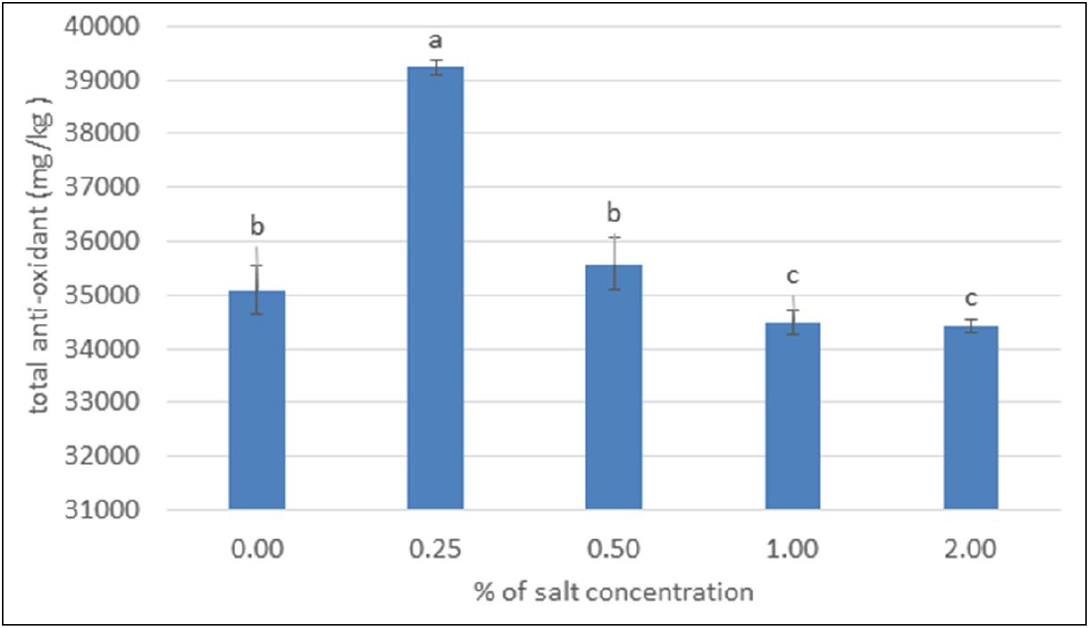
DPPH는 항산화 활성이 있는 물질과 결합하게 되면 전자를 내어주면서 radical 소모로 인하여 노란색으로 변하게 된다. DPPH는 안정한 free radical로 cysteine, glutathione과 같은 아미노산과 tocopherol, ascorbic acid 등의 항산화 물질에 의해 환원되어 탈색되므로 항산화 물질의 항산화능을 측정할 시, DPPH radical scavenging 측정법이 많이 이용되고 있다(Jang et al., 2007). 개정향풀의 DPPH radical 소거능을 측정한 결과, 총항산화능력(ascorbic acid equivalent)의 경우 표준원액은 ascorbic acid를 사용하여 표준검량곡선 함수식(y = -0.004x + 3.1861) 및 결정계수 R²(0.9997)로 분석한 결과 대조구의 경우 35098.33 ± 450.18 mg AAE/kg로 나타났으며 0.25% 농도에서 39231.67 ± 141.78 mg AAE/kg로 가장 높게 나타났고 2.00% NaCl처리에서 34428.33 ± 122.02 mg AAE/kg로 가장 낮았는데(Fig. 5) 이는 모든 염농도 처리 간에 유의적인 차이를 나타내었다(p < 0.05). 적당한 염 스트레스는 산화적 스트레스를 유발시켜서 활성 산소종을 증가시키고, 식물은 이를 제거하기 위한 항산화 방어 시스템을 가동시켜 항산화 효소나 항산화 물질들을 생성시킨다(Alscher et al., 2002)는 보고와 유사한 결과를 보였다.
항산화 활성과 항산화 물질 관계 분석
개정향풀의 항산화 능력과 항산화 물질 간의 상관관계를 분석한 결과 페놀과 플라보노이드 물질 모두 정의 상관관계는 염농도 0.00, 0.25% 처리에서 나타났으며 고농도의 염처리인 1.00%와 2.00%의 처리에서는 부의 상관관계를 보였다. 또한 가장 높은 상관관계는 0.25% 염처리에서 페놀물질 함량도 24607.68 mg GAE/kg로 가장 높게 나타났고 항산화능력 DPPH radical 소거능도 39231.67 mg AAE/kg로 가장 높게 나타났으며 전체 염처리와 가장 높은 0.968의 상관관계를 보였다(Table 3).
Table 3.
Correlation between antioxidant compounds and Apocynum lancifolium activities
Kim et al.(2014)의 연구에서는 일반적으로 시료에 함유된 총 페놀 화합물의 농도가 높을수록 free radical 소거능이 높은 것으로 나타났다. 꽃차의 항산화 물질과 항산화능의 상관관계 연구에서 총 안토시아닌, 총 플라보노이드, 총 페놀 화합물의 함량과 상관관계가 있다는 보고와 채소를 비롯한 원예 산물들의 항산화 물질과 항산화력 간의 상관관계는 일반적으로 높은 것으로 알려져 있다(Yang, 1999). Lee et al.(2009)의 연구에서는 감국, 산국 및 구절초꽃 차의 항산화 활성을 연구하여 페놀 화합물과 플라보노이드 물질을 발표하였고, Yang et al.(2017)은 심비디움 꽃과 잎 등 부위 별 항산화 물질과 항산화능 간의 상관관계 분석에 있어서 총 페놀 화합물과 총 안토시아닌 간의 정의 상관관계로 나타났으며, DPPH radical 소거능과 총 플라보노이드 간의 상관관계도 높게 나타났다고 보고하였다.
결 론
항산화 물질은 동ㆍ식물계에 널리 분포되어 있으며, 활성산소종의 작용을 억제하며(Block and Langseth, 1994) 폴리페놀은 flavonoids, anthocyanins, tannins, catechins, isoflavones, lignans, resveratrols 등의 총칭으로 폴리페놀에 존재하는 다수의 히드록실기(-OH)는 여러 화합물과 쉽게 결합하는 특성으로 항산화 및 항암, 항염 효과가 뛰어난 것으로 발표되었으며(Urquiaga and Leighton, 2000; Dai and Mumper, 2010), 플라보노이드(flavonoids)는 담황색을 나타내는 페놀계 화합물의 총칭으로 활성산소종을 효과적으로 제거하여 항산화능이 높다고 알려져 있으며 폴리페놀과 마찬가지로 항바이러스, 항염증, 항암 효과가 있는 것으로 알려져 있다(Heim et al., 2002; Williams et al., 2004; Taso, 2010).
항산화물질 분석은 일반적으로 추출용매 조건에 따라 차이가 있는데 부평초(Spirodela polyrhiza)의 페놀 및 플라보노이드 성분이 항산화 활성 측정을 하기 위해 페놀성분과 플라보노이드를 열수추출 또는 에탄올추출 하여 항산화 효과를 보고하였으며(Song and Choi, 2017), Lee et al.(2013)은 로즈마리의 최적 추출조건 으로 75% 메탄올 추출 시 총 페놀함량이 높은 수치를 나타내었고 항산화력이 검증되었는데 본 연구의 개정향풀의 페놀성분, 플라보노이드 성분 및 아스코르브산의 항산화 활성을 알아보기 위해 시료 추출은 메탄올로 진행하였으며 이후 추출방법 및 용매에 따른 항산화물질 탐색 연구가 계속 진행되어져야 할 것으로 생각된다. 또한 Kang et al.(2019)은 함유량이 다르기는 하였으나 간척지 재배 생산물에서 폴리페놀과 플라보노이드 함유량이 유의적으로 증가하고 있다는 결과는 본 연구에서 밝혀진 염분 농도에 따른 개정향풀 유리아미노산 및 항산화 함량 결과와 비슷한 맥락을 가진다. 특히 항산화 물질인 flavonoid 함량 CE(catechin equivalent), 총폴리페놀 GAE(gallic acid equivalent), 그리고 항산화활성 AAE(ascorbic acid equivalent)는 모두 0.25% NaCl농도에서 가장 높게 나타났으며 그 값은 각각 29034.17 mg CE/kg, 24607.68 mg GAE/kg, 그리고 39231.67 mg AAE/kg 함량으로 분석되었는데 이러한 결과는 개정향풀이 간척지 및 해안지역 등에 적합한 경관성 초본 내염성식물 이상으로 일반 토양보다 더 높은 항산화물질을 함유한 약용 소재로의 개발을 위한 기초자료로 유용하게 활용될 수 있을 것이다. 그 동안 퉁퉁마디, 해홍나물 등의 일부 염생식물은 염농도에 따른 생장스트레스에 관련된 연구, 염생식물 갯개미자리의 염스트레스에 대한 염농도에 따른 발아 및 생장 반응 등에 대한 연구를 통해 농가소득 고부가가치 자원식물로 미미하게 이용되어 왔으나(Lee et al., 1999; Nam et al., 2007) 개정향풀의 간척지 등의 염생지 식재를 통한 녹화경관의 효과를 높이고 또한 고부가가치 약용식물 생산에 크게 기여할 것으로 기대된다.