서 론
재료 및 방법
시험 물질 및 제조방법
세포 배양
세포 생존율(cell viability) 측정
Acetaminophen 유도 간세포 손상에 대한 시험 물질의 간세포 보호 효과 측정 - MTT assay
Acetaminophen 유도 간세포 손상에 대한 시험 물질의 간세포 보호 효과 측정 - LDH assay
Aspartate transaminase(AST) 및 alanine transaminase(ALT) 활성 측정
통계처리
결과 및 고찰
HepG2 세포의 세포 생존율에 미치는 영향
Acetaminophen 유도 간세포 손상에 대한 시험 물질의 간세포 보호 효과
LDH 활성에 미치는 영향
AST 및 ALT 활성에 미치는 영향
요약 및 결론
서 론
최근 현대인들의 불규칙한 식사, 서구화된 식습관, 스트레스 증가, 과도한 음주 및 흡연 등으로 인하여 비만, 당뇨, 고혈압, 암, 간질환 등과 같은 성인병 및 난치성 질환이 증가하고 있다. 특히 대한민국은 40대 남성의 간질환 관련 사망률이 OECD 국가 중 상위에 있고, 국내 비만, 당뇨 등 대사성 질환의 급격한 증가와 함께, 간질환 유병률이 급격히 증가하는 추세이다. 특히 간질환은 산화적 스트레스(Oxidative stress), 바이러스성 간염(Viral hepatitis), 알코올성(Alcoholic liver disease) 및 약물성 간손상(Drug-induced liver injury)의 원인으로 염증반응이 증가되어(Williams and Ding, 2020; Zhou et al., 2019; Cahill et al., 2002; Hoofnagle and Björnsson, 2019) 급성 간염이 유발되고, 더 나아가 만성화에 따른 간섬유화(liver fibrosis), 간경변증(liver cirrhosis), 간암(liver cancer)으로 진전되어 사망에 이르게 된다(Shojaie et al., 2020).
현재 간질환 치료에 있어 염증 반응에 의한 진행성 간질환을 동반하는 환자에게 장기간 예방적 치료제(antibiotic prophylaxis, antiviral treatment, anti-fibrotic candidate agent) 처치(Bajaj, 2019; Roehlen et al., 2020) 및 수술적 치료(간절제, 간이식 등)가 시행되고 있으나(Lee, 2005) 완벽한 치료제가 없는 상황이다. 이에 많은 연구자들에 의해 간질환 치료에 부작용이 없고 인체에 부담을 주지 않는 천연재료(생약재)을 활용한 연구가 진행되고 있다(Madrigal-Santillán et al., 2014). 더욱이 예방차원의 간 관련 건강보조식품 개발에 대한 현대인들의 수요 및 선호도가 증가하고 있으나 현재의 수요에 맞는 선택적, 영양학적 그리고 약리학적 효과 개선에 대한 연구가 필요한 실정이다.
본 연구에서 사용되는 복령(Wolfiporia extensa)은 구멍장이버섯과에 속하는 담자균류 버섯으로서 복령추출물을 이용한 수면유도작용, 항암, 항산화, 항염증, 항당뇨, 이뇨작용 개선 등이 보고되었다(Liu et al., 2020a; Jiang and Fan, 2020; Tian et al., 2019). 또한, 백출(Atractylodes Japonica)은 국화과에 속하는 삽주의 뿌리를 건조시킨 약재로 비만 억제와 당 소모 촉진 및 에너지 대사 조절 효과, 근육의 분화 및 발달, 항염, 항암, 항알러지, 관절염 개선 등의 다양한 효능이 알려졌다(Choi et al., 2009; Liu et al., 2020b; Han et al., 2012). 마지막으로 작약(Paeonia lactiflora)은 미나리아재비과의 쌍떡잎 식물로 Paeoniflorin, Paeonel, Paeonin, Tannin, β-sitosterol, triterpenoid, 정유, 지방유, 수지 등의 성분이 다량 함유되어 있어 작약 추출물을 활용한 항산화, 항염증, 진통 효과, 혈액 보강, 면역 강화, 비만억제 효능이 검증되었으며 우울증(Li et al., 2021), 염증성 대장염(Zhang et al., 2019b; Wu et al., 2019) 예방과 치료에 활용되며, 추출물을 이용한 피부건강 개선 관련 화장품 개발에 이용되고 있다(Kim et al., 2020). 그러나, 기능성 농식품자원정보서비스(생리활성 기능별 원료 정보, 농림축산식품부)에서 간건강 개선에 대한 효능은 작약(작약 뿌리 건분)에서만 보고되었다(Kim et al., 2008). 이에 본 연구에서는 다양한 효능을 지닌 복령, 백출, 작약의 단독 추출물 및 혼합 추출물을 활용하여 시험관 상에서 간세포의 보호 및 간건강 기능 인자의 변화를 확인하고 복령, 백출, 작약의 단독 추출물 및 혼합 추출물의 간건강 개선 효능을 검증하고자 한다.
재료 및 방법
시험 물질 및 제조방법
구운식품에서 제조하여 제공한 복령 주정 추출물(TD1), 백출 주정 추출물(TD2), 작약 주정 추출물(TD3) 및 복령, 백출, 작약 혼합추출물인 TD4-TD7은 복령, 백출, 작약 단독추출물을 다른 배율[TD4(복령:백출:작약, 1.0:1.0:1.0), TD5(복령:백출:작약, 2.0:0.5:0.5), TD6(복령:백출:작약, 0.5:0.5:2.0), TD7(복령:백출:작약, 0.5:2.0:0.5)]로 혼합하여 사용하였다.
시험물질의 제조방법은 100% 주정을 이용하여 50°C에서 3 시간 동안 추출한 후, 농축과정(50°C, 90 rpm) 및 동결건조를 통해 분말 형태로 만들고 정제수에 녹여 실험에 사용하였다.
세포 배양
인간의 간암세포에서 유래한 HepG2 세포는 American Type Culture Collection에서 구입하였고, Dulbecco’s Modified Eagle’s Medium(DMEM, Welgene)에 10% fetal bovine serum(FBS), 100 units/mL penicillin과 100 µg/mL streptomycin을 첨가한 세포 배양액을 사용하여 37°C 습윤한 CO2 배양기(5% CO2/95% air)에서 배양하였다. 세포가 배양 접시의 80% 정도 찼을 때, phosphate buffer saline(PBS, pH 7.4)으로 세포 단층을 씻어낸 후 trypsin-2.65 mM EDTA을 첨가하여 세포를 배양접시에서 떼어내 계대 배양하고 배지는 2일마다 교환하였다.
세포 생존율(cell viability) 측정
HepG2 세포를 5 × 104 cells/well이 되도록 48-well plate에 분주하고 24 시간 세포를 배양하였다. 세포를 24 시간 배양한 후, 각각의 시험 물질을 다양한 농도(0-1,000 µg/mL)가 포함된 세포배양액으로 교환하여 세포를 48 시간 배양한 후 MTT assay를 실시하여 살아있는 세포수를 측정하였다. MTT assay 방법은 미토콘드리아의 dehydrogenase가 MTT(Amresco, Inc.)를 환원시켜 푸른색 물질인 formazan을 만드는 원리에 기초하였으며, 세포생존율을 측정하기 위해 생성된 formazan을 isopropanol에 용해시킨 다음 570 nm의 파장에서 흡광도를 측정하였다
Acetaminophen 유도 간세포 손상에 대한 시험 물질의 간세포 보호 효과 측정 - MTT assay
간세포 보호 효과 확인은 간암세포주인 HepG2 세포를 활용하여 acetaminophen에 의해 유도된 간세포 손상에 복령, 백출, 작약추출물의 단독 및 혼합 추출물(TD1-TD7) 처리에 의한 간세포 보호 효과를 MTT assay 방법으로 평가하였다. HepG2 세포를 5 × 104 cells/well이 되도록 48-well plate에 분주하고 24 시간 세포를 배양한 후, 무혈청배지(serum-free medium: SFM)로 교환하여 세포를 2 시간 serum-starvation 하였다. 이후, 간세포 보호 효과를 측정하기위해 간세포 손상을 유도 물질인 acetaminophen(30 mM)과 TD1-TD7을 100 µg/mL 농도로 동시에 처리하여 4 시간 배양한 후, MTT assay 방법을 실시하여 살아있는 간세포 생존율을 측정하였다.
Acetaminophen 유도 간세포 손상에 대한 시험 물질의 간세포 보호 효과 측정 - LDH assay
간세포 보호효과를 확인하기 위한 방법으로 세포막 손상에 따라 배지로 유출된 젖산수소제거효소(lactate dehydrogenase, LDH)의 활성을 측정하는 LDH assay를 실시하여 acetaminophen에 의해 유도된 간세포 손상에 대한 복령, 백출, 작약추출물 단독 및 혼합 추출물(TD1-TD7)의 간세포 보호 효과를 평가하였다. 실험은 HepG2 세포를 2 × 105 cells/well이 되도록 96-well plate에 분주하고, 간세포 손상을 유도하기 위해 30 mM acetaminophen을 처리하였으며, TD1-TD7의 간세포 보호 효과 확인을 위하여 100 µg/mL 농도로 동시에 처리하여 4 시간 배양한 후, 세포배양액을 수거하여 세포 배양액 내의 LDH 활성을 Cytotoxicity Detection Kit PLUS(Sigma-aldrich, USA)를 사용하여 제조사에서 제시한 방법에 따라 측정하였다.
Aspartate transaminase(AST) 및 alanine transaminase(ALT) 활성 측정
HepG2 세포를 5 × 104 cells/well이 되도록 48-well plate에 분주하고 세포를 24 시간 배양한 후, 무혈청배지로 세포배양액을 교환하여 세포를 2 시간 serum-starvation 하고 30 mM acetaminophen와 100 µg/mL 농도로 각각의 시험 물질을 동시에 처리하여 4 시간 배양한다. 이후, 세포 배양액을 수거하여 AST 및 ALT 측정 kit(Asan Pharm Co., Ltd)을 사용하여 제조회사가 제시한 방법에 따라 AST 및 ALT 활성을 측정하였다.
통계처리
모든 분석 수치는 mean ± SEM으로 나타내었고, 수집된 결과는 GraphPad Prism 7.0(GraphPad software) 프로그램을 이용하여 분석하였다. 시험 물질 투여군과 대조군의 차이를 비교하기 위하여 one-way analysis of variance (ANOVA) 및 사후검정(Post-hoc test)을 이용하였고 p < 0.05 이상일 때만 통계적으로 유의성 있는 것으로 판단하였다.
결과 및 고찰
HepG2 세포의 세포 생존율에 미치는 영향
구운식품에서 제공한 복령 주정 추출물(TD1), 백출 주정 추출물(TD2), 작약 주정 추출물(TD3)의 단독 추출물과 복령, 백출, 작약 추출물의 혼합 추출물인 TD4, TD5, TD6, TD7의 세포 독성에 의한 증식 감소 관련 세포 활성에 영향을 배제하고 HepG2 세포의 세포 독성을 나타내지 않는 시험 물질의 처리 농도를 설정하고자, 7종의 시험 물질을 HepG2 세포에 다양한 농도(0-1,000 µg/mL)로 처리하여 세포를 48 시간 배양한 후 MTT assay를 실시하였으며, HepG2 세포의 생존율은 시험 물질을 처리하지 않은 대조군(0 µg/mL)에 대한 백분율로 표기하였다(Fig. 1). 결과 확인 시, 시험 물질을 처리하지 않은 대조군과 비교하여 TD1은 400 µg/mL 이상의 농도(82.8% ± 4.9)로 처리한 경우 세포 생존율이 유의적으로 감소하였으며(Fig. 1A), TD2은 200 µg/mL 이상의 농도(87.1% ± 3.7) 로 처리한 경우(Fig. 1B), TD3는 모든 처리 농도(0-1,000 µg/mL)에서 세포생존율에 영향을 주지 않음을 확인하였고(Fig. 1C), TD4는 600 µg/mL 이상의 농도(89.1% ± 4.4)로 처리한 경우(Fig. 1D), TD5은 200 µg/mL 이상의 농도(91.7% ± 1.5)로 처리한 경우(Fig. 1E), TD6은 200 µg/mL 이상의 농도(86.2% ± 1.1)로 처리한 경우(Fig. 1F), TD7은 400 µg/mL 이상의 농도(88.9% ± 0.2)로 처리한 경우 시험 물질을 처리하지 않은 대조군과 비교하여 세포 생존율이 유의적으로 감소하였다(Fig. 1G).
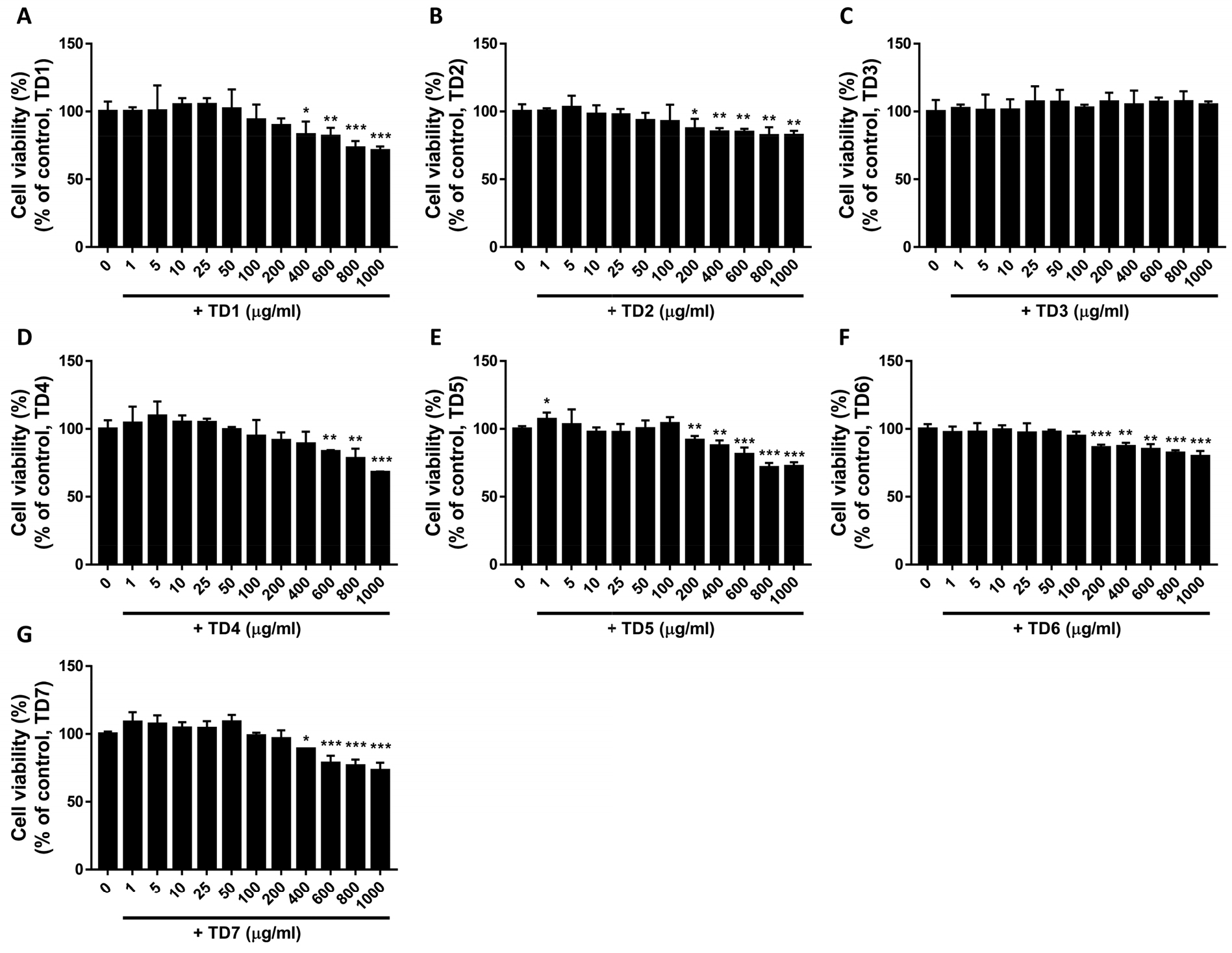
Fig. 1
Effect of Paeonia lactiflora (TD1), Wolfiporia extensa (TD2), Atractylodes japonica (TD3) extracts and their mixtures (TD4–TD7) on the viability of HepG2 cells. HepG2 cells were incubated with TD1–TD7 at the indicated concentrations (1–1000 µg/mL) for 48 h. Cell viability was assessed using the MTT assay. Statistical differences were determined using a one-way ANOVA test with Tukey’s post hoc test (n = 4, *p < 0.05; **p < 0.01; and ***p < 0.001).
하지만 시험물질처리에 의한 유의적인 세포생존율의 감소는 세포독성 평가기준(National Institute of Food and Drug Safety Evaluation (NIFDS), 2020)에서 명시한 세포독성에 의한 세포사멸 30% 미만이며, 세포질 내 과립 소실과 세포 형태의 변화는 관찰되지 않았다. 이에 실험에서는 HepG2세포에서 시험물질처리에 있어 7종의 시험 물질 모두에서 세포증식 및 생존율 감소에 영향을 주지 않는 0-100 µg/mL를 처리 농도로 설정하여 간기능 개선 효과를 확인하였다.
Acetaminophen 유도 간세포 손상에 대한 시험 물질의 간세포 보호 효과
아세트아미노펜(acetaminophen, (N-acetyl-p-aminophenol; APAP)은 paracetamol이라고도 하며 해열진통제로 널리 사용되는 약물이다. 특히 처방전 없이도 약국에서 쉽게 구할 수 있고 치료용량에서도 매우 안전하지만 과량으로 복용 시에는 간손상을 일으킬 수 있다고 보고되었다. 또한 간손상에 대한 in vitro(시험관) 실험모델로서 고농도의 APAP처리에 의한 간세포의 손상 유도 모델이 활용된 많은 연구가 진행되고 있다(Fisher and Curry, 2019; Jaeschke and Bajt, 2006). 따라서 본 연구에서는 인간 간암세포주인 HepG2 세포에 APAP 처리에 의해 유도된 간세포 손상에서 시험물질들의 간세포 보호 효과를 평가하기 위해 MTT assay를 실시하여 세포 생존율을 측정하였다. 그 결과, APAP 처리에 의한 간세포 손상 대조군(-, +Acetaminophen)에서 정상 대조군(-)에 비해 세포 생존율이 유의적으로 감소하였고, APAP 처리에 의해 간세포의 손상이 유도되었음을 알 수 있다. 또한, APAP을 처리한 간세포 손상 대조군(-, +Acetaminophen)과 시험 물질 처리군(TD1-TD7, +Acetaminophen)을 비교 시, 시험 물질인 TD3, TD4, TD5, TD6 처리군에서 세포생존율이 간세포 손상 대조군에 비해 유의적인 증가가 관찰되었다. 이는 TD3, TD4, TD5, TD6 처리가 간손상에 의한 세포사멸을 감소시키는 세포 보호 효과가 있음을 시사한다(Fig. 2).
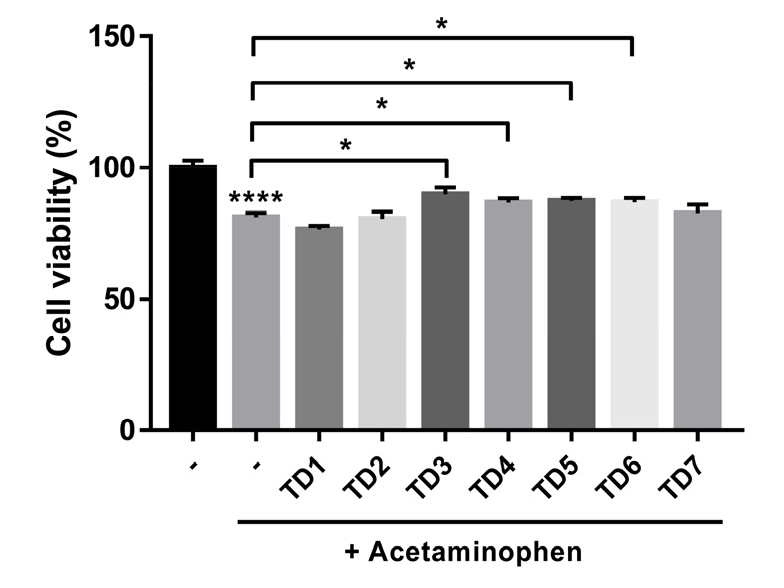
Fig. 2
Effect of TD1–TD7 on cell viability against acetaminophen (APAP)-induced cell toxicity in HepG2 cells. APAP-treated HepG2 cells were incubated with or without TD1–TD7 at a concentration of 100 µg/mL for 48 h. Cell viability was assessed using the MTT assay. The control group (–) represents the negative control while the positive control group, to which the APAP was added, represents the positive control for assessing cell viability. Different groups were compared with the positive control group. Statistical differences were determined using a one-way ANOVA test with Tukey’s post hoc test (n = 6, *p < 0.05; ****p < 0.0001).
LDH 활성에 미치는 영향
LDH(lactate dehydrogenase)는 세포질에 존재하며 체 내 당이 분해되어 에너지원으로 변환될 때 작용하는 효소이다. 특히 LDH는 세포 자극에 의해 세포막이 손상을 받을 시 세포 내 존재하는 LDH가 세포 외로 유출되어 세포배양액에서 증가하게 된다. 이러한 작용을 이용하여 많은 연구에서 세포의 손상에 의한 세포 외로 유출되는 LDH의 증가가 시험 물질 처리에 의해 감소됨을 측정하여 시험 물질의 세포보호능을 검증하는 방법으로 이용하고 있다(Fotakis and Timbrell, 2006). 이에 본 연구에서는 APAP에 의한 간세포에 손상이 있을 시, 배양액 내 LDH양이 증가하게 되고 간세포 손상에 대한 복령, 백출, 작약 단독 추출물 및 혼합 추출물의 간세포 보호 효과를 검증하기 위해 세포막 손상에 따라 배지로 유출된 LDH의 활성을 측정하였다(Fig. 3). 결과 확인 시, 간세포 손상 대조군(-, +Acetaminophen)이 APAP을 처리하지 않은 정상 대조군(-)보다 LDH 활성이 유의적으로 증가하였고, 시험 물질 처리군과 간세포 손상 대조군을 비교해 볼 때, TD7 처리군을 제외한 시험 물질 처리군(TD1-TD6)에서 LDH 활성이 유의적으로 감소하였다. 이는 APAP에 의해 유도된 간세포 손상에 TD1-TD6이 간세포 보호 효과가 있음을 제시한다(Fig. 3). 특히, APAP에 의해 유도된 간세포 손상에 대한 보호 효과를 세포 생존율과 LDH 활성으로 평가한 각각의 결과에서 공통적으로 TD3, TD4, TD5, TD6 처리군에서의 유의적인 간세포의 보호 효과를 확인하였다. 이는 TD3, TD4, TD5, TD6가 다른 시험 물질에 비해 APAP에 의해 유도된 간세포 손상에 대한 보호 효과가 높음을 제시한다(Fig. 2 and Fig. 3).
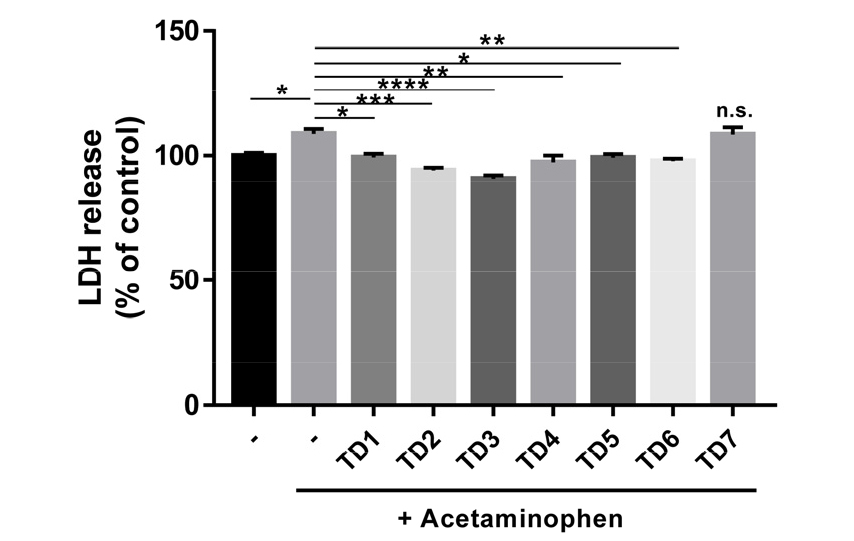
Fig. 3
Effect of TD1–TD7 on lactate dehydrogenase (LDH) release against acetaminophen (APAP)-induced cell toxicity in HepG2 cells. APAP-treated HepG2 cells were incubated with or without TD1–TD7 at a concentration of 100 µg/mL for 48 h. Cell viability was assessed using the LDH assay to analyze different groups (TD1–TD7). The control group (–) represents the negative control while the positive control group, to which the APAP was added, represents the positive control for assessing cell viability. Different groups were compared with the positive control group. Statistical differences were determined using a one-way ANOVA test with Tukey’s post hoc test (n = 6, *p < 0.05; **p < 0.01; ***p < 0.001; ****p < 0.0001; n.s.: not significant).
AST 및 ALT 활성에 미치는 영향
간기능 검사(Liver function test)는 간에서 생산 및 분비되거나 간손상에 의해 영향을 받는 효소나 단백질의 발현양을 측정하여 간손상 혹은 이상여부를 발견하고 평가하는 방법으로서(Hoekstra et al., 2013; Kim, 2009) 대표적으로 아스파테이트 아미노전이효소(Aspartate Aminotransferase, AST)와 알라닌 아미노전이효소(Alanine Aminotransferase, ALT)의 발현 변화가 이용된다. AST는 아미노산과 α-케토글루타르산과 옥살로아세테이트 사이의 반응을 매개하고 전이 반응을 촉매하는 효소이며, ALT는 글루탐산의 아미노기를 알라닌으로 전이 반응을 촉매하는 효소로 알려져 있다. 또한 이 두 효소는 대부분 간에 주로 분포하고 특히 다양한 요인에 의해 간손상이 유발될 때, 두 효소의 발현이 급격히 증가되는 수치를 간손상 지표로 활용하고 있다(Zhang et al., 2019a; Sheth et al., 1998).
이에 본 연구에서는 복령, 백출, 작약의 단독 및 혼합 추출물의 간손상 억제 효과를 확인하기 위해 APAP 및 시험 물질을 처리한 HepG2 세포의 세포배양액을 수거하여 세포가 분비한 AST와 ALT 활성을 측정하였다(Fig. 4). 결과 확인 시, AST 활성은 정상 대조군(-)과 비교할 때, APAP처리에 의한 간세포 손상 대조군(-, +Acetaminophen)에서 135.1% ± 23.7 증가가 관찰되었으며, 시험 물질을 처리하지 않은 간세포 손상 대조군과 시험 물질 처리군(TD1-TD7, +Acetaminophen)을 비교 시, 모든 시험군에서 간세포 손상 대조군에 비해 약하게 발현감소가 확인되었다(TD1:123.1% ± 6.7, TD2:106.8% ± 3.2, TD3:109.5% ± 0.7, TD4:108.9% ± 3.0, TD5:115.5% ± 3.3, TD6:128.5% ± 11.5, TD7: 132.7% ± 0.9). 또한 AST 활성과 마찬가지로 ALT 활성도 정상 대조군과 비교할 때 간세포 손상 대조군에서 증가를 확인하였고(140.5% ± 17.2), 흥미롭게도 시험 물질 처리군에서 간세포 손상 대조군에 비해 ALT 활성감소가(TD1:126.9% ± 23.5, TD2:118.2% ± 18.7, TD3:93.4% ± 9.9, TD4:92.0% ± 12.3, TD5:103.4% ± 5.7, TD6:106.8% ± 6.4, TD7: 129.2% ± 18.0) 관찰되었다(Fig. 4A and 4B). 위 결과를 통해 APAP 처리에 의해 유도된 간세포 손상이 AST 및 ALT 단백질의 발현 증가를 유도하며 복령, 백출, 작약의 단독 및 혼합 추출물을 처리에 의한 두 효소의 발현 감소는 간의 손상이나 이상 여부에 의해 증가된 이상반응에 대하여 간보호 및 기능개선 가능성을 기대할 수 있다.
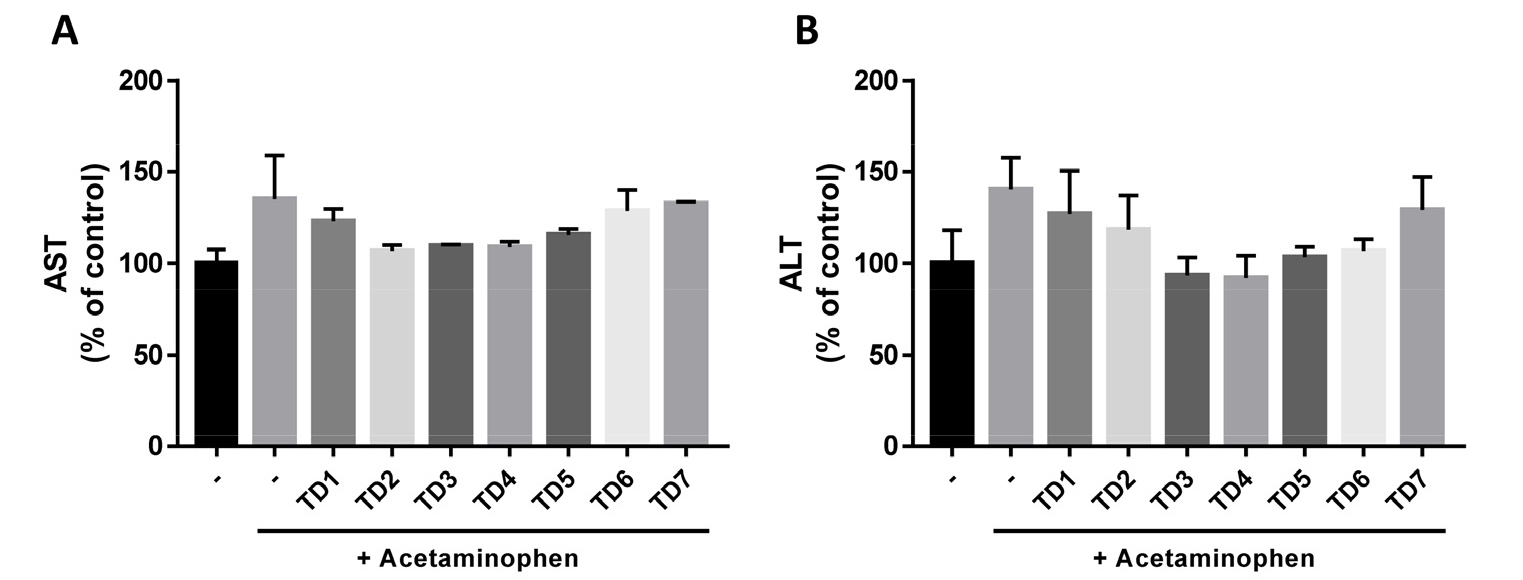
Fig. 4
Effect of TD1–TD7 on AST and ALT against acetaminophen (APAP)-induced cell toxicity in HepG2 cells. APAP-treated HepG2 cells were incubated with or without TD1–TD7 at a concentration of 100 µg/mL for 48 h; the cell culture media was then centrifuged at 3000 × g for 10 min to remove debris. Supernatants were collected and stored at -20 ºC until further use. (A) alanine aminotransferase (ALT) and (B) aspartate aminotransferase (AST) levels were measured using the colorimetric method. Statistical differences were determined using a one-way ANOVA test with Tukey’s post hoc test (n = 4).
모든 결과를 종합해 볼 때, 작약, 복령, 백출의 단독 및 혼합 추출물은 고농도의 APAP 처리에 의한 증가된 세포독성을 완화하였고, 간세포 보호능 및 간손상 억제 가능성을 제시하였다. 또한 현재 원료 표준화 공정을 통해 생산된 복령, 백출, 작약의 혼합 추출물 제품이 개발 진행 중이며, 위 결과는 간손상 치료제 및 간기능 개선을 위한 건강기능식품 개발에 기초자료로 활용될 것이라 사료된다.
요약 및 결론
본 연구는 시험관시험을 통하여 구운식품에서 제조하여 제공한 복령 주정 추출물(TD1), 백출 주정 추출물(TD2), 작약 주정 추출물(TD3), 복령, 백출, 작약의 혼합 추출물(TD4-TD7)을 시험 물질로 사용하여 간손상 억제 효능을 분석하였다. 실험에 앞서 복령, 백출 작약 주정추출물이 간세포 생존에 영향을 미치는지 확인하기 위하여 농도별로 인간 간암 세포주(HepG2)에 처리하여 실험에 사용한 7종의 시험 물질이 0-100 µg/mL 농도 범위에서 세포생존율에 영향이 없음을 확인하였다. 이에 실험에서 세포 생존율에 영향을 주지 않는 처리 농도를(100 µg/mL) 설정하여 실험을 진행하였다.
APAP의 첨가에 의한 간세포 손상에 있어 시험물질들의 간세포 보호 효능 확인 시 TD3, TD4, TD5, TD6 처리군에서 세포 생존율이 유의적으로 증가하였으며, 간세포막 손상에 따라 배지로 유출된 LDH의 활성 측정 시, TD7 처리군을 제외한 모든 처리군(TD1-TD6)에서 LDH 활성이 유의적으로 감소하였다. 또한 간손상 지표로 활용되는 AST 및 ALT 활성 변화 확인 시, 간세포 손상 대조군에 비하여 시험 물질 처리군에서 약하게 감소됨이 관찰되었다. 위 결과를 종합해 볼 때 복령, 백출, 작약의 단독 및 혼합 추출물은 간손상에 대한 보호 및 간손상 억제 가능성을 기대할 수 있으며, 간기능 개선 효과에 대한 건강기능식품개발의 기초자료로서 활용될 수 있을 것이라 사료된다.




