서 론
재료 및 방법
시료 및 추출물의 제조
실험재료
마우스 대식세포 RAW 264.7 세포의 배양
세포 독성 평가(Cell viability)
Nitric oxide 생성량 측정
염증성 사이토카인의 mRNA 발현 분석
염증성 인자의 생성량 분석
통계처리
결 과
MEC와 MERC가 RAW 264.7 세포 생존율에 미치는 영향
MEC와 MERC가 NO 생성과 iNOS의 mRNA발현에 미치는 영향
MEC와 MERC가 PGE2 생성과 COX-2의 mRNA 발현에 미치는 영향
MEC와 MERC가 염증성 사이토카인 발현에 미치는 영향
고찰 및 결론
서 론
염증(Inflammation)은 감염 및 상처 등의 외부자극에 의해 유도되는 과정으로 손상 부위를 복구시키는 역할을 하는 신체 방어기전 중 하나이다(Kim et al., 2018). 그러나 지속적 또는 과도한 염증은 통증, 발열을 동반하는 점막손상, 관절염, 암 등 다양한 만성 염증성 질환의 원인이 되므로 염증의 조절은 필수적이다(Cheon et al., 2009). 염증이 일어나게 되면 대식세포에서는 여러 가지 염증성 인자들이 만들어지게 되는데, 대표적인 염증성 인자로는 inducible nitric oxide synthase(iNOS)에 의해 만들어지는 nitric oxide(NO)와 cyclooxygenase-2(COX-2)에 의해서 만들어 지는 prostaglandin(PG) E2등이 있다(Park, 2017). NO는 고반응성 자유라디칼로 iNOS가 외부 스트레스나 염증성 사이토카인 등에 의해 자극을 받게 되면 다량 생성되어 염증반응의 매개체로 작용한다(Nam, 2020; Sou et al., 2009). COX-2에 의해 합성되는 PGE2는 PG중 가장 잘 알려져 있으며 혈관 확장, 부종, 발열, 통증 등을 유발하고 NO와 마찬가지로 염증반응의 매개체로써의 중요한 역할을 하고 있다(Ji et al., 2004). 내․외부적 자극에 의해 PGE2가 과도하게 생성되면 염증성 사이토카인을 방출하고, 패혈증과 같은 염증 증상 및 징후가 나타난다(Park et al., 2019).
NO와 PGE2의 과량생성은 interleukin(IL)-6, IL-1β와 같은 염증성 사이토카인의 과발현을 유도하여 유전자 변이, 조직 손상 등의 염증반응을 유발한다(McDaniel et al., 1996). 이러한 염증성 사이토카인들은 대식세포를 활성화시키고 다양한 염증성 인자의 유도 및 번역 조절에 중요한 역할을 하여 급성 및 만성 염증반응을 일으킨다(Kim and Kim, 2015). 그 중 IL-6는 B-cell을 자극하여 염증반응을 촉진하며 면역응답, 조혈계와 신경계 세포의 증식 및 분화 급성반응 등에 관여하고 이는 자가면역질환의 발생과 경과에 깊게 관련되어 있다(Lee and Chung, 1999). IL-1β는 혈관 내피에서 부착분자들의 발현을 촉진하고 호중구의 결합을 유도하여 손상을 유발한다(Jin et al., 2016). 또한 시냅스 활동 촉진 및 통증 전달, 만성 통증의 발달에 기여하므로 IL-1β의 억제를 통해 통증과 염증을 효과적으로 관리할 수 있다(Ren and Torres, 2009). 따라서 염증성 인자와 사이토카인을 조절하는 것은 염증 질환의 치료제 개발에 있어서 중요한 요소이며 항염증 소재 개발을 위한 중요한 타겟이 될 수 있다.
최근 산업의 발전으로 수명이 연장되고 생활수준이 향상됨에 따라 다양한 염증질환의 예방과 치료에 대한 요구가 급증하고 있다(Jung et al., 2021). 현재 만성 염증질환의 예방 및 치료를 위해 사용되는 항염증 제제는 장기간 복용할 경우 출혈성 소화관 궤양이나 혈전, 혈압 상승 등과 같은 소화기나 순환계 질환과 같은 부작용을 유발하는 등의 임상사례가 보고되고 있다(Boumpas et al., 1993; Hippeli and Elstner, 1999). 따라서 염증을 효과적으로 억제하고 부작용이 적은 성분의 탐색을 위해 다양한 약용 식물의 생리활성 물질을 찾고자 하는 연구가 활발하게 진행되고 있다(Lee and Cho, 2015).
토끼풀속(Trifolium)은 예로부터 민간요법으로 사용되어져 왔으며 꽃의 색에 따라 분류할 수 있다(Korea Beekeeping Association, 2007). 흰 꽃이 피는 토끼풀(Trifolium repens L., Clover)은 phenolic compound를 다량 함유하여 체내에서 여러가지 생리대사에 영향을 미치는 것으로 확인되었으며 말린 꽃과 잎은 천식, 감기, 해열에, 생잎은 지혈 및 염증 완화 효능이 있다고도 알려져 있다(Ahmad and Zeb, 2021; Lee et al., 2001). 하지만 토끼풀의 생리활성물질과 관련된 연구는 아직까지 부족한 실정이다. 붉은 꽃이 피는 붉은토끼풀(Trifolium pratense L., Red clover) 역시 다량의 phenolic compound를 포함하고 특히 isoflavonoid를 풍부하게 함유하여 뛰어난 항산화 효과를 가지는 것으로 확인되었다(Esmaeili, 2015). 최근에는 붉은토끼풀 유래 isoflavone을 이용한 갱년기 치료제가 시판중이며, 붉은토끼풀 유래 Biochanin-A가 matrix metalloproteinases(MMP)와 nuclear factor-κB(NF-κB)의 발현을 억제하는 것을 이용하여 퇴행성 관절염 치료제로의 개발 가능성을 확인하였다(Myers and Vigar, 2017; Wu et al., 2014). 또한, 붉은토끼풀에서 유래한 물질인 Pratol이 LPS로 유도된 RAW 264.7 세포에서 NO, PGE2 및 염증성 사이토카인의 생성을 억제하는 것으로 알려져 항염증제로서의 연구가 진행되고 있다(Chung et al., 2018). 그러나 과량의 붉은토끼풀은 혈액응고를 늦춰 출혈장애가 있는 경우 사용을 피해야 하며 붉은토끼풀의 생리활성물질이 호르몬과 동일한 수용체에 경쟁적으로 결합하기 때문에 호르몬 약물을 복용하는 환자들 역시 농도선택에 있어서 주의가 필요하다(Hatice et al., 2020; Karimpour-Reihan et al., 2018).
따라서 본 연구는 LPS로 염증이 유도된 마우스 대식세포 RAW 264.7 세포에서 토끼풀(Methanolic extract of clover, MEC)과 붉은토끼풀(Methanolic extract of red clover, MERC) 메탄올 추출물의 항염증 효과를 비교 분석하고 기능성 소재로의 활용 가능성을 확인하고자 하였다.
재료 및 방법
시료 및 추출물의 제조
토끼풀은 강원도 춘천시 신동면 증리에서, 붉은토끼풀은 강원도 양양군 양양읍에서 각각 채집하였다. 채집식물은 4°C 조건의 냉장고에 넣어 강원대학교 농업생명과학대학 천연향료실험실로 옮겨져 상온 상태에서 음건한 후 식물분쇄기(NANIL, Korea)를 이용하여 마쇄하였다. 마쇄한 토끼풀과 붉은토끼풀 1 kg을 취하여 삼각 플라스크에 넣고 메탄올 2 L에 24시간 침지시켰다(Lim et al., 2007). 메탄올 추출물을 여과시켜 여과액을 완전 농축한 다음, 증류수를 50 mL 첨가하였다. 플라스크 내의 건조물을 증류수를 이용하여 잘 용해시킨 다음 동결건조기(ILSHIN Lab Co. Ltd., Korea)를 이용하여 건조시킨 시료를 4°C의 냉장고에 보관하였다. 평가시에는 이 시료를 70% 에탄올에 녹여 사용하였다. 토끼풀과 붉은토끼풀의 수득률은 각각 6.76%, 1.05%이다.
실험재료
3-(4,5-Dimethylthiazol-2-yl)-2, 5-diphenyl tetrazolium bromide(MTT), lipopolysaccharide(LPS)는 Sigma-Aldrich Co.(St. Louis, MO, USA)에서, griess reagent는 promega(Madison, WI, USA)에서 구입하였다. Penicillin-streptomycin (P/S), Dulbecco’s modified Eagle’s medium(DMEM)는 Welgene(Gyeongsan, Korea)에서, fetal bovine serum(FBS)는 Atlas Biologicals(Fort Collins, CO, USA)에서 각각 구입하였다. RNA iso Plus는 Takara Bio Inc.(Kusatsu, Japan)에서 구입하였으며, iNOS, COX-2, IL-6, IL-1β, β-actin primer는 Integrated DNA Technologies(Caralville, LA, USA)에서 구입하였다. TransScript All in one first-strand cDNA synthesis SuperMix for qPCR은 TransGen Biotech Co.(Beijing, China)에서 구입하였다. Power SYBRⓇ Green PCR Master Mix는 Applied biosystem 제품을 Thermo Fisher Scientific (Rockford, IL, USA)에서 구입하였다. 이 외 기타 시약은 시중에서 구입할 수 있는 최상급을 사용하였다.
마우스 대식세포 RAW 264.7 세포의 배양
마우스 유래 대식세포 RAW 264.7 세포는 한국세포주은행(Korean Cell Line Bank, Korea)에서 구입하였다. 배지는 Dulbecco’s modified Eagle’s medium(DMEM)에 100 units/mL의 penicillin-streptomycin(P/S)과 10%의 fetal bovine serum(FBS)를 넣어 사용하였다. 이후 37°C, 5% CO2 조건의 incubator에서 배양하였으며, 2일에 한 번씩 계대 배양하였다.
세포 독성 평가(Cell viability)
RAW 264.7 세포(2 × 105 cells/well)를 96 well cell culture plate에 분주하여 37°C, 5% CO2 incubator에서 24시간 배양하였다. 배양액을 serum free medium으로 갈아주고 24시간 배양 후에, medium을 제거하고 농도별 추출물을 첨가한 medium 100 µL에서 배양하였다. 24시간 후, 5 mg/mL의 MTT 시약을 serum free medium과 1:9로 혼합하고 각 well에 100 µL씩 첨가하여 4시간 재배양하였다. 이후 medium을 제거하고 99.5% DMSO와 isopropanol을 1:1로 혼합하여 100 µL씩 첨가하여 세포를 용해시키고 SpectraMax 190 microplate reader(Molecular devices, San Jose, CA, USA)를 이용해 540 nm에서 흡광도를 측정하였다.
Nitric oxide 생성량 측정
RAW 264.7 세포(2 × 106 cells/well)를 6 well cell culture plate에 분주하여 37°C, 5% CO2 incubator에서 24시간 배양하였다. 배양액을 serum free medium으로 갈아주고 24시간 배양시킨 후 추출물을 농도별로 첨가하여 전처리하였다. 1시간 후에 LPS(1 µg/mL)를 대조군을 제외한 모든 well에 처리하여 24시간 재배양 하였다. 이후 세포 배양액의 상층액을 수거하여 griess reagent와 1:1로 혼합해 반응시킨 후 96 well plate에 200 µL씩 분주하고 microplate reader를 이용해 540 nm에서 흡광도를 측정하였다. 배양액 내의 NO 농도는 sodium nitrite(NaNO2)으로 표준곡선을 작성하고 측정한 흡광도 값을 대입하여 농도를 산출하였다. MEC와 MERC의 NO의 생성량 변화는 NO의 생성을 50% 억제하는 농도(50% Inhibitory concentration, IC50)을 산출하여 비교하였다.
염증성 사이토카인의 mRNA 발현 분석
상기와 같이 처리한 cell culture plate의 세포에 RNA iso Plus용액을 1 mL/well씩 넣어 세포를 용해시킨 후, 200 µL의 chloroform을 가하여 섞어준 뒤 4°C, 10,000 rpm에서 30분간 원심분리하였다. 상층액 400 µL를 취해 isopropanol과 1:1로 섞은 뒤 4°C, 12,000 rpm에서 10분간 원심분리하고 상층액을 제거하였다. 추출한 mRNA에 75% ethanol을 넣고 4°C, 10,000 rpm에서 5분간 원심분리하였다. 이를 완전히 건조시키고 pure water 50 µL씩 넣어 mRNA를 용해시키고 하루동안 냉장고에 보관한 뒤 사용하였다. mRNA는 microplate reader를 이용하여 정량한 뒤 TransScript All in one first-strand cDNA synthesis SuperMix for qPCR을 이용하여 20 µL cDNA로 합성하였다. 만들어진 cDNA는 pure water 180 µL에 희석하여 사용하였다.
cDNA 4 µL와 pure water 4.4 µL, Power SYBRⓇ Green PCR Master Mix 10 µL를 혼합하고 primer(iNOS, COX-2, IL-6, IL-1β, β-actin) 1.6 µL를 넣어 real time - polymerase chain reaction(RT-PCR)을 수행하였다. RT-PCR 조건은 최초 95°C에서 10분간 가열하고 95°C에서 15초, 57°C에서 20초, 72°C 40초인 cycle을 총 40회 반복 수행한 후 95°C에서 15초, 60°C에서 1분, 95°C에서 15초 1회 수행하였다(Yang et al., 2014). 각 primer의 sequence는 다음과 같다(Table 1). MEC와 MERC의 사이토카인 mRNA 생성량 변화는 IC50를 산출하여 비교하였다.
Table 1.
Primer sequences for RT-PCR analysis
염증성 인자의 생성량 분석
PGE2(R&D systems, Minneapolis, MN, USA)와 IL-1β, IL-6(invitrogen, Carlsbad, CA, USA)의 생성량을 정량하기 위해 ELISA kit를 이용하여 분석하였다. LPS에 의해 유도된 염증성 인자인 PGE2, IL-1β, IL-6 생성량은 배양액의 미립자와 응집체를 10,000 rpm으로 4°C에서 10분간 원심 분리하여 제거한 후 ELISA kit에 포함된 protocol에 따라 수행하였다. 추출물의 사이토카인 생성량 변화는 IC50를 산출하여 비교하였다.
통계처리
모든 측정값은 평균 ± 표준오차로 나타내었고, 대조군 및 실험군 간의 통계적 유의성 검증은 GraphPad Prism (Graphpad Software Inc.)를 통한 one way analysis of variance(ANOVA)를 사용해 확인한 후 Student-Newman-Keuls test에 의해 p < 0.05 수준에서 판단하였다.
결 과
MEC와 MERC가 RAW 264.7 세포 생존율에 미치는 영향
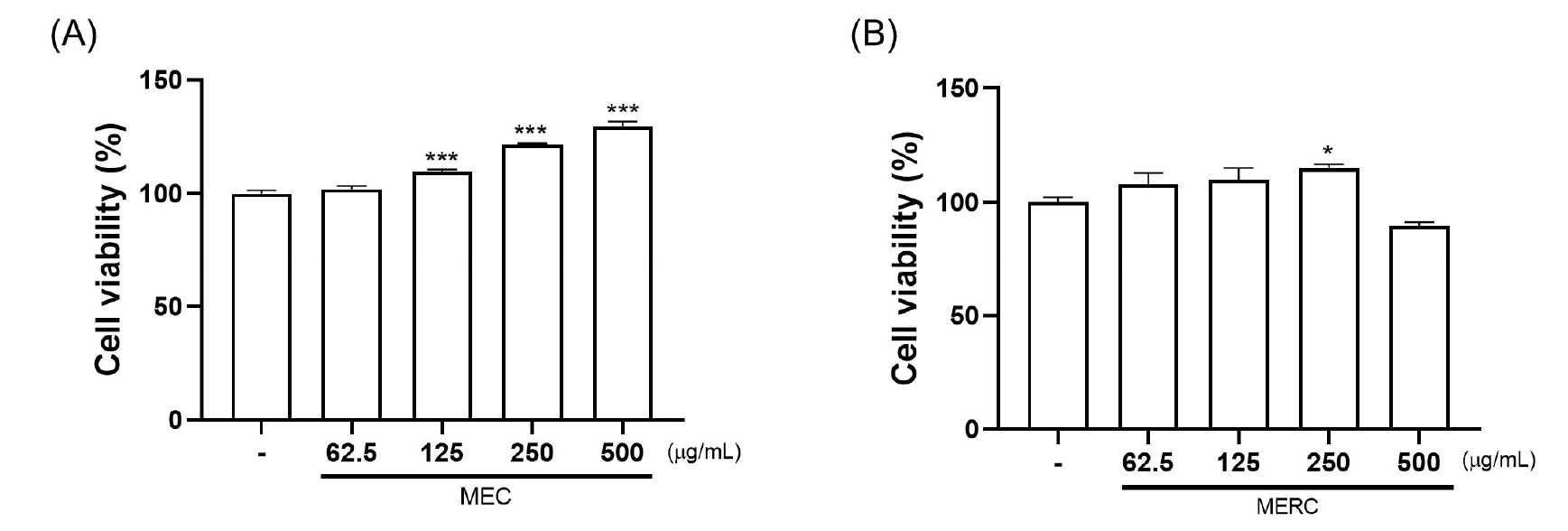
MEC와 MERC가 RAW 264.7 세포의 생존율에 미치는 독성을 평가하기 위해 MTT assay를 수행하였다. 각 추출물을 처리한 결과 두 추출물 모두 500 µg/mL 이하에서 유의적인 독성이 없음을 확인하여 이후의 연구는 500 µg/mL 이하에서 수행하였다(Fig. 1).
MEC와 MERC가 NO 생성과 iNOS의 mRNA발현에 미치는 영향
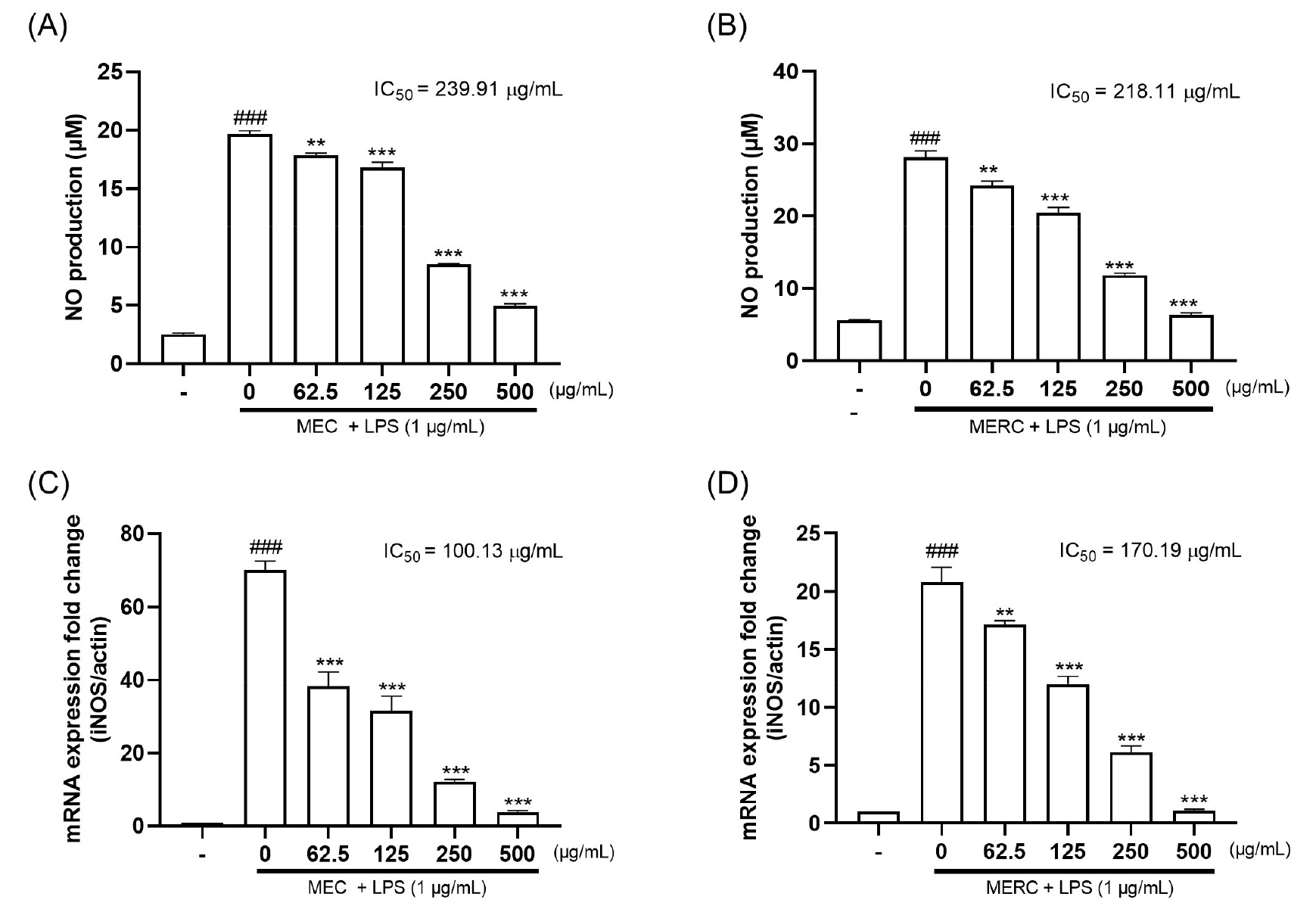
RAW 264.7 세포에서 LPS 자극에 의해 생성된 NO가 MEC와 MERC의 전처리로 인해 억제되는지 확인하기 위해 NO assay를 수행하였다. 그 결과 MEC(IC50 = 239.91 µg/mL, Fig 2A)와 MERC(IC50 = 218.11 µg/mL, Fig. 2B)가 LPS로 유도된 NO의 생성을 농도의존적으로 억제하는 것을 확인하였다.
NO 생성량 감소가 iNOS의 mRNA 발현 억제에 의한 것인지 확인하기 위하여 RT-PCR을 수행하였다. 그 결과 LPS에 의하여 iNOS의 mRNA 발현이 증가되었으며, 추출물을 처리 후 MEC(IC50 = 100.13 µg/mL, Fig 2C)와 MERC(IC50 = 170.19 µg/mL, Fig. 2D) 모두 농도의존적으로 iNOS의 mRNA 발현을 억제하는 것을 확인하였다. 이 결과는 MEC와 MERC가 iNOS의 mRNA 발현을 억제하여 NO의 생성을 유의적으로 감소시킴을 시사한다.
MEC와 MERC가 PGE2 생성과 COX-2의 mRNA 발현에 미치는 영향
RAW 264.7 세포에서 LPS 자극에 의해 생성된 PGE2가 MEC와 MERC의 전처리로 인해 억제되는지를 ELISA kit를 이용하여 확인하였다. MEC(IC50 = 154.96 µg/mL, Fig. 3A)와 MERC(IC50 = 51.80 µg/mL, Fig. 3B)의 전처리가 배양액 내 LPS로 유도된 PGE2를 유의적으로 억제하는 것을 확인하였으나, MERC 500 µg/mL에서 증가하는 것을 확인하였다. 이는 고농도의 MERC에서 PGE2의 생성을 증가시킬 수 있음을 의미한다.
COX-2는 대식세포와 같은 염증반응을 매개하는 세포에서 높게 발현되며 PGE2를 생성하여 통증을 유발하는 것으로 알려져 있다(Song and Ha, 2009). 배양액 내 PGE2의 감소가 COX-2의 발현 감소에 의한 것인지 확인하기 위해 RT-PCR을 이용하여 확인하였다. MEC(IC50 = 234.48 µg/mL, Fig. 3C)와 MERC(IC50 = 276.97 µg/mL, Fig. 3D)가 LPS로 유도된 COX-2의 mRNA의 발현을 유의적으로 감소시키는 것을 확인하였다. 이 결과는 MEC와 MERC가 COX-2의 mRNA 발현을 억제하여 PGE2의 생성을 유의적으로 감소시킴을 시사한다.
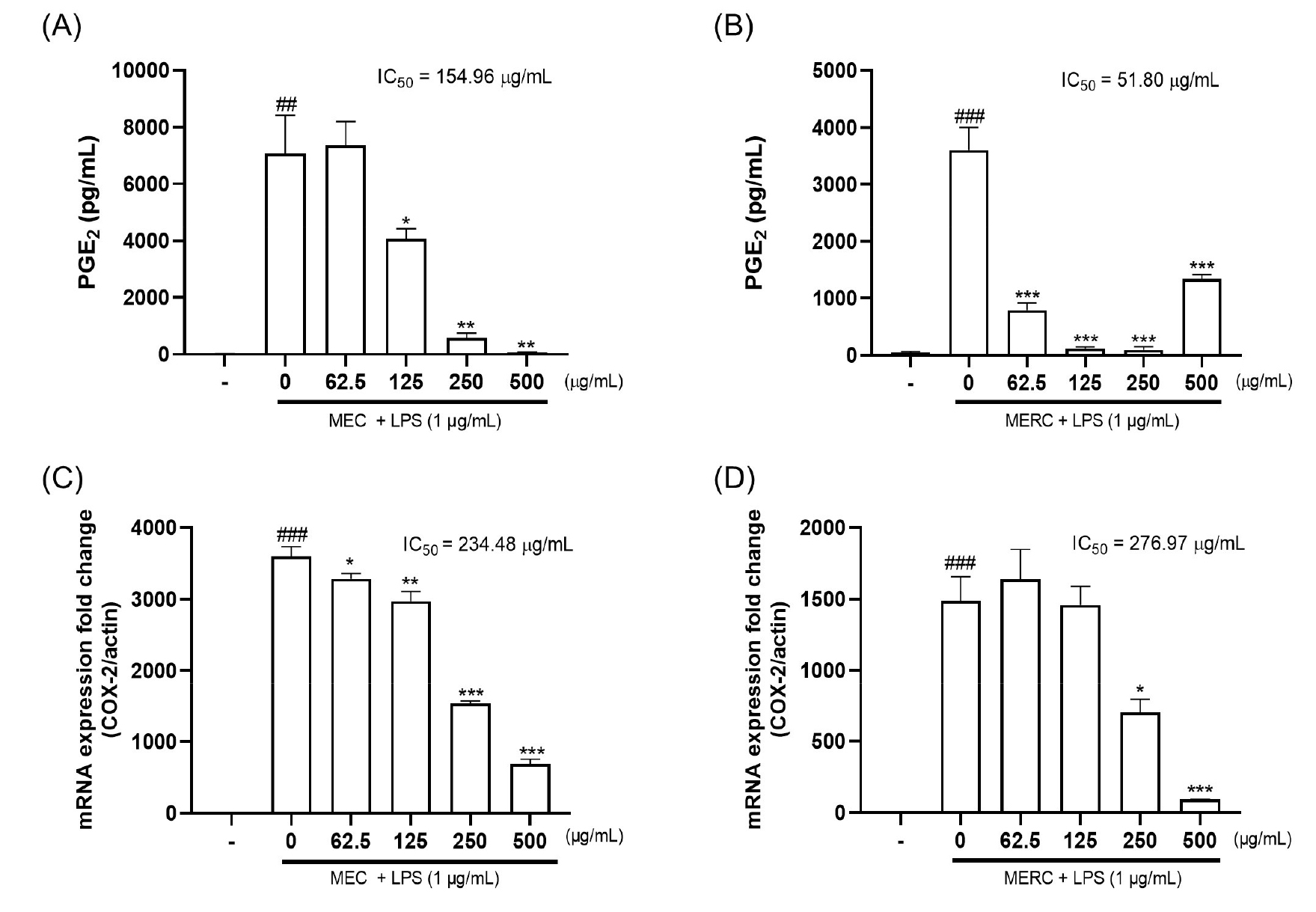
Fig. 3.
Effects of methanolic extract of clover (MEC) and red clover (MERC) on the PGE2 production and COX-2 mRNA expression in LPS-stimulated RAW 264.7 cells. ##p < 0.01; ###p < 0.001 : significant as compared to vehicle alone, *p < 0.05; **p < 0.01; ***p < 0.001 : significant as compared to LPS alone.
MEC와 MERC가 염증성 사이토카인 발현에 미치는 영향
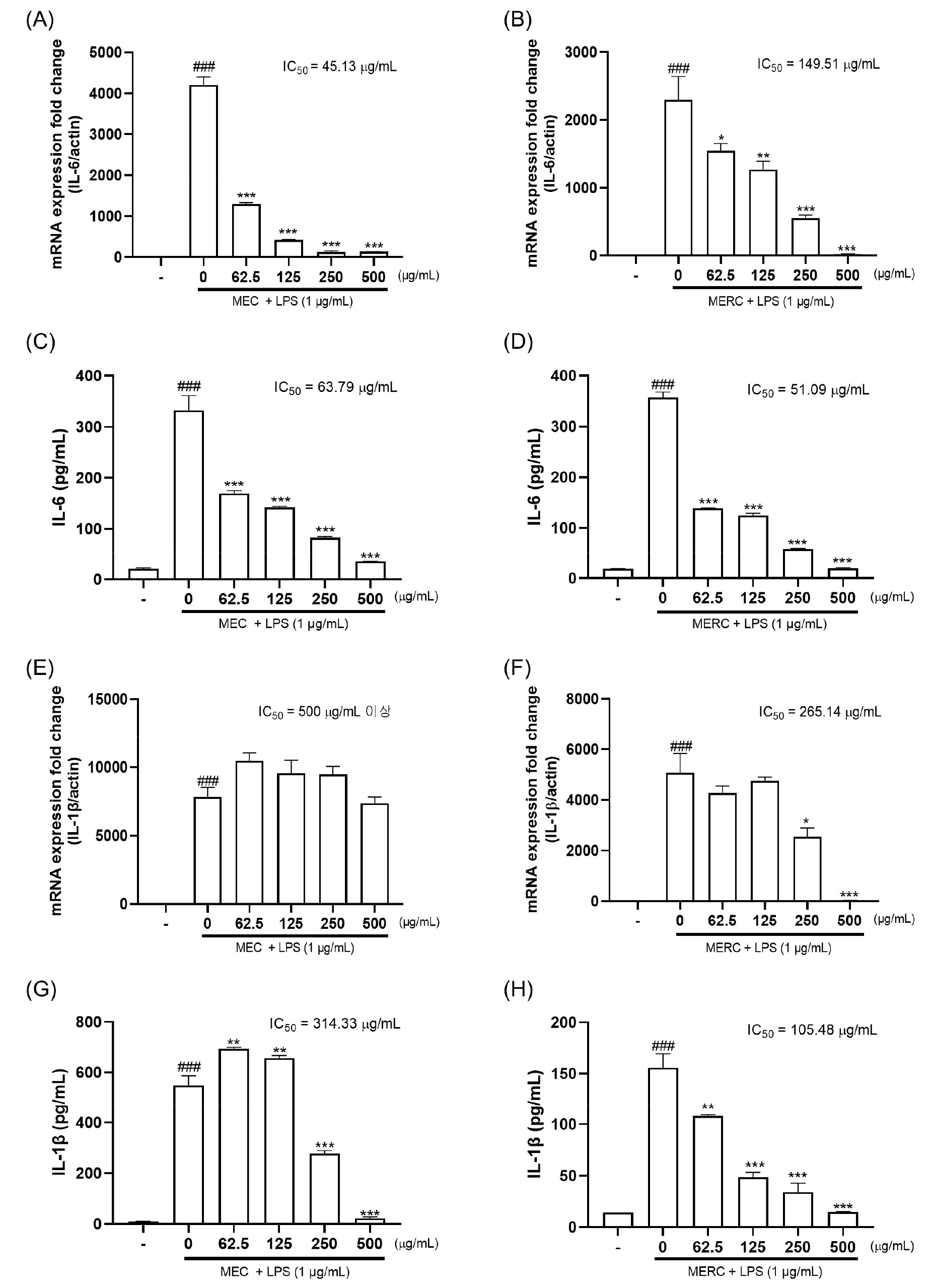
MEC와 MERC의 전처리가 LPS로 자극한 RAW 264.7 세포에서 염증성 사이토카인의 생성을 억제하는지 RT-PCR과 ELISA 분석법을 이용하여 확인하였다. 염증성 사이토카인의 mRNA 발현을 확인한 결과, LPS에 의해 유도된 IL-6 mRNA는 MEC와 MERC 모두에서 감소하는 경향을 확인하였다(Fig. 4A, 4B). 나아가 ELISA 분석법을 통해 배양액 내 염증성 사이토카인인 IL-6 단백질을 정량한 결과 MEC(IC50 = 63.79 µg/mL, Fig. 4C)와 MERC(IC50 = 51.09 µg/mL, Fig 4D) 모두 LPS로 유도된 IL-6의 단백질 생성을 효과적으로 억제하는 것을 확인하였다. 이는 MEC와 MERC가 LPS로 유도된 IL-6의 mRNA 발현을 감소시켜 단백질 발현 조절에 효능이 있는 것을 시사한다.
또한 IL-1β의 mRNA 발현을 확인한 결과, MERC에 의해 IL-1β의 mRNA의 발현이 유의적으로 감소하였지만(Fig. 4F), MEC는 IL-1β의 발현을 감소시키지 않는 것을 확인하였다(Fig. 4E). 반면 LPS로 유도된 배양액 내 IL-1β 단백질 생성은 MERC(IC50 = 105.48 µg/mL, Fig. 4H)와 MEC(IC50 = 314.33 µg/mL, Fig. 4G)모두 억제하는 것을 확인하였다. 이 결과는 MERC가 IL-1β의 mRNA 발현을 감소시켜 단백질의 발현을 억제한 것을 시사하며, MEC가 IL-1β의 mRNA에 유의적인 영향을 끼치지 않은 채 단백질 발현을 감소시킨 것은 MEC가 전사 후 과정을 조절했음을 시사한다.
고찰 및 결론
최근 생리활성을 가지는 신물질의 탐색 및 신소재 개발의 중요성이 부각되고 있다. 특히 선진국의 신물질 개발에 의한 물질 특허가 증가하고 있고, 이에 따라 국내에서도 국제 경쟁력을 확보하기 위한 새로운 소재 개발이 시급한 상황이다(Jhoo, 2008). 따라서, 본 연구는 다양한 생리활성 기능을 가진 것으로 알려진 토끼풀(Trifolium repens L.) 추출물과 붉은토끼풀(Trifolium pratense L.) 추출물의 기능성 소재로 활용 가능성을 확인하고자 하였다. MEC와 MERC 모두 500 µg/mL 이하의 농도에서 RAW 264.7 세포의 생존율에 영향을 미치는 독성이 없는 것을 확인하여 500 µg/mL 이하에서 실험을 수행하였다. LPS로 염증을 유도한 RAW 264.7 세포에서 MEC와 MERC의 전처리가 NO와 PGE2의 생성 및 iNOS와 COX-2의 mRNA 발현을 유의적으로 감소시키는 것을 확인하였다. MEC와 MERC가 LPS로 유도된 iNOS와 COX-2의 mRNA 발현을 억제시켜 NO와 PGE2의 생성을 유의적으로 감소시켰으며 동일농도에서 MERC가 MEC 보다 뛰어난 PGE2 억제능을 보였다. 그러나 MERC의 전처리로 모든 농도에서 LPS로 유도된 PGE2가 유의적으로 감소하였으나 500 µg/mL에서 이하농도와 비교하여 증가하는 것을 확인하였다. 이는 고농도의 붉은토끼풀 추출물이 PGE2의 생성을 증가시켜 염증성 질환을 유발할 수 있음을 시사한다. COX-2는 arachidonic acid로부터 PGE2를 합성하는데 촉매작용을 하는 효소로 염증 및 면역기능을 조절하며 PGE2는 손상된 부위나 조직에서 통증과 발열 전달에 관여하는 중요한 염증성 인자로 과잉시 각종 염증성 질환을 유발하게 된다(Kim and Lim, 2008; Yun and Lee, 2012). PG는 월경주기, 배란, 유산 및 분만에 중요한 역할을 하고 있으며 임신시 과량의 PGE2를 사용할 경우 과도한 자궁수축으로 인해 태아의 저산소증을 초래한다고 알려져 있다(Kim et al., 1995). 실제로 고농도의 붉은토끼풀이 불임과 관련된 부작용이 보고된 바 있어 붉은토끼풀의 PGE2 생성에 따른 독성에 대한 후속연구가 필요할 것으로 사료된다(Nelsen et al., 2002).
본 연구에 사용된 MEC와 MERC가 LPS로 유도된 염증성 사이토카인의 발현을 억제시키는 것을 확인하였다. LPS로 염증을 유도한 RAW 264.7 세포에서 MEC와 MERC의 전처리가 IL-6와 IL-1β의 단백질 생성을 유의적으로 억제하는 것을 확인하였다. 즉, 토끼풀과 붉은토끼풀은 IL-6와 IL-1β에 효과가 있을 것으로 사료되며 두 추출물 모두 IL-6 관련 질환인 염증성 질환이나 림프계 종양과 IL-1β 관련 질환인 염증 및 통증 질환등의 치료제로서 개발 가능성을 확인하였다. 한편 MEC은 IL-1β의 mRNA 발현량은 감소시키지 못했으나 배양액 내 방출된 단백질 생성량을 감소시켰다. 대식세포는 병원체의 침입, 사이토카인 노출과 같은 다양한 스트레스에 의해 mRNA에서 단백질로의 번역 단계가 조절될 수 있다는 보고가 있다(Tabatabaei et al., 2020). 또한, IL-1β의 경우 대식세포에서 염증 복합체인 인플라마솜(inflammasome)의 활성화에 따라 방출되는 단백질로 알려져 있다(Martín-Sánchez et al., 2016). 이처럼 IL-1β는 다양한 기전을 통해 생성될 수 있고 mRNA와 단백질 발현량에 차이가 발생할 수 있다. 따라서 토끼풀이 IL-1β의 단백질을 유의적으로 감소시킨 것은 다른 기전에 대한 추가 연구를 통해 다양한 염증 반응 및 질환에 적용할 수 있을 것으로 사료된다.
본 연구를 통해 토끼풀과 붉은토끼풀의 항염증 효과를 확인하였다. 다만, 본 연구 결과 뿐 아니라 선행연구에서도 고농도 붉은토끼풀에서 독성이 보고되어 독성에 대한 후속 연구 및 규명이 필요하다. 추후 면역이상증과 염증성 질환의 치료제로의 개발을 위해 저농도의 토끼풀과 붉은토끼풀의 기전연구가 필요할 것으로 사료된다.