서 론
재료 및 방법
토양에서 분리한 세균의 식물병원성 곰팡이에 대한 길항력 검정
선발한 미생물의 biochemical test
결과 및 고찰
토양에서 분리한 세균의 식물병원성 진균에 대한 길항력 검정
토양에서 분리한 세균의 biochemical test
요 약
서 론
농업에서 식물병은 작물의 수확량 감소, 품질 저하 등 경제적인 손실을 야기한다. 현대에는 농약과 비료를 사용함으로써 곰팡이병, 세균병 등을 방제하지만 이들의 오용과 남용 그리고 토양에 축적된 화학물질이 생태계를 오염시키는 환경적인 문제가 되고 있다. 또한 작물에 남아있는 잔류농약이 인체에 축적되는 사례도 적지 않게 발생하고 있으며, 해외로 수출되는 몇 가지 작물들에 대한 잔류농약 규제가 강화되면서 수출에 난항을 겪고 있는 실정이다(Mansour, 2004). 이러한 문제점 때문에 최근에는 화학물질을 사용하지 않고 무농약 및 유기농 재배를 하는 친환경농법 적용 농가가 증가하고 있다(Dangour et al., 2010). 친환경농업은 천연물질이나 미생물을 이용하는 것으로 작물 및 환경에 부정적인 영향이 없으며 건강한 작물을 재배할 수 있는 장점이 있다. 이러한 많은 미생물 중에서 세균의 Volatile Compounds(VOC)가 곰팡이의 생장에 영향을 준다는 연구가 보고된 바 있다(Wheatley et al., 2002). VOC는 해당 과정, 단백질 및 지방 분해를 하는 이화 작용을 통하여 생성되며 휘발성 유기화합물로 분류가 된다(Penuelas et al., 2014; Schulz and Dickschat, 2007). 일부 세균 및 곰팡이는 cellulose를 가수분해하는 생화학물질인 cellulase를 생성한다(Tomme et al., 1995). 특히 Cellulase는 곰팡이보다 세균이 더 많이 생성하는 것으로 알려져 있으며, 이런 특성을 통하여 토양에서 cellulase를 생성하는 세균이 곰팡이의 생장을 간접적으로 억제한다(Acharya et al., 2012; Yotchaisarn et al., 2018). 또한 cellulase는 효모, 곰팡이, 세균 등의 세포벽에 존재하며 섬유소 분해효소로 길항효과(antagonistic effect)가 있는 것으로 보고된바 있다(Zafar et al., 2014).
본 연구에서는 토양에서 분리한 세균이 분비하는 VOC 특성을 조사하여 분리한 세균의 항균 능력을 확인하여 농업에서 주로 문제가 되는 식물병원성 곰팡이에 대한 길항효과를 확인하여 생물적 방제제의 가능성을 연구하고자 한다.
재료 및 방법
토양에서 분리한 세균의 식물병원성 곰팡이에 대한 길항력 검정
토양에서의 세균 분리
본 연구에서 사용한 세균은 육안으로 관찰하였을 때 식물병이 없는 건전한 식물체가 자란 장소를 선정하여, 지표면에서 10cm 깊이의 토양을 채취하여 사용하였다. 채취한 토양은 3일간 음지에서 풍건한 후, serial dilution 방법으로 10-4까지 희석하여 Tryptic Soy Agar(TSA, MBcell, USA) 배지에 30 µL씩 분주 후 도말하여 30°C에서 3일간 배양하였다. 미생물이 자란 배지에서 육안상 colony의 모양, 색깔, 형태 등 형태학적 특징을 기준으로 총 39종 균주를 순수 분리하여 실험에 사용하였다.
분리한 세균의 선발 및 식물병원성 진균에 대한 생장억제 검정
식물병원성 진균은 국립농업유전자원센터(Korean Agricultural Culture Collection, KACC)에서 Alternaria solani, Colletotrichum gleosporioides, Fusarium oxysporum, Rhizoctonia solani, Sclerotinia minor, S. sclerotiorum을 분양받아 Potato Dextrose Agar(PDA, MBcell, USA)에 7일간 배양하여 실험에 사용하였다(Table 1). 식물병원성균에 대해 분리한 39종 균주의 길항력을 확인하기 위해 TSA와 PDA를 각각 혼합한 배지(v/v, 1:1)를 만들어 150 mm petridish에 분주하였으며, 직경 4 mm cork borer를 사용하여 6종 진균을 접종한 후 TSB 배지에서 48시간 배양한 39종 균주를 각각 30 µL씩 분주하였다. 7일 후 inhibition zone을 나타내는 5종 균주를 선발하였으며, 선발한 5종의 균주를 동정하고자 16S RNA(universal primer 27F; 5’-AGAGTTTGATCTG GCTCA G-3’, 1492R; 5’-TACGGYTACCTTGTTACGACTT-3’)로 염기서열을 분석하였다. 그 후 NCBI의 BLAST를 통하여 선발한 5종을 동정하였다. 1차 screening에서 선발된 5종 균주가 식물병원성 곰팡이 6종에 대해 길항효과를 확인하고자 ∅ 90 mm petridish에 각각 혼합 배지(v/v, 1:1)를 분주한 후 1:1 대치배양을 진행하였다. 그 후 무처리구의 식물병원성 진균의 균사가 plate 전체를 채울때까지 배양 후 세균과의 거리를 측정하여 진균에 대한 억제율(Inhibition rate)을 계산하였으며, 각각의 실험은 분리한 균주당 5 plate씩 3반복 진행하였다.
Table 1.
The six fungal pathogens used in this study and their disease symptoms
| No. | Fungal species | Host plants | Disease symptoms1) |
| 1 | Aternaria solani | Tomato | Early blight |
| 2 | Colletotrichum gloeosporioides | Pepper | Anthracnose |
| 3 | Fusarium oxysporum | Pepper, Tomato | Fusarium wilt |
| 4 | Rhizoctonia solani | Chinese cabbage | Bottom rot |
| 5 | Sclerotinia minor | Chinese cabbage, Lettuce | Sclerotinia rot |
| 6 | Sclerotinia sclerotiorum | Lettuce | White mold |
선발한 미생물의 biochemical test
Cellulase production test
선발된 5종의 세균의 Cellulase 생성 여부를 확인하기 위해 1% cellulose가 첨가된 Basal 배지(NaNO3 1 g, K2HPO4 1 g, KCl 1 g, MgSO4·7H2O 0.5 g, yeast extract 0.5 g, glucose 1 g, distilled water 1 L, agar 15 g)를 제조한 후 직경 4 mm cork borer로 well을 만들어 TSB에 배양된 각각의 세균을 30 µL씩 접종하여 5일간 28°C에서 배양하였다. 배양 후, 1% iodine solution으로 염색하여 well 주변에 clean zone을 통하여 생성 여부를 확인하였다(Cappuccino et al., 1992).
Chitinase production test
선발한 5종의 세균의 chitinase의 생성 여부를 확인하기 위해 Roberts와 Selitrennikoff(1988)의 방법을 참고하여 실험을 진행하였다. Colloidal chitin을 얻기 위해 350 ml HCl에 crab-shell chitin(Sigma Aldrich) 20 g을 혼합 후 4°C의 냉장고에 24시간동안 보관하였다. 이후 거즈로 filtering하여 –20°C의 ethanol을 첨가하여 생성된 chitin 현탁액을 10,000 g로 20분간 원심분리 하였다. 상층액은 버리고 생성된 pellet을 멸균수로 세척하였고 동결 건조 후 –20°C에 보관하였다. 생성된 colloidal chitin을 TSA배지에 2%(w/v)을 첨가하여 colloidal chitin plate를 만들었으며, 직경 4 mm의 cork borer을 사용한 well에 각각의 세균 30 µL를 접종하여 5일간 35°C에서 배양하였다. 1% iodine solution으로 염색하여 형성된 clean zone을 통하여 chitinase 생성 여부를 확인하였다.
Hydrogen Cyanide (HCN) production test
Hydrogen cyanide 생성 여부는 Lorck (1948)의 분석법을 참고하여 확인하였으며, glycine(4.4 g/L)이 첨가된 TSA배지에 각각 선발한 세균을 접종하였다. 이후 멸균한 filter paper를 0.5%(w/v) picric acid와 1% Na2CO3의 혼합액에 침지시킨 후 petridish의 뚜껑에 부착시켜 37°C에서 14일간 배양하였다. Filter paper의 색이 yellow에서 red-brown으로의 변화를 통하여 HCN 생성 여부를 확인하였다.
Protease test
선발된 세균 5종을 TSB 배지에 48시간 배양하여 사용하였으며 skim milk agar(skim milk 100 g, peptone 5 g, agar 15 g/L) 배지에 직경 4 mm cork borer를 사용하여 well을 만들었다. 배양된 각각의 세균을 30 µL씩 접종하여 48시간 28°C에서 배양하였다. 그리고 1% iodine solution으로 염색하여 well 주변부의 clean zone을 통하여 protease의 생성여부를 확인하였다(Cappuccino and Sherman, 2006).
결과 및 고찰
토양에서 분리한 세균의 식물병원성 진균에 대한 길항력 검정
세균의 선발 및 동정
순수 분리한 미생물을 colony의 형태학적 특징을 기준으로 총 39종의 세균을 분리하였으며, 1차 길항실험을 통해 최종적으로 5종의 세균을 선발하여 동정하였다. 동정한 세균은 각각 BH9, BH29, BH36, BH37, BH38로 명명하여 실험에 사용하였고 NCBI GeneBank의 염기서열을 BLAST를 통하여 Burkholderia sp., Lysinibacillus macrolides, Paenibacillus peoriae, Bacillus subtilis, Burkholderia sp.로 동정이 확인되었다(Table 2).
Table 2.
List of identified bacterial isolates with their similarity to Genbank library strain
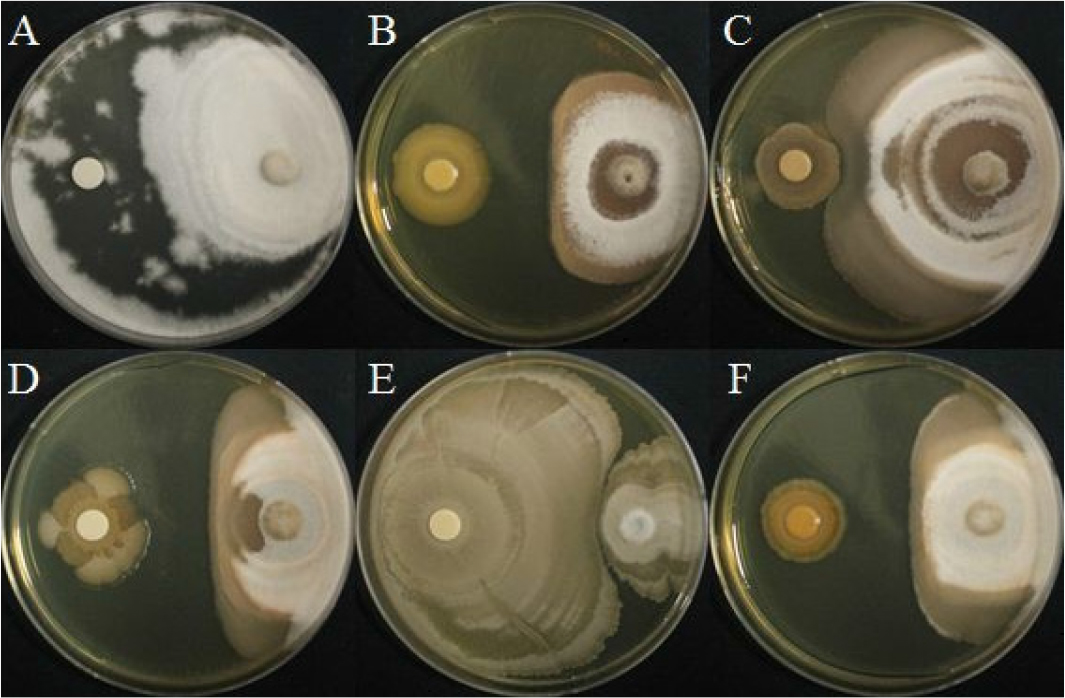
선발한 5종 세균의 A. solani에 대한 길항력
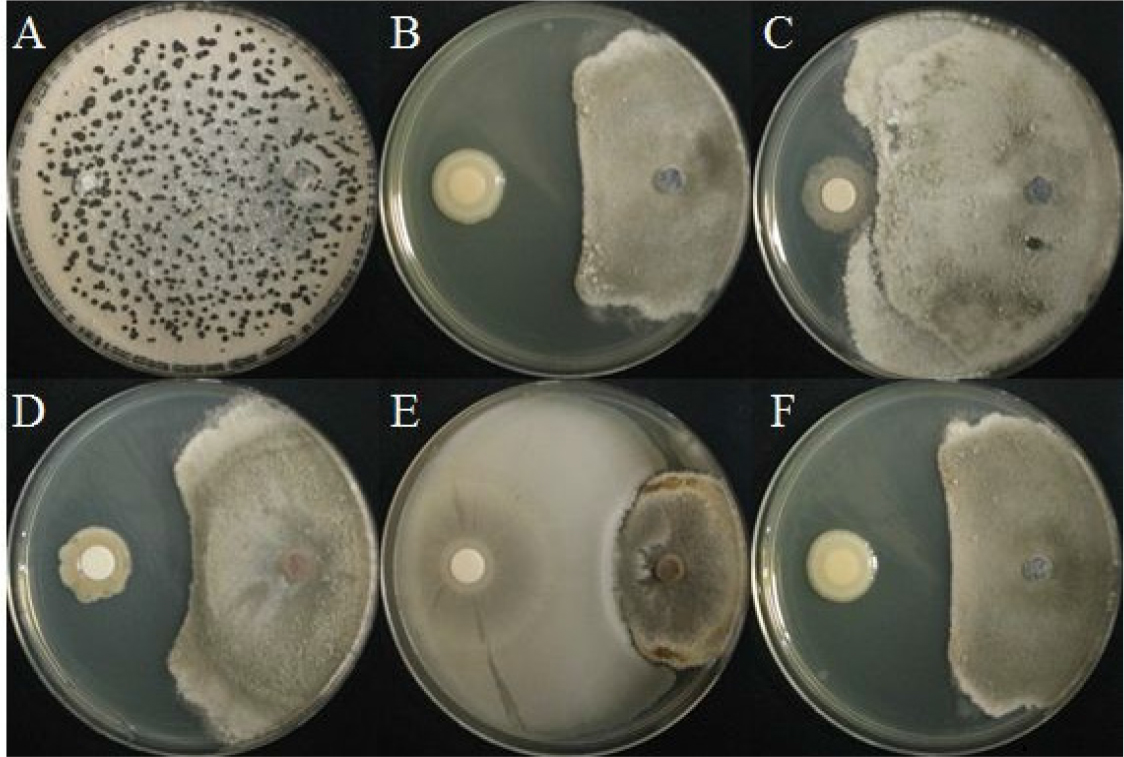
겹무늬병원균의 대치배양을 실시하였으며, 82.8%로 BH37의 억제율이 가장 높았으며 BH36(60.9%), BH9 (58.1%), BH38(57.2%) 순으로 억제율이 높았다(Fig. 1, Table 3). 선행연구에 따르면 토마토를 대상으로 필드에서 Pseudomonas fluorescens, Bacillus subtilis가 A. solani의 균사 생장을 각각 47.8%, 47.1%의 억제율로 병 발생 억제효과가 있다고 보고되었다(Moges et al., 2012). 이에 따라 선발한 세균 BH37는 높은 억제율을 나타냈으며 겹무늬병에 대한 억제 효과가 있을 것으로 예상된다.
Table 3.
In vitro inhibition rate of rhizobacterial isolates against several plant pathogenic fungi
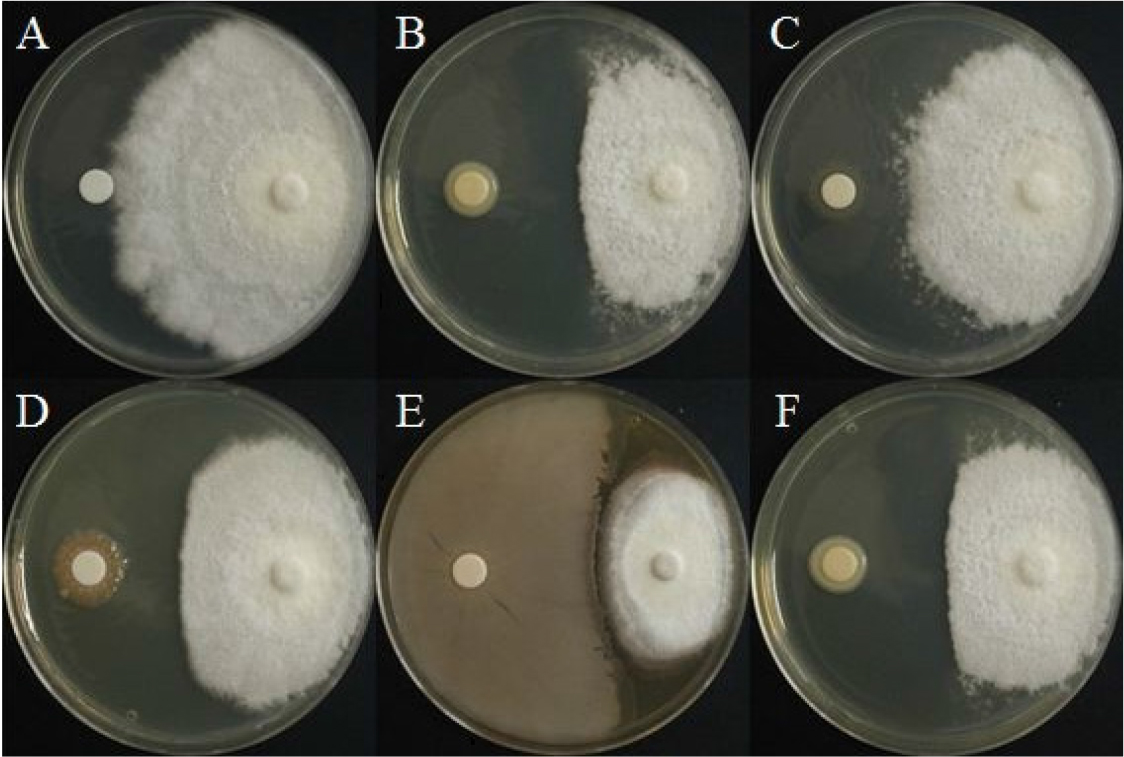
선발한 5종 세균의 C. gloeosporioides에 대한 길항력
탄저병원균의 대치배양에서 BH37균주가 64.6%로 가장 높은 억제율을 나타냈으며 순서대로 BH9, BH38, BH36 그리고 BH29가 각각 55.8%, 48.8%, 44.2%, 4.2% 의 억제효과를 확인하였다(Fig. 2, Table 3). B. sutilis는 C. gloeosporioides의 균사 생장을 63.6% 억제하는 연구가 보고된바 있다(Kabir, 2012).
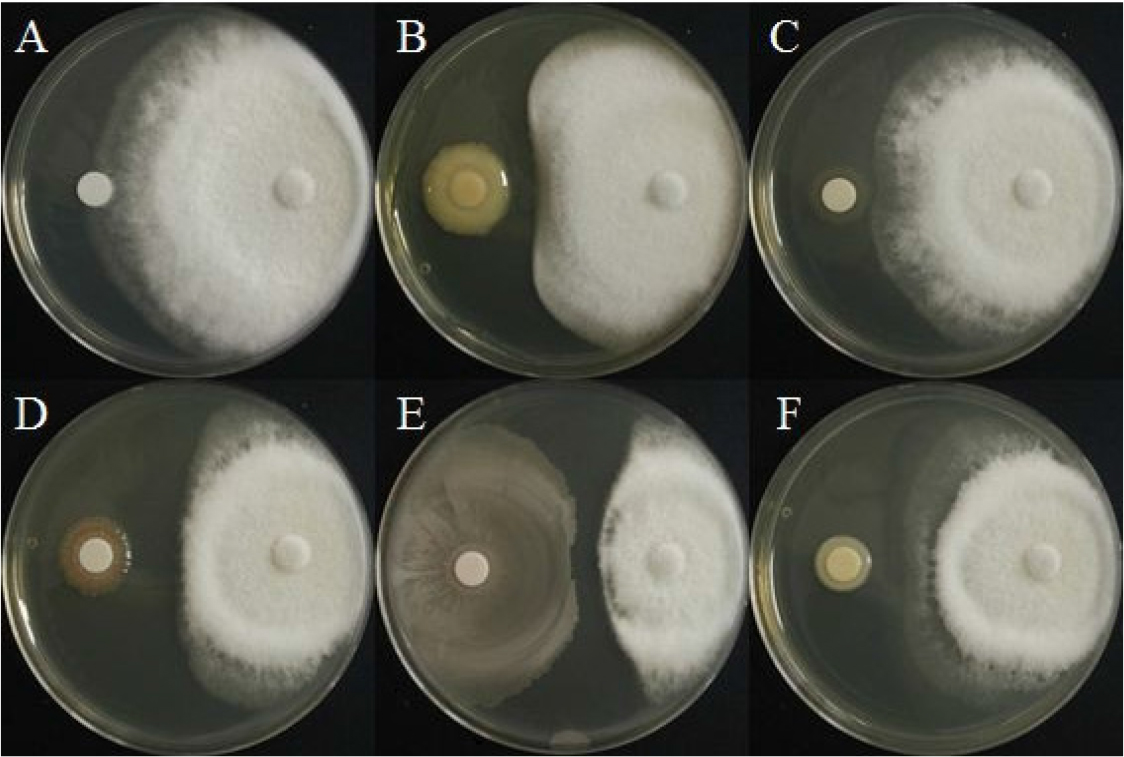
선발한 5종 세균의 F. oxysporum에 대한 길항력
시들음병원균에 대한 길항력을 확인하고자 대치배양을 실시하였으며 BH9는 23.3 %의 억제효과를 나타냈으며, BH29는 시들음병원균에 대한 억제효과를 보이지 않았다. BH36과 BH38은 각각 44.2%, 48.8%로 비슷한 억제율을 나타내었으며, BH37은 64.6%로 가장 높은 억제율을 보여주었다(Fig. 3, Table 3). 다른 연구에 따르면 Salvia officinalis의 시들음병이 Brevibacillus brevis라는 근권세균을 처리하였을 때 병 발생율이 46.0% 감소한 바 있다(Omar and Ahmed, 2014).
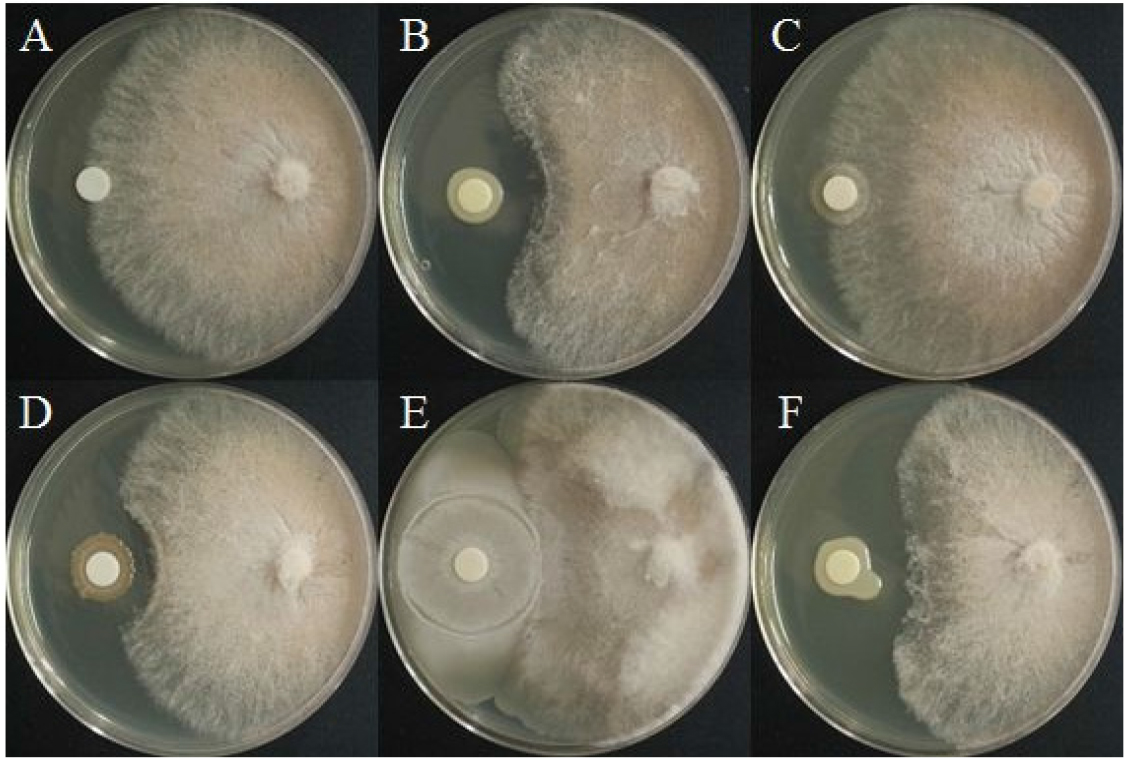
선발한 5종 세균의 R. solani에 대한 길항력
모잘록병원균에 대해 대치배양을 실시한 결과, BH29는 모잘록병원균에 대한 균사 생장 억제효과가 없는 것을 확인하였다. BH9, BH36, BH37, BH38은 각각 29.8%, 26.0%, 31.6%, 35.8%로 낮은 억제율을 나타냈다(Fig. 4, Table 3). 다른 연구 결과, Pseudomonas fluorescens의 Siderophore, HCN, Indole Acetic acid(IAA) 등의 2차 대사산 물의 기작으로 okra의 뿌리썩음병을 72.05% 억제되었으며, 토양전처리 효과가 좋았다고 보고된 바 있다(Adhikari et al., 2013).
선발한 5의 세균의 S. minor에 대한 길항력
균핵병원균에 대해 대치배양을 실시한 결과, BH37는 81.4%로 가장 높은 균사 생장 억제효과를 보였고, BH9, BH36, BH38은 각각 58.6%, 47.9% 그리고 57.7%의 억제효과를 보여주었다. BH29는 8.8%로 가장 낮은 억제효과를 보여주었다(Fig. 5, Table 3). 균핵병은 최적의 환경조건 상태에서 균사 덩어리를 생성 후 많은 양의 포자를 생성하기 때문에 방제하기 어려운 병으로(Tarabily et al., 2000), 본 연구에서 선발된 BH37 균주로 균핵병 방제가 가능할 것으로 생각된다.
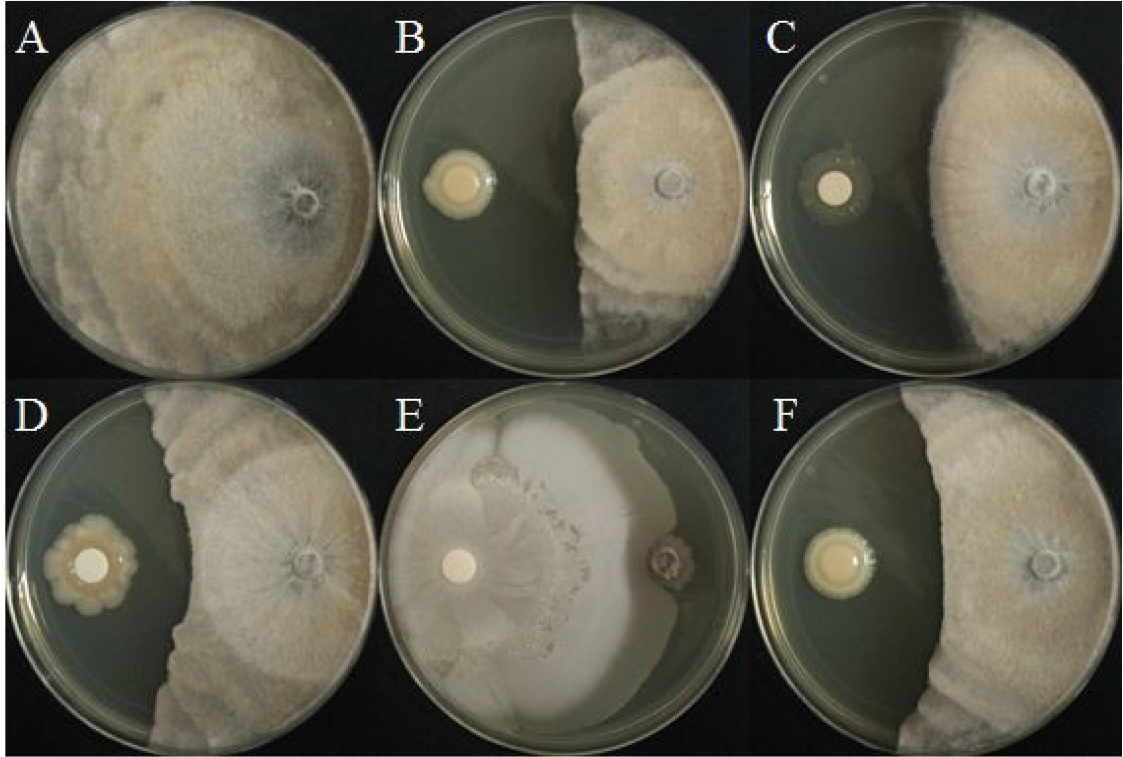
선발한 5종 세균의 S. sclerotiorum에 대한 길항력
균핵병원균에 대해 대치배양을 실시한 결과, BH37은 95.3%로 균사 생장 억제효과가 가장 높았고, BH9, BH36, BH38은 각각 54.0%, 48.8% 그리고 53.5%의 억제율을 보여주었다. 5가지 균주 중에서 BH29는 29.8%로 가장 낮은 억제 효과를 나타냈다(Fig. 6, Table 3). 본 연구에서 BH37 균주가 균핵병원균에 대해 가장 높은 억제율을 보여주었으며 균핵병 생물방제제로 큰 효과가 있을 것으로 예상된다.
토양에서 분리한 세균의 biochemical test
Cellulase 생성 여부
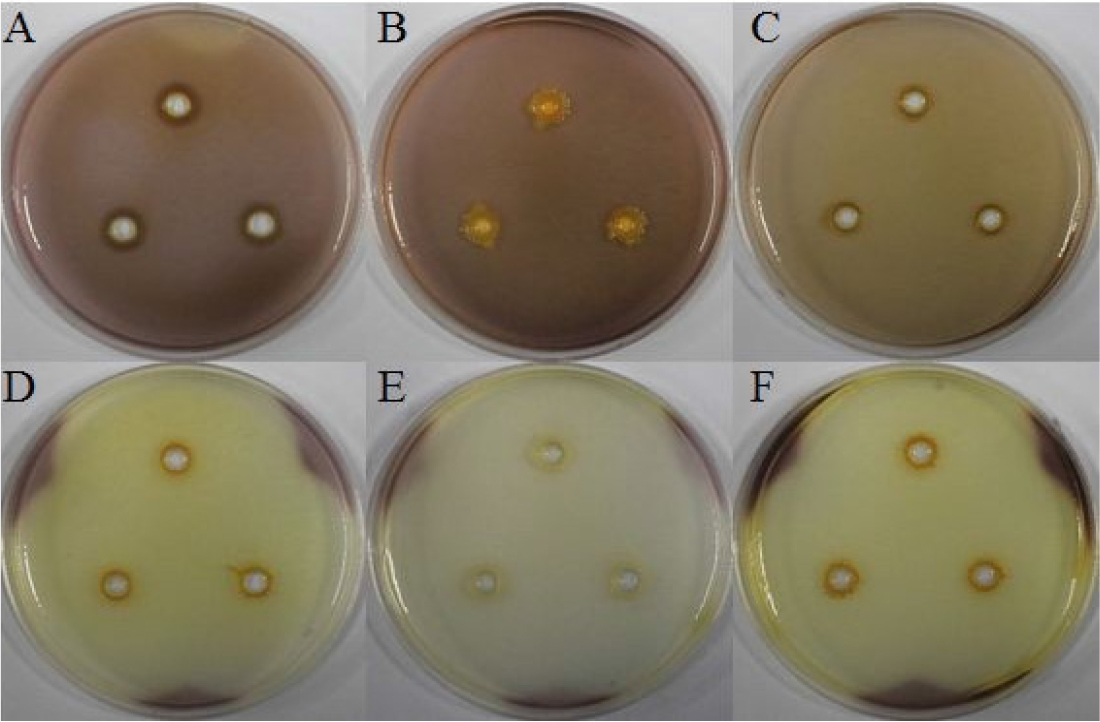
선발한 세균의 cellulase 생성을 확인하였으며 5균주 중 BH9와 BH29는 cellulose 분해 효소를 생성하지 않았으나, BH36, BH37, BH38은 cellulase 효소를 생산하는 것을 clear zone을 통하여 확인하였으며 모두 유사한 수준으로 cullulase를 생성하는 것을 확인하였다(Fig. 7).
Chitinase 생성 여부
Chitinase는 병원성 곰팡이의 세포벽을 분해하여 곰팡이의 생장을 억제하는 항진균 작용을 하며 미생물 살균제로도 사용된다(Mahadevan and Crawford, 1997; Raaijmakers et al., 1995; Wiwat et al., 1999). 하지만, 본 연구에서 선발한 5균주는 모두 chitinase 효소 활성이 없는 것을 확인하였다(Fig. 8).
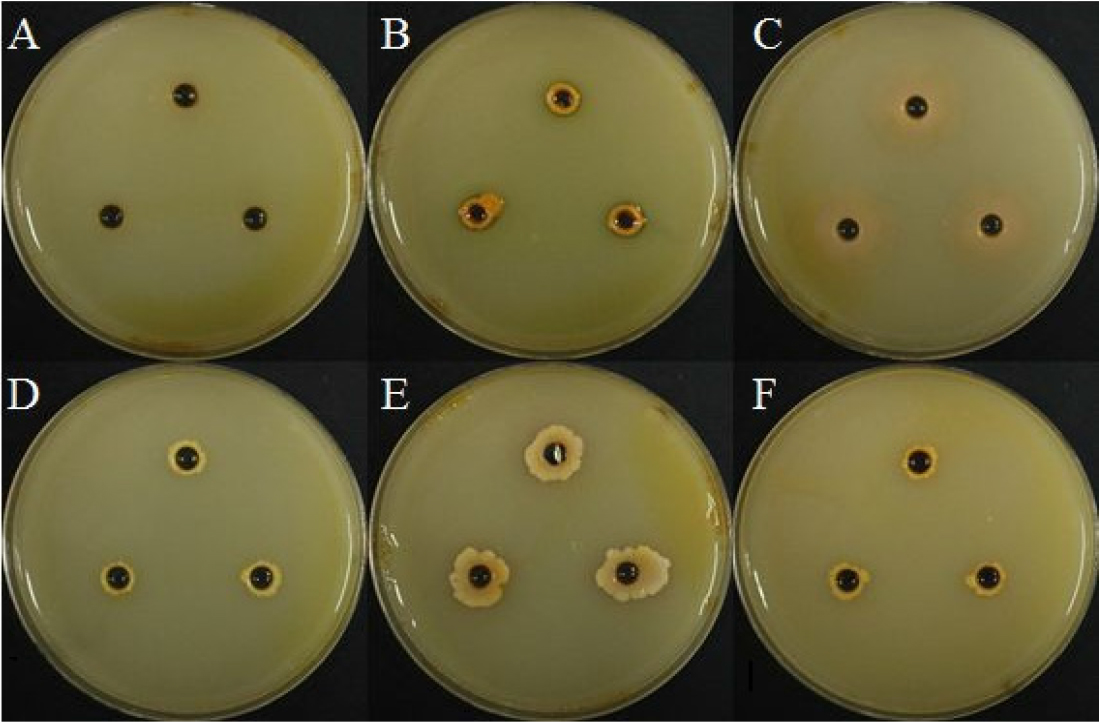
Hydrogen cyanide (HCN) 생성 여부
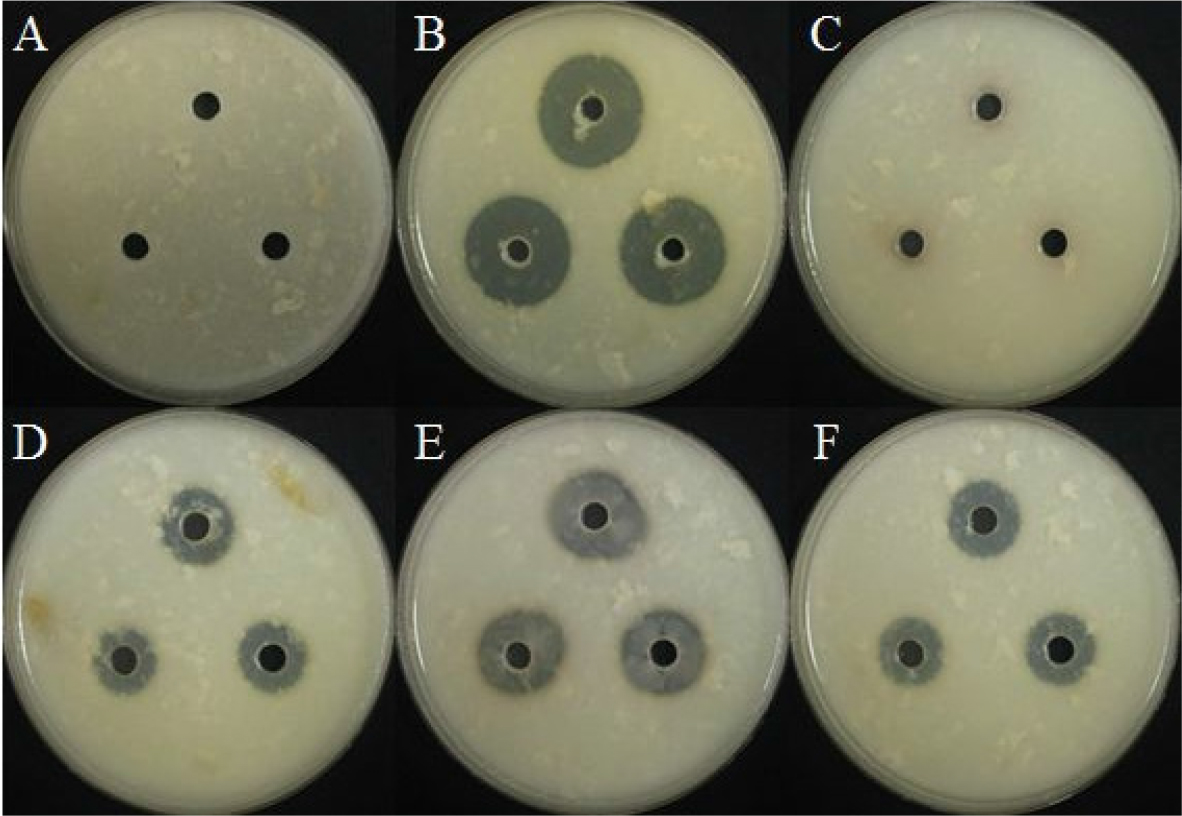
선발한 5균주에 대해 HCN 생성 여부를 확인하였으며, 모든 균주가 clear zone을 통해 HCN을 생성하는 것을 확인하였다(Fig. 9). 이런 HCN은 수용성이며 병원성 미생물에 대한 억제 효과가 있으며 식물의 성장을 촉진하는 역할도 있는 것으로 알려져 있다(Chandra et al., 2007; Kumar et al., 2009).
Protease 생성 여부
BH9, BH36, BH37, BH38에서 clear zone을 통하여 protease 생성 여부를 확인하였으며, BH9균주가 protease 생성이 가장 많은 것을 확인하였다(Fig. 10).
요 약
본 연구에서는 토양에서 분리한 세균 5종의 식물병원성 진균에 대한 길항효과와 생물학적 특성을 연구하였다. BH9균주는 S. minor의 균사 성장을 58.6% 억제하였으며, S. sclerotiorum의 균사 성장을 54% 억제하였다. BH29균주는 S. sclerotiorum의 균사 성장을 29.8% 억제하였지만 다른 곰팡이에 대해서는 길항효과를 보이지 않았다. BH36균주는 A. solani의 균사 성장을 60.9% 억제하였으며, BH37균주는 S. sclerotiorum에 대해 95.3%로 가장 높은 억제율을 보였을 뿐만 아니라 A. solani 및 S. minor에 대해 각각 82.8%, 81.4%의 높은 길항 효과를 나타냈다. BH38균주는 S. sclerotiorum에 대해 57.7%의 억제율을 보였으며 BH9균주의 실험 결과와 유사한 패턴을 나타냈다. 일부 미생물에서 분비되는 chitinase, cellulase와 같은 2차 대사산물은 식물병원성 진균의 성장을 방해하는 것으로 알려져 있다(Kai et al., 2007; Kumar et al., 2014). 선발한 5종의 세균 모두 chitinase와 HCN을 생산하지 않았으나 BH36, BH37, BH38균주는 곰팡이 성장 억제에 효과적인 cellulase와 proteinase를 생성하였다. Melotto et al. (2006)의 연구 결과에 따르면, B. subtilis를 처리한 식물은 MAMP 유발 면역 반응이 유도되어 기공을 닫아 식물을 보호한다는 결과와 비추어 보았을때 BH37균주 또한 그런 유사한 반응의 기작으로 병을 억제할 것으로 판단되며, 이를 통해 BH37균주는 겹무늬병 및 균핵병에 대한 생물학적 방제제로 유용할 것으로 판단된다.