서 론
친수기와 소수기를 동시에 갖는 양친매성 물질인 계면활성제는 계면의 성질을 변화시켜 분산을 촉진시키는 역할을 한다(Rebello et al., 2014). 이러한 특성 때문에 계면활성제는 습윤제, 유화제, 가용화제, 분산제 및 윤활제 등으로(Ribeiro et al., 2020), 의약품, 식품, 화장품, 농약 및 세제 산업에 널리 사용되고 있다(Fenibo et al., 2019; Kim et al., 2005; Mao et al., 2015). 현재 산업적으로 생산되고 있는 대부분의 계면활성제는 석유를 원료로 하여 생산되며, 이용 범위가 광범위하지만 독성이 있거나 쉽게 생분해 되지 않는 단점이 있다(Fenibo et al., 2019; Kim et al., 2009). 화학합성 계면활성제는 거품을 형성하여 빛과 산소를 차단하며, 세척력 증진을 위해 첨가되는 인은 인산염이 되어 부영양화 현상을 발생시켜 물을 오염시킨다(Sim and Park, 2006). 반면, 생물 계면활성제는 상대적으로 낮은 독성과 우수한 생분해성으로 꾸준히 주목을 받고 있다(Jahan et al., 2020; Marchant and Banat, 2012). 급속한 산업화에 의한 환경오염으로 인체에 유해한 제품에 대한 각종 규제가 점차 강화되는 추세이며, 이에 대응하기 위한 방안의 하나로써 생물 계면활성제의 산업화는 필수적인 문제로 인식되고 있다(Kim, 2013; Rebello et al., 2014).
생물 계면활성제는 미생물, 동물, 식물에서 얻을 수 있는 표면활성물질(surface active compound)로 1947년 최초로 보고되었으며(Zobell, 1947), 생체 내 생합성 과정의 해석, 유기합성 및 바이오매스의 원료화 등 다양한 분야에서 활발한 연구가 진행되고 있다(Joo and Kim, 2011; Kumar et al., 2007). 미생물은 동, 식물 세포에 비해 성장 속도가 상대적으로 빨라 생산기간이 짧고, 간단한 배양과정을 통해 목적하는 물질을 생산할 수 있다는 장점이 있다(Kim et al., 2005; Rebello et al., 2014). 또한, 당지질, 지질 펩타이드 등 미생물에 따라서 다양한 종류의 생물 계면활성제가 생산된다(Pacwa-Płociniczak et al., 2011). 생물 계면활성제의 생산에는 탄소원, 질소원, pH, 배양온도 등 다양한 요인이 영향을 미치며(Jahan et al., 2020; Santos et al., 2016), 최근 유전자 재조합기술을 이용한 생물 계면활성제 생산에 관한 연구도 진행되고 있다(Santos et al., 2016).
본 문헌 연구에서는 생물 계면활성제의 종류 및 생산성 향상과 관련된 최근의 연구결과를 조사하였고 생물 계면활성제의 다양한 산업적 이용 가능성을 살펴보았다.
본 론
계면활성제
계면활성제는 서로 다른 두 상의 계면장력을 감소시키는 양친매성 물질로써 친수성기와 소수성기를 함께 갖는 물질이다(Sim and Park, 2006). 계면활성제가 물에 확산될 때, 친수성기는 극성을 띠는 물 쪽으로 향하고 소수성기는 공기 또는 소수성 물질의 방향으로 위치하여 미셀(micelle) 구조를 형성한다(Lee and Lee, 2015). 소수성 분자 간 상호작용에 의해 소수성기가 집합체를 이루고 친수성기가 표면에 위치하는 미셀이 형성되면 용해성이 증가하는데 열역학적으로 미셀을 형성하는데 적합한 농도를 임계 미셀농도(Critical Micelle Concentration, CMC)라고 한다(Santos et al., 2016). 계면활성제는 식품과 화장품, 유화제, 보습제로 많이 사용되고 있으며, 대표적인 계면활성제로는 ethylene oxide와 linear alkylbenzene 등이 있다(Kim, 2013). 그러나, 이들 물질은 분해가 잘되지 않기 때문에 환경오염의 주요 원인 중의 하나로 대두되고 있으며(Fenibo et al., 2019), 인체에 피부염을 유발하는 문제점도 보고된 바 있다(Kim, 2013).
미생물 유래 계면활성 물질의 종류
생물 계면활성제(biosurfactant)는 살아있는 세포에서 합성되는 양친매성물질 이다(Cho et al., 2011). 미생물에 의해 생산되는 생물 계면활성제의 친수성 부분은 아미노산, 펩타이드, 탄수화물 등으로 구성되며 소수성 부분은 주로 장쇄 지방산으로 구성되어 있다(Santos et al., 2016). 생물 계면활성제는 분자량을 기준으로 당지질(glycolipid), 인지질(phospholipid) 또는 지질단백질(lipopeptide)을 포함하는 저분자 계면활성제(low-molecular-weight microbial surfactant)와 다당류, 단백질, 지질다당류와 같은 고분자 중합체(high-molecular-weight polymer)로 분류된다(Cameotra and Makkar, 2010; Jahan et al., 2020).
당지질(glycolipid)
당지질은 생물 계면활성제 중에서 연구가 가장 활발히 진행되고 있으며, 탄수화물이 장쇄지방산인 aliphatic acid 또는 hydroxy-aliphatic acid와 결합된 형태로 rhamnolipid, trehalolipid, sophorolipid 등이 알려져 있다(Cameotra and Makkar, 2010) (Table 1).
Table 1.
Biosurfactants produced by microorganisms
| Type | Biosurfactants | Microorganisms | References |
| Glycolipid | Rhamnolipid | eudomonas aeruginosa | Zhou et al. (2019) |
| Thermus thermophilus | Řezanka et al. (2011) | ||
| Trehalolipid | Rhodococcus wratislaviensis | Tuleva et al. (2008) | |
| Sophorolipid | Starmerella bombicola | Kurtzman et al. (2010) | |
| Lipopeptide | Polymyxin B | Bacillus polymyxa | Godoy et al. (2019) |
| Gramicidin S | Bacillus brevis | Yang and Yousef (2018) | |
| Lichenysin A | Bacillus licheniformis | Czinkoczky and Nemeth (2020) | |
| Surfactin | Bacillus subtilis | de Faria et al. (2011) | |
|
High-molecular- weight polymer | Emulsan | Acinetobacter calcoaceticus | Mujumdar et al. (2019) |
| Biodispersan | Acinetobacter calcoaceticus | Mujumdar et al. (2019) | |
| Mannoprotein | Saccharomyces cerevisiae | Martínez et al. (2016) |
Rhamnolipid는 하나 또는 두 분자의 rhamnose가 하나 또는 두 분자의 β-hydroxydecanoic acid와 결합한 형태이다(Abdel-Mawgoud et al., 2010; Kaskatepe and Yildiz, 2016) (Fig. 1A). Rhamnolipid 계열의 생물 계면활성제는 대부분 Pseudomonas aeruginosa 균주에 의해 생산 되며(Costa et al., 2010; Zhou et al., 2019), 구조에 따라 mono- 또는 di-rhamnolipid로 구분된다(Sekhon Randhawa and Rahman Pattanathu, 2014). Thermus thermophilus, Methanobacterium thermoautotrophicum, Acinetobacter calcoaceticus, Pseudoxanthomonas sp., Enterobacter sp., Burkholderia sp. 등의 균주에서 rhamnolipid의 생산이 보고된 바 있다(Abdel-Mawgoud et al., 2010; Řezanka et al., 2011; Rooney et al., 2009).
Trehalolipid는 이당류인 trehalose의 C6와 C6’위치에 마이콜 산(mycolic acid)이 결합한 형태로(Fig. 1B), Rhodococcus 속 균주에서 생산이 보고되었다(Tuleva et al., 2008). 구조에 따라 monocorynomycolate, dicorynomycolate, trehalose tetraester, succinoyl trehalose lipid 등 다양한 종류의 trehalolipid가 있으며(Tuleva et al., 2008), Arthrobacter sp., Nocardia sp., Gordonia sp. 등의 균주에서 생산이 보고되었다(Andrea et al., 2010; Jahan et al., 2020).
Sophorolipid는 sophorose의 C6과 C6’ 위치에 장쇄 수산화지방산(hydroxy fatty acid)이 결합한 구조이며(Gautan and Tyagi, 2005) (Fig. 1C), Starmerella bombicola, Candida apicola, Rhodotorula bogoriensis, Wickerhamiella domercqiae 균주에서 sophorolipid의 생산이 보고되었다(Bogaert et al., 2007; Bogaert et al., 2011).
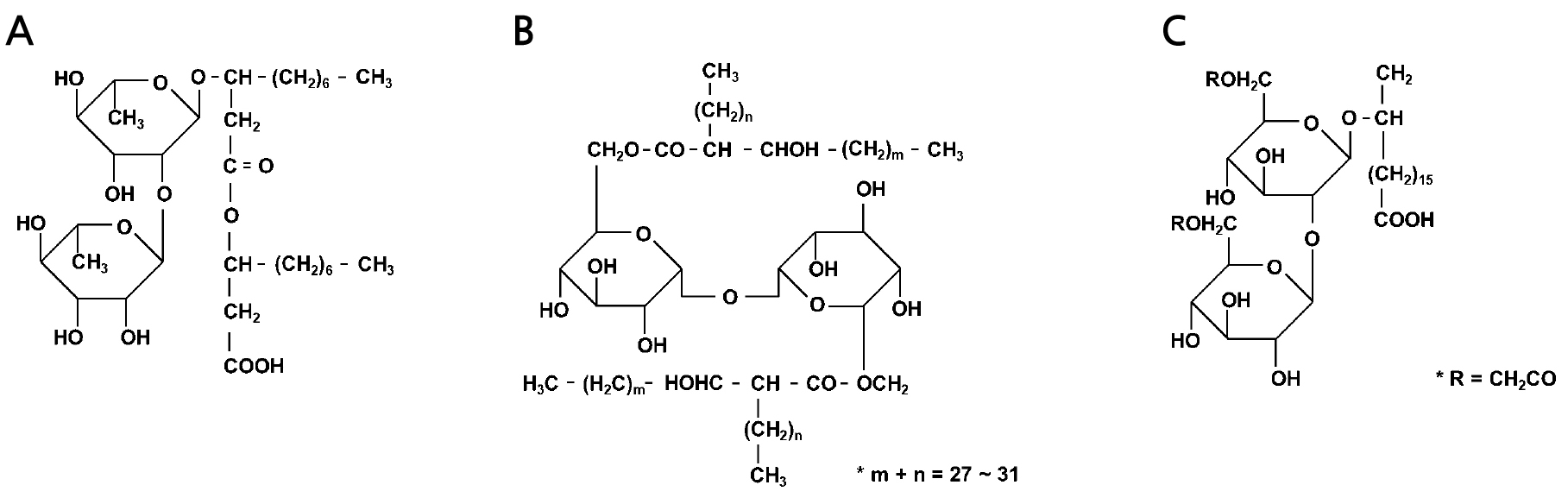
Fig. 1
Structure of rhamnolipid (A), trehalolipid (B), and sophorolipid (C) produced by microorganisms (Desai and Banat, 1997).
지질 펩타이드(lipopeptide)
지질 펩타이드는 7개 내외의 아미노산으로 이루어진 펩타이드와 β-amino fatty acid 또는 β-hydroxy fatty acid를 포함하는 구조이며(Jahan et al., 2020), 고초균에서 가장 많은 연구결과가 보고되었다(Hamley, 2015).
Bacillus polymyxa 균주는 decapeptide와 지방산이 결합된 polymyxin를 생산하며(Godoy et al., 2019), Bacillus brevis 균주는 cyclic decapeptide인 gramicidin S를 생산한다(Yang and Yousef, 2018). Bacillus subtilis 균주가 생산하는 surfactin은 환형의 지질 펩타이드로 우수한 계면활성을 가지고 있으며(de Faria et al., 2011) (Fig. 2A), Bacillus licheniformis 균주가 생산하는 lichenysin A는 surfactin 과는 다르게 탄소원 말단 아미노산이 이소류신(isoleucine)이며 surfactin보다 낮은 임계미셀농도에서 물의 표면장력을 감소시키는 것으로 알려져 있다(Czinkoczky and Nemeth, 2020).
고분자 중합체(high-molecular-weight polymer)
유화제는 계면활성제의 일종으로써 유류를 수용액에 유화시킬 수 있는 물질로(Alizadeh-Sani et al., 2018), emulsan, liposan, mannoprotein 및 다당류-단백질 복합체 등이 있다(Alizadeh-Sani et al., 2018; Cameotra and Makkar, 2010; Jahan et al., 2020).
Acinetobacter calcoaceticus RAG-1 균주에 의해 생산되는 emulsan은 음전하를 띠는 양친매성 다당류로써(Mujumdar et al., 2019), 에스테르기가 공유결합으로 연결된 장쇄지방산과 함께 삼당류가 반복적으로 결합된 중합체를 형성한다(Mujumdar et al., 2019; Zhang et al., 1997) (Fig. 2B).
A. calcoaceticus A2 균주에 의해 생산되는 biodispersan은 세포 밖에 위치한 다당류로써, 수용액 내에서 CaCO3 및 TiO2를 분해할 수 있는 것으로 보고되었다(Mujumdar et al., 2019). Candida lipolytica 균주는 83%의 탄수화물과 17%의 단백질로 구성된 liposan을 생산하며 식물성 기름의 에멀젼을 안정화시킨다(Santos et al., 2016). Saccharomyces cerevisiae, Kluyveromyces marxianus 균주가 생산하는 mannoprotein 등의 생물유화제와 관련된 연구결과도 보고되고 있다(Alizadeh-Sani et al., 2018; Martínez et al., 2016).
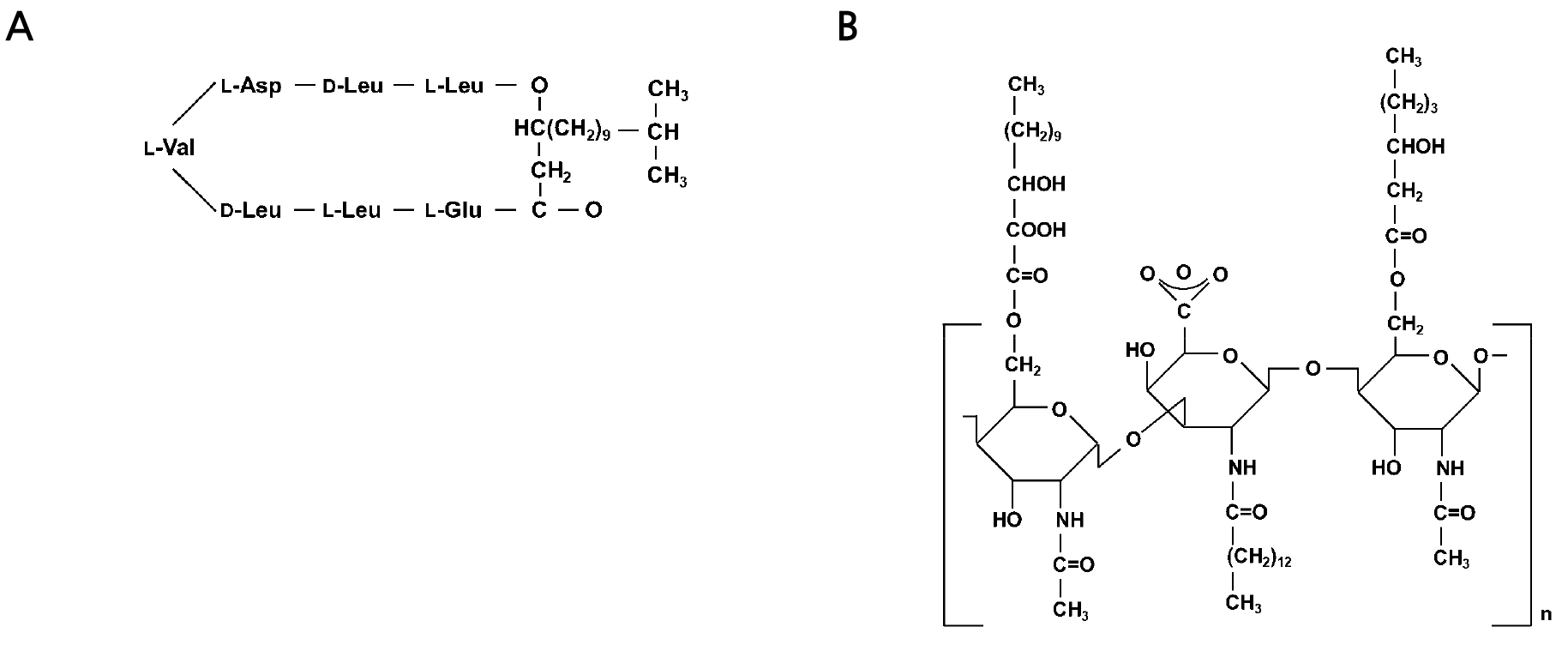
Fig. 2
Structure of surfactin produced by Bacillus subtilis (A) and emulsan produced by Acinetobacter calcoaceticus (B) (Desai and Banat, 1997).
미생물 유래 계면활성 물질의 생산
배양조건
미생물에 의한 생물 계면활성제 생산은 온도, pH, 교반속도와 같은 배양조건에 의해 영향을 크게 받는 것으로 알려져있다(Jahan et al., 2020; Santos et al., 2016).
Pseudomonas sp. Z1 균주는 30°C에서 약 50%의 표면장력 감소를 보였고(Chang et al., 2011). B. subtilis JK-1 균주는 45°C에서도 우수한 표면장력 감소를 나타냈다(Kim, 2011)(Fig. 3A). 반면, Bacillus velezensis LP-3 균주는 37°C에서 2.14 g/L의 lipopeptide로 가장 우수한 생산량을 나타냈으며, 45°C 대비 약 6배 이상 증가된 생산량을 나타냈다(Meena et al., 2018)(Table 2).
Pseudomonas sp. Z1 균주는 pH 6-7에서 표면장력 감소능이 가장 우수하였으며(Chang et al., 2011), B. subtilis JK-1 균주는 pH 6-10의 넓은 pH의 범위에서 표면장력 감소능이 우수하였다(Kim, 2011)(Fig. 3B). 또한, B. velezensis LP-3 균주는 pH 7.0 에서 lipopeptide의 생산량이 가장 높았으며 2.08 g/L를 생산하였다(Meena et al., 2018)(Table 2). Candida sp. NRRLY-27208 균주는 교반속도 300 rpm에서 sophorolipid의 생산량이 가장 우수한 반면, S. bombicola NRRL Y-17069 균주는 400 rpm에서 생산량이 가장 우수하였다(Kurtzman et al., 2010)(Table 2).
Table 2.
Effects of cultivation conditions on biosurfactant production
| Strain | Biosurfactant | Cultivation conditions |
Maximum production (g/L) | References | |
| S. bombicola NRRL Y-17069 | Sophorolipids |
Shaker speed |
150, 200, 250, 300, 350, 400 rpm | 76.4 (400rpm) | Kurtzman et al. (2010) |
| Candida sp. NRRL Y-27208 | Sophorolipids |
Shaker speed |
150, 200, 250, 300, 350, 400 rpm | 30.9 (200rpm) | |
| B. velezensis LP-3 | Lipopeptide | Temperature |
25°C, 30°C, 37°C, 40°C, 45°C | 2.14 (30°C) | Meena et al. (2018) |
| pH | pH4, 5, 6, 7, 8, 9 | 2.08 (pH 7) | |||
|
Carbon source |
Sorbitol, Maltose, Fructose, Glucose, Starch, Sucrose | 1.85 (Sorbitol) | |||
|
Nitrogen source |
Beef extract, Yeast extract, Peptone, (NH4)2SO4, NH4Cl, NH4NO3 |
1.90 (Beef extract) | |||
| B. amyloliquefaciens MB199 | C15-Surfactin |
Carbon source |
Sucrose, Glucose, Mannitol, Glycerol, Starch, Dextrin, Maltose | 0.10 (Sucrose) | Liu et al. (2012) |
|
Nitrogen source |
NH4NO3, (NH4)2SO4, Peptone, Soybean flour, C5H8NO4Na, Casein acids hydrolysate |
0.10 (NH4NO3) | |||
| P. nitroreducens | Rhamnolipid |
Carbon source |
Glucose, Diesel, Glycerol, Sucrose, Palm oil, Groundnut oil | 5.27(Glucose) | Onwosi and Odibo (2012) |
|
Nitrogen source |
NaNO3, Yeast extract, Urea | 4.40 (NaNO3) | |||
| P. aeruginosa EM1 | Rhamnolipid |
Carbon source |
Glucose, Glycerol, Olive oil, Soybean oil, Oleic acid, Hexane, Sucrose | 7.50 (Glucose) | Wu et al. (2008) |
|
Nitrogen source |
NaNO3, Urea, Yeast extract, NH4Cl | 8.63 (NaNO3) | |||
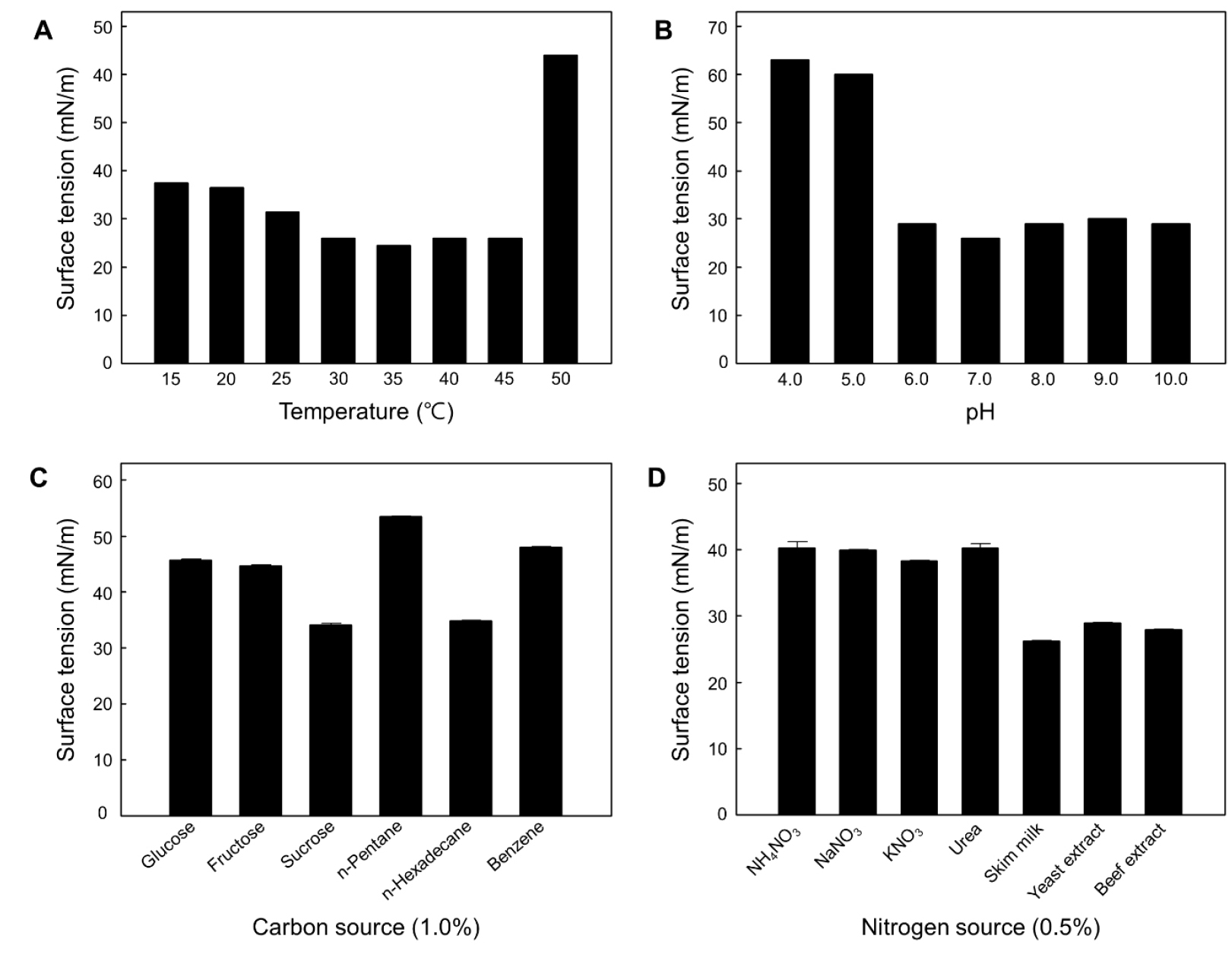
Fig. 3
Effects of cultivation temperature (A) and pH (B) on surface tension in B. subtilis JK-1 culture. The medium included 1% soluble starch, 0.5% skim milk, and 0.1% KNO3 (Kim, 2011). Effects of various carbon sources (C) and nitrogen sources (D) on the surface tension by B. subtilis JK-1. Cells were grown at the indicated conditions for 96 h with an agitation speed of 200 rpm at pH 7 and 35 °C (Joo and Kim, 2011).
탄소원
탄소원은 미생물의 성장과 생물 계면활성제의 생산에 가장 중요한 역할을 한다(Santos et al., 2016). 생물 계면활성제 생산에 탄수화물, 탄화수소 등의 탄소원이 사용되며, 탄수화물로써 대사가 용이한 포도당, 설탕이 이용된다(Nurfarahin et al., 2018).
Bacillus amyloliquefaciens MB199 균주는 설탕을 이용하였을 때, 포도당 대비 1.8배 증가된 0.102 g/L의 surfactin을 생산하였으며(Liu et al., 2012), B. velezensis LP-3 균주는 sorbitol 이용하여 1.85 g/L의 lipopeptide를 생산하여 설탕 대비 1.7배 이상 우수한 생산성을 나타냈다(Meena et al., 2018). B. subtilis JK-1 균주는 탄화수소인 n-hexadecane 뿐만 아니라 설탕을 이용하였을 때도 비슷한 수준의 표면장력 감소능을 나타내었다(Joo and Kim, 2011)(Fig. 3C). P. aeruginosa EM1 균주는 포도당을 첨가하였을 때, 7.5 g/L의 rhamnolipid를 생산하여 글리세롤 대비 1.5배 이상, 설탕 대비 100배 이상 증가된 생산량을 나타냈으며(Wu et al., 2008), Pseudomonas nitroreducens 균주도 포도당을 사용하였을 때 생물 계면활성제 생산량이 가장 우수하였다(Onwosi and Odibo, 2012)(Table 2).
최근에는 고가의 탄소원을 대체하기 위해 지질과 탄수화물 함량이 높은 농업 및 산업 폐기물을 이용한 생물 계면활성제 생산 연구가 보고되고 있다(Nurfarahin et al., 2018; Santos et al., 2016). P. aeruginosa MTCC2297 균주는 오렌지 껍질을 원료로 이용하여 9.18 g/L의 rhamnolipid를 생산하였고(George and Jayachandran, 2009), S. bombicola MTCC1910 균주는 부산물로 폐기되는 해바라기 기름과 포도당을 탄소원으로 이용하여 51.5 g/L의 sophorolipid를 생산하였다(Jadhav et al., 2019). B. subtilis ATCC6051 균주는 발효 부산물로부터 0.21 g/L의 surfactin을 생산하였다(Nazareth et al., 2020).
질소원
미생물의 성장과 생물 계면활성제의 생산에 영향을 미치는 질소원은 유기질소원(yeast extract, beef extract, tryptone, peptone)과 무기질소원(NH4NO3, NaNO3, (NH4)2SO4, KNO3)이 있다(Nurfarahin et al., 2018). B. subtilis JK-1 균주는 무기질소원보다 유기질소원인 효모추출물(yeast extract)을 사용하였을 때 표면장력을 더 큰 폭으로 감소시켰으며(Joo and Kim, 2011)(Fig. 3D), B. velenzensis LP-3은 Beef extract를 이용하였을 때, 1.9 g/L의 우수한 lipopeptide 생산량을 나타냈다(Meena et al., 2018)(Table 2). 반면, B. amyloliquefaciens MB199 균주는 무기질소원인 NH4NO3를 이용하였을 때 surfactin 생산성이 유의적으로 증가하였다(Liu et al., 2012). P. nitroreducens 균주는 질소원으로 NaNO3를 첨가하였을 때 4.4 g/L의 rhamnolipid를 생산하였으며(Onwosi and Odibo, 2012) P. aeruginosa EM1 균주는 NH4Cl를 첨가하였을 때 8.63 g/L를 생산하여 유기질소원인 yeast extract보다 무기질소원에서 약 3.8배 우수한 생산성을 나타냈다(Wu et al., 2008).
탄소원/질소원(C/N) 비율
탄소원/질소원(C/N) 비율은 생물 계면활성제 생산에 필요한 탄소원과 질소원의 비율을 의미하는데, 미생물을 배양할 때 탄소원과 질소원의 비율을 조절하여 생물 계면활성제의 생산성을 증가시키기 위한 연구결과가 지속적으로 보고되고있다(Nurfarahin et al., 2018; Santos et al., 2016). P. nitroreducens 균주는 포도당과 NaNO3의 비율을 22로 조정하였을 때 5.5 g/L의 최대 생산량을 나타냈으며(Onwosi and Odibo, 2012), B. subtilis 균주는 포도당과 NH4NO3의 비율을 3으로 조정하여 최대 46%의 표면장력 감소능을 나타냈다(Fonseca et al., 2007). Bacillus sp. BMN14 균주는 포도당과 NH4NO3의 비율이 12.36일 때 34% 표면장력 감소능을 나타냈다(Heryani and Putra, 2017).
유전자 재조합기술을 이용한 생물 계면활성 물질의 생산
생물 계면활성제는 미생물에 의해 생합성되는 대사산물로써 산업적, 환경적 응용에 큰 잠재력을 가지고 있지만, 낮은 수율과 생산성은 여전히 산업화의 걸림돌로 작용하고 있다(Jung et al., 2012). 이러한 문제를 해결하기 위해 유전자 재조합 기술을 이용한 생물 계면활성제 생산이 제안되고 있다(Chong and Li, 2017).
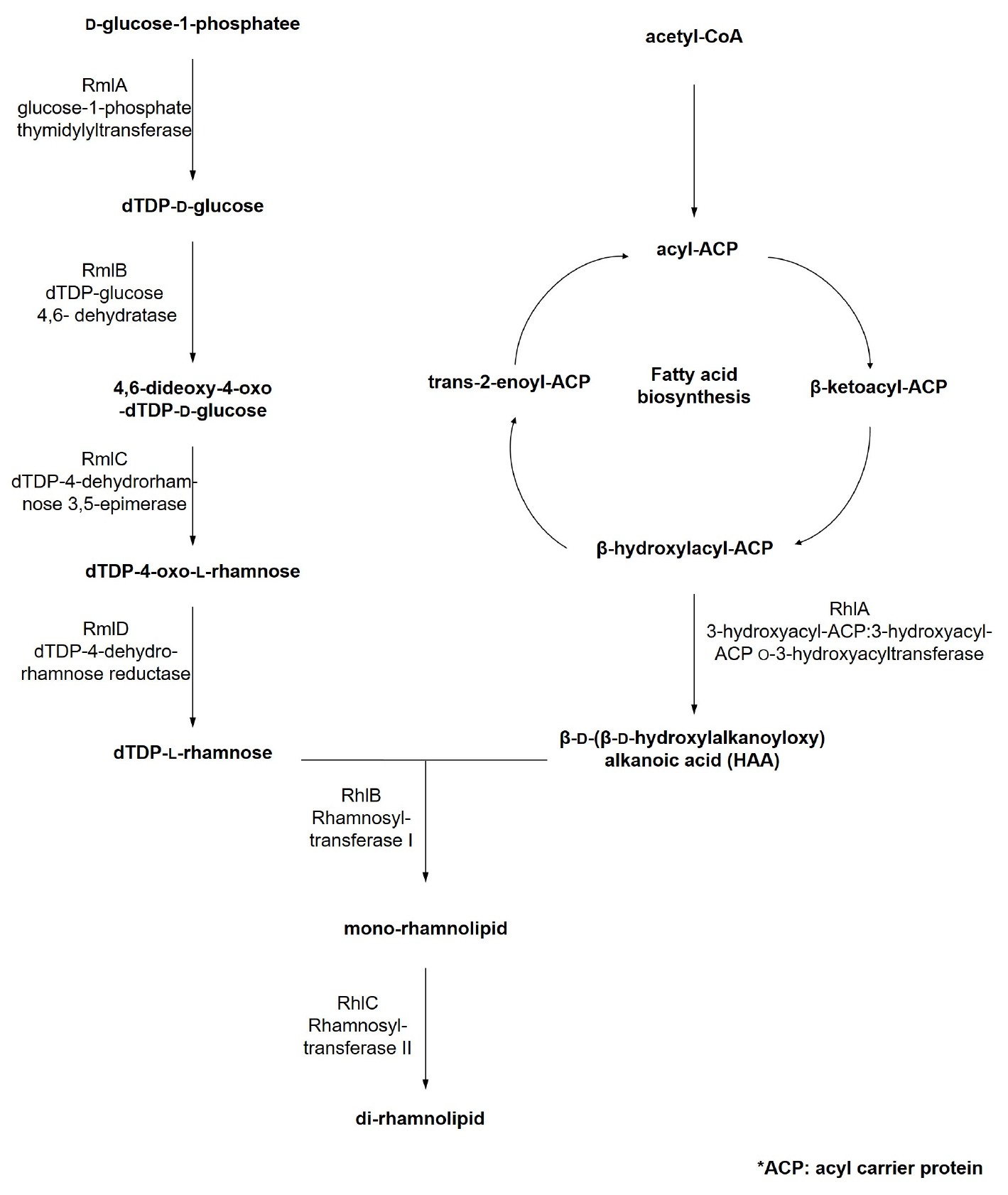
P. aeruginosa 균주는 두가지 경로에 의해 rhamnolipid를 생합성한다(Abdel-Mawgoud et al., 2010). 첫번째는 glucose-1-phosphate가 rmlABCD 오페론에 의해 dTDP-1-rhamnose로 전환되어 rhamnolipid의 친수성부분이 생합성되는 경로이며, 두번째는 acyl 운반단백질(acyl carrier protein, ACP)와 결합된 β-hydroxy fatty acids 2분자가 RhlA에 의해 결합되어 소수성 부분인 3-(3-hydroxyalkanoyloxy)alkanoic acids(HAA)이 생합성되는 경로이다. 이후 RhlB와 RhlC 효소에 의해 친수성 부분과 소수성 부분이 연결되어 mono- 또는 di-rhamnolipid를 형성한다(Abdel- Mawgoud et al., 2010)(Fig. 4).
생물 계면활성제의 생산의 수율을 높이기 위하여 P. aeruginosa 균주의 rhlA 및 rhlB 유전자를 확보하여, Burkholderia kururiensis 균주에서 과발현 하였을 때, rhamnolipid의 생산이 600% 이상 증가하였다(Tavares et al., 2013). P. aeruginosa 균주 유래의 rhamnolipid 합성 유전자 5개(rmlA, rmlB, rmlD, rhlA, rhlB)를 확보하여 비 병원성 균주인 S. cerevisiae 균주에서 발현시켜 rhamnolipid 생합성을 확인할 수 있었는데, 이 균주는 비교적 저렴한 설탕을 탄소원으로 이용할 수 있으며, 발효 중 독성물질이 생산되지 않아 생산 공정의 비용을 감소시킬 수 있는 가능성을 제시하였다(Bahia et al., 2018).
Surfactin의 합성 경로는 지방산 생합성 경로를 통해서 acyl-CoA를 활성화 하는 단계와 분지쇄아미노산 생합성경로를 통해 아미노산을 합성하는 경로로 나뉘어 진다. Surfactin synthase(SrfA)에 의해 아미노산이 acyl-CoA에 연속적으로 결합하여 최종적으로 surfactin이 합성된다(Roongsawang et al., 2011; Tapi et al., 2010)(Fig. 5).
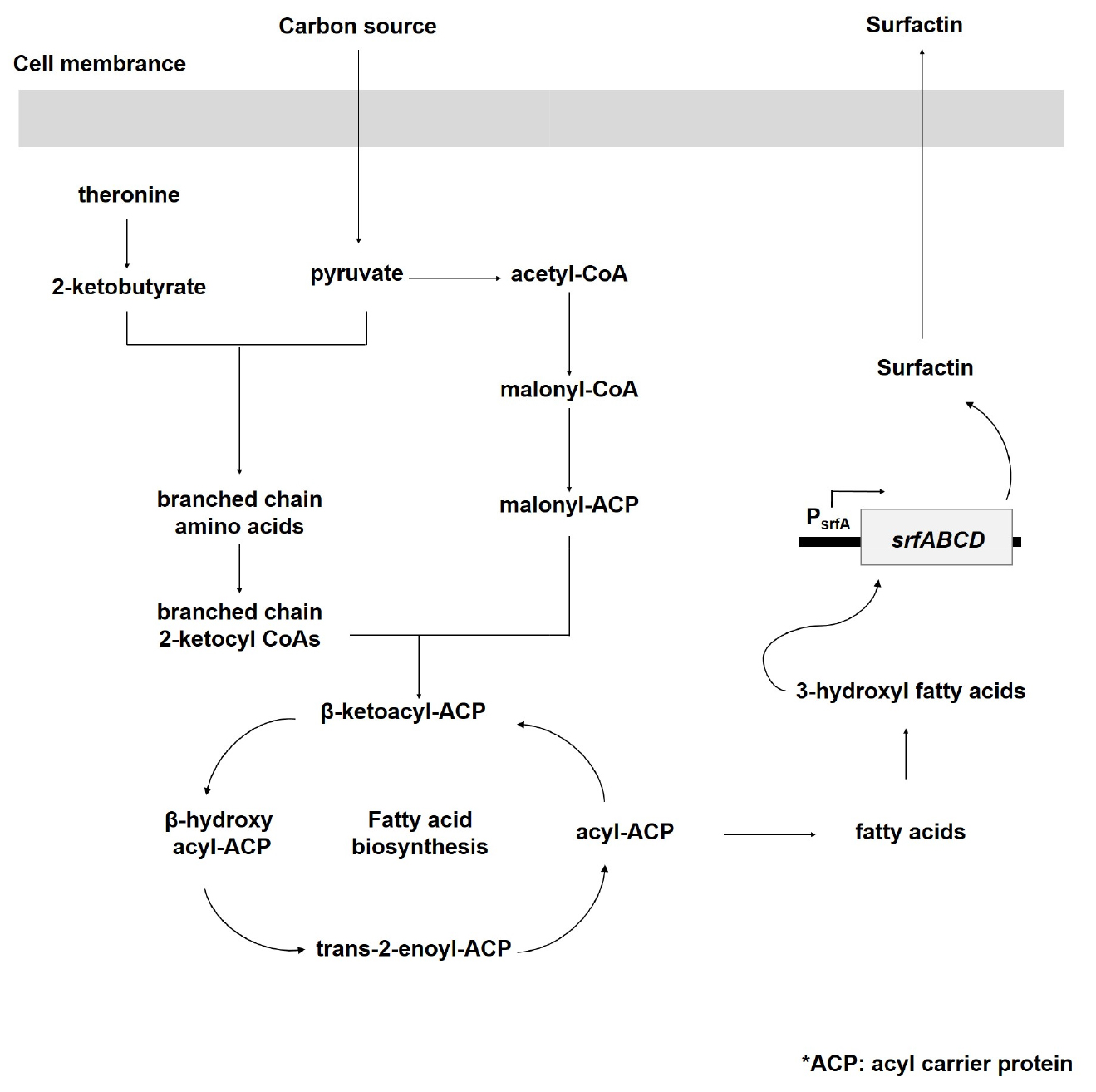
Fig. 5
Schematic representation of surfactin biosynthetic pathway in Bacillus subtilis (Jung et al., 2012).
Bacillus sp. SK320 균주에서 surfactin을 생합성하는 유전자인 srfA를 확보한 후, Escherichia coli 균주에 도입하여 surfactin의 생산을 시도한 경우 모균주인 Bacillus sp. SK320 균주와 비교하여 2배 많은 생산량을 나타냈다(Khanna et al., 2009). 또한, B. subtilis THY-7의 srfA 유전자 발현을 촉진시키는 프로모터 유전자 PsrfA를 Pg3로 대체하였을 때, 생산된 surfactin 농도가 8.61 g/L로서 대조구 대비 약 15.6배 증가된 생산량이 보고되었다. B. subtilis 1012WT 균주의 생물 계면활성제 생산을 증대시키기 위해 세포 외 신호전달 펩타이드를 암호화하는 유전자인 comX 및 phrC를 과발현하여 계면활성제 생산량을 6.7배 증가시킨 결과도 보고되었다(Jung et al., 2012)(Table 3).
Table 3.
Genetic engineering strategies for biosurfactant production
| Biosurfactant | Description | References |
| Rhamnolipid | Insertion of the P. aeruginosa rhlA, rhlB gene into B. kururiensis. | Tavares et al. (2013) |
| Insertion of the P. aeruginosa rmlA, rmlB, rmlD, rhlA, and rhlB into S. cerevisiae. | Bahia et al. (2018) | |
| Surfactin | Insertion of the Bacillus sp. srfA gene into E. coli. | Khanna et al. (2009) |
| Overexpression of comX, phrC in B. subtilis. | Jung et al. (2012) | |
| Replacement of PsrfA to Pg3 in B. amyloliquefaciens. | Jiao et al. (2017) |
미생물 유래 계면활성제의 기능과 산업적 이용
토양 복원
토양입자에 유기물질, 탄화수소 등이 흡수되거나 표면에 불용성 상태로 부착되면 토양을 오염시키게 되는데 계면활성제의 첨가는 유기물질과 탄화수소를 미셀속에 용해하여 토양입자 표면의 소수성을 변화시킴으로써 토양을 복원할 수 있다(Fenibo et al., 2019; Mao et al., 2015). 미생물들은 세포 표면에 부착된 계면활성 물질의 소수성 부분을 내외부로 노출시킬 수 있기 때문에 표면 소수성을 증가 또는 감소시킬 수 있는 것으로 알려져 있으며, 이러한 성질을 이용하여 탄화수소 및 원유(crude oil)로 오염된 토양을 생물학적으로 복원한 결과가 보고되었다(Rufino et al., 2013).
C. lipolytica 균주가 생산한 rufisan은 석유에 의하여 오염된 토양을 30%이상 정화하였고(Rufino et al., 2013), Gordonia sp. 균주는 bioemulsan을 생산하여 원유와 방향족 탄화수소의 분해를 촉진하였다(Franzetti et al., 2009). 이런한 생물 계면활성제의 특성은 중금속 및 방사선 핵종에 오염된 토양을 복원할 수 있을것으로 기대되고 있다(Jahan et al., 2020; Santos et al., 2016).
유류 회수
기존의 석유 추출은 산화에틸렌을 이용하는 방법으로 유류의 생산성을 증가시켰으나(Jung et al., 2018), 이 과정에서 발생하는 환경적, 경제적인 문제로 인하여 미생물을 이용하는 석유 회수 기술(Microbial Enhanced Oil Recovery, MEOR)에 대한 관심이 점차 높아지고 있다(Silva et al., 2014). MEOR 공정은 생물 계면활성제를 생산하는 균주를 원유가 저장된 위치에 주입하여 사암의 유막을 분해하고 표면장력을 감소시킴으로써 원유가 모세관 현상에 의해 누출되는 것을 방지하여 회수율을 높이는 기술이다(Santos et al., 2016; Sarafzadeh et al., 2014; Silva et al., 2014).
B. subtilis B20 균주는 실험실 수준의 코어주입실험(core flooding experiments)을 통해 오일 회수율을 9.7% 증가시켰으며(Al-Bahry et al., 2013), Aneurinibacillus aneurinilyticus SBP-11 균주는 원유가 함유된 모래에서 49-81%의 회수율을 나타냈다(Balan et al., 2017). 중유(heavy oil)는 높은 점도로 인해 금속 파이프라인을 통한 원유의 이동성이 감소하게 되는데 생물 유화제인 emulsan은 중유의 점도를 감소시켜 원유의 이동성을 개선시키는 것으로 보고되었다(Mazaheri Assadi and Tabatabaee, 2010).
의약품
생물 계면활성제는 항균, 항바이러스, 항접착제, 효소 억제제로 의약품에 광범위하게 사용되고 있다(Banat et al., 2014; Joshi-Navare and Prabhune, 2013; Smith et al., 2020). B. polymyxa가 생산하는 polymyxin은 그람음성 간균으로 인한 감염치료에 사용되며, P. aeruginosa, Acinetobacter baumannii, Klebsiella pneumoniae 또는 Stenotrophomonas maltophilia와 같은 약물내성 균주로 인한 질병의 치료제로서도 이용되고 있다(Giamarellou and Poulakou, 2009). B. brevis균주가 생산하는 gramicidin A는 항생물질의 일종으로 그람양성균을 억제하지만 독성이 있어 감염치료를 위해 국소적으로 사용되고 있다(Khandelia et al., 2008). B. subtilis 균주가 생산하는 iturin A는 K562 골수성 백혈병 세포의 사멸을 억제함으로써 만성 골수성 백혈병 치료제로 잠재력을 나타낸 바 있다(Zhao et al., 2018). Rodococcus ruber IEGM231 균주가 생산하는 당지질 계면활성제는 인터루킨(IL-12, IL-18)을 활성화하여 항염증 효과를 나타내기도 했다(Chereshnev et al., 2010).
식품첨가물
생물 계면활성제는 점도 향상, 병원성 미생물 증식 억제, 빵반죽의 질감 개선의 목적으로 식품산업에서 다양한 활용 가능성을 나타낸 바 있다(Nitschkea and Costa, 2007). B. subtilis SPB1 균주가 생산하는 생물 계면활성제는 쿠키의 응집력을 상용 계면활성제 보다 약 1.5배 향상시켰으며(Zouar et al., 2016), Candida utilis UFPEDA1009 균주가 생산하는 생물 계면활성제는 쿠키에 첨가되었을 때 견고성을 20% 이상 감소시켜 쿠키의 질감을 개선하였다(Ribeiro et al., 2020). 또한, C. utilis UFPEDA1009 균주의 생물 계면활성제는 마요네즈의 제형을 30일 동안 유지하여 식품유화제로써 사용가능성을 제시하였다(Campos et al., 2015).
Lactobacillus plantarum CFR2194 균주가 생산하는 생물 계면활성제는 식품위해균인 E. coli, Yersinia enterocolitica, Staphylococcus aureus에 대해 생육억제 효과를 나타내어 식품의 안전성을 높일 수 있는 첨가제로써 제안되었다(Madhu and Prapulla, 2014).
결 론
석유로부터 생산되는 계면활성제는 계면장력 또는 표면장력을 감소시키는 물질로서 의약품, 식품, 화장품 등 다양한 산업에서 사용되고 있지만 독성이 있거나 쉽게 생분해 되지 않는 단점이 있다. 반면, 미생물이 생산하는 생물 계면활성제는 낮은 독성과 우수한 생분해성으로 다양한 산업 분야에서 이용을 위한 연구가 꾸준히 보고되고 있다. 본 문헌 연구에서는 다양한 생물 계면활성제의 특성과 생산방법 등 최근의 문헌을 조사하였다. 미생물은 당지질(glycolipid), 지질 펩타이드(lipopeptide) 고분자 중합체(high-molecular-weight polymer)등 다양한 형태의 생물 계면활성제를 생산하는 것으로 보고되고 있으며, 탄소원, 질소원, 온도 및 산도와 같은 미생물 배양조건이 생물 계면활성제 생산에 크게 영향을 미치는 것으로 나타났다. 또한, 재조합 유전자 기술을 이용한 생물 계면활성제의 생산에 관한 연구결과도 보고되고있다. 이러한 생물 계면활성제는 원유회수, 토양복원, 식품산업 등에 사용되기 위한 발판을 마련하고 있으며, 생산단가 절감을 통해 보다 다양한 산업에 적용이 가능할 것으로 기대된다.