서 론
재료 및 방법
호염성 고온균 분리 및 배양
16S rDNA 염기서열의 계통학적 분석
세포외 분해 효소 생산능 분석
옥신(Auxin) 생산능 분석
결과 및 고찰
호염성 고온균 분리
16S rDNA 염기서열 분석을 통한 분리 균주 동정
세포외 분해효소 및 옥신 생산 활성 분석
서 론
최근 다양한 산업에서 극한의 조건에서의 생육이나 활성을 나타낼 수 있는 고온성 미생물, 저온성 미생물, 호산성 미생물, 호알칼리성 미생물과 호염성 미생물 등이 포함되는 극한미생물에 대한 관심이 높아지고 있으며 이에 대한 연구도 많이 진행되고 있다(Tango and Islam, 2002). 극한 미생물 중에서 고온성 미생물(thermophile)들은 일반적으로 화산지역이나 온천, 심해 열수구 등에서 분리되고 있으며 moderate thermophiles(최적 생육온도, 50-60°C), extreme thermophiles (최적 생육온도, 60-80°C), 그리고 hyperthermophiles(최적 생육온도, 80-110°C)로 나뉜다(Gupta et al., 2014).
생육환경이 열악한 이런 고온성 미생물들은 고온의 반응 조건과 같이 식품이나 화장품 산업 등에서의 환경 친화적인 생물공정에 사용될 수 있는 열에 안정한 효소들의 창고로 알려져 있으며, 이러한 이유로 인하여 최근 고온성 미생물의 분리나 이들이 생산하는 열에 안정한 가수분해 효소들의 특성이나 활성 검증 관련 연구가 많이 이루어지고 있다(Baltaci et al., 2017; Dettmer et al., 2013; Hmidet et al., 2009; Sen et al., 2010; Singh et al., 2016). 또한 호염성 미생물이 생산하는 단백질 가수분해효소는 염이 많이 포함되어 있는 수산 폐기물을 이용한 동물성 콜라겐과 같은 기능성 소재 개발 분야에서 활용될 수 있기에 이러한 단백질 가수분해효소 또는 이를 생산하는 호염성 미생물을 분리하여 활용하는 방법이 연구되고 있다(Mayuri et al., 2019; Wu et al., 2008).
따라서 본 연구에서는 숯의 제조과정 특성상 일정 시간 높은 온도의 유지가 필수적인 숯가마 주변의 토양 시료로부터 호염성과 호열성을 동시에 가지는 세균의 탐색을 시도하고자 강원도 경원참숯가마에서 숯가마 주변의 토양을 시료로 사용하여 호염성 고온균을 분리하고 이들의 생리학적 특성의 분석과 함께 산업용 효소시장에 응용이 가능한 3종류의 효소(amylase, lipase, protease)의 생산 특성 탐색과 함께 다양한 미생물에 의해 식물호르몬 auxin의 생산이 유도 될 수 있다는 것이 보고(Jung et al., 2006; Jung et al., 2007)되었기에 식물생육을 촉진하는 기능을 가지는 유기농자재로서의 활용 가능성을 확인하기 위한 auxin 생산능 분석을 실시하였다.
재료 및 방법
호염성 고온균 분리 및 배양
강원도 경원참숯가마에서 숯가마 주변의 토양 시료로부터 호염성 미생물 분리를 위해 각각의 샘플을 멸균된 0.85% 생리식염수에 첨가하여 voltexing으로 현탁하였다. 현탁한 샘플 1 ml을 사용하여 10-1-10-4 배로 단계희석 한 후, 일반 증식배지로 해양미생물 전용배지인 marine agar(BD, USA) 배지에 3% NaCl을 첨가한 고체배지를 제작하여 희석액을 도말하여 37°C에서 호기적으로 호염미생물을 배양 후 동일한 고체배지를 사용하여 추가적으로 single colony isolation을 수행하였다. 그리고 분리된 균주의 복합배지에서의 생육 가능성을 확인하기 위하여, nutrient agar(BD, USA), R2A agar(BD, USA), 및 tryptic soy agar(BD, USA)에 평판 도말법을 이용하여 37°C에서 7일간 정치 배양을 하였다. 그리고 분리된 균주들이 호염성 균주로써 12%, 15%와 20% NaCl 농도에서도 생육이 가능한지를 확인하기 위하여 marine agar 배지에 12%, 15%와 20% NaCl을 첨가한 배지를 제작하여 분리 균주들의 생육을 확인하였으며 최적의 생육 pH 조건을 확인하기 위하여 pH를 5, 7, 9로 각각 조절한 marine agar 배지에 분리 균주들의 생육을 확인하였다. 또한 분리된 균주들이 고온에서도 생육이 가능한지를 확인하기 위하여 nutrient agar (BD, USA) 배지를 사용하여 균주들을 획선 도말법으로 접종한 후 45°C, 50°C와 55°C에서 정치배양을 하였다.
16S rDNA 염기서열의 계통학적 분석
국내 숯가마 주변의 토양 시료로부터 호기적 배양 조건에서 분리된 균주들의 분자생물학적 동정을 위해 marine agar (BD, USA) 배지에 각각 분리된 균주의 colony가 배양된 상태의 고체 배지를 ㈜바이오팩트에 보내어 16S rDNA 염기서열의 분석을 의뢰하였으며 분석된 16S rDNA 염기서열로부터 가장 유사한 근연 균주의 확인을 위하여 ㈜천랩의 웹 기반 분석 데이터베이스인 EzBioCloud에 접속하여 16S-based ID 분석 앱(https://www.ezbiocloud.net/)을 사용하였다.
세포외 분해 효소 생산능 분석
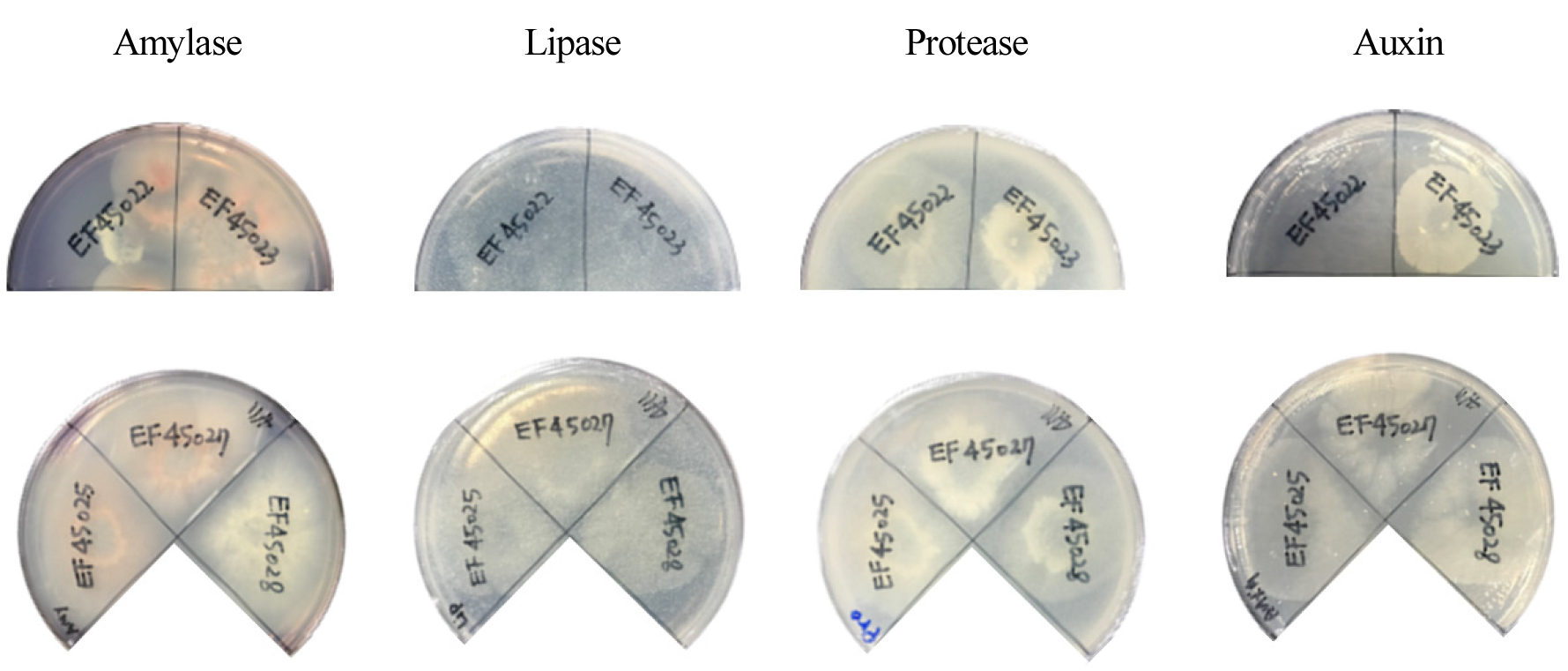
분리된 호염성 고온균들의 세포외 분해 효소 amylase, lipase, protease 생산능 확인을 위하여 각각의 효소와 특이적으로 반응할 기질 성분이 포함된 고체평판 선별배지를 사용하였다. 먼저 amylase 생산능은 0.2% soluble starch(BD, USA)를, lipase 생산능은 1% Tween 80(Sigma, USA)을, protease 생산능은 2% skim milk(BD, USA)를 기질로 선택하여 marine agar(BD, USA) 배지에 각각 첨가하여 제조하였으며 분리된 균주를 직접 접종하여 37°C에서 7일 배양한 후 투명환(Clear zone)의 직경으로 조사하였다. 분리된 균주의 효소활성 분해능 평가는 배양 후 나타나는 접종균 주위의 투명환의 크기(+++ : > 7 mm, ++ : 4-6 mm, + : 1-3 mm)로 나타내었다.
옥신(Auxin) 생산능 분석
분리된 균주의 auxin 생산능은 0.1% L-tryptophan이 첨가된 Marin broth(BD, USA) 배지에 순수 분리된 콜로니를 tooth-picking 한 후 37°C에서 5일 배양하여 Salkowski 시약(35% HClO4 50 ml + 0.5 M FeCl3 1 ml) 800 μl을 배양 상등액 400 μl 에 섞어준 후 어두운 곳에서 30 min 반응시켜 육안으로 확인하여 붉은 색깔 변화 정도에 따라 옥신 생성능 정도를 표시하였다(짙은 붉은색: +++; 일반 붉은색: ++; 옅은 붉은색: +; 주황색: w; 무색:-).
결과 및 고찰
호염성 고온균 분리
국내 숯가마 주변의 토양 시료로부터 먼저 호기적인 호염성 미생물을 분리하고자 marine agar 배지에 시료를 희석한 후 도말하여 정치배양을 하고 배양된 콜로니를 다시 동일한 고체배지를 사용하여 2차로 단일 콜로니 분리를 수행하였다. 실험 결과 Table 1에서 나타낸 것처럼 숯가마 주변의 토양 시료로부터 호염성 미생물로 예상되는 5균주가 순수 분리되었다.
분리된 균주가 호염성 미생물로 높은 염 농도에서도 생육이 가능한지를 확인하기 위하여 marine agar 배지에 12%, 15%와 20% NaCl을 각각 첨가한 배지를 제작하여 분리 균주들의 생육을 확인한 결과, 하나의 균주(No. 1)는 모든 실험 조건에서 생육을 할 수 없었으나 나머지 분리 균주들은 12%와 15% NaCl 조건에서 생육이 가능한 것을 확인하였으며 이는 분리된 균주 중 4균주는 높은 염 농도에서도 생육이 가능한 초호염성 미생물임을 확인하였다. 또한 최적의 생육 pH 조건을 확인하기 위하여 pH를 5, 7, 9로 각각 조절한 marine agar 배지에 분리 균주들의 생육을 확인한 결과 분리된 모든 균주가 pH7에서는 생육이 가능하였으나 약산성(pH5) 조건에서는 생육을 할 수 없음을 확인하였으며 이중 3 균주(No. 2, 3, 5)는 pH9에서도 생육이 가능(weak growth 제외)한 것을 확인하였다(Table 1).
Table 1.
Isolation and identification of aerobically cultured bacteria isolated from the soil around charcoal kilns
| No |
Isolate number | Media | MA* | |||||||||||||
| NA# | R2A | TSA | Temp. (°C) | pH | NaCl (%) | |||||||||||
| 45 | 50 | 55 | 5 | 7 | 9 | 12 | 15 | 20 | ||||||||
| 1 | EF45022 | +a | + | + | + | + | + | -c | + | wb | - | - | - | |||
| 2 | EF45023 | + | + | + | + | + | + | - | + | + | + | + | - | |||
| 3 | EF45025 | + | + | + | + | + | + | - | + | + | + | + | - | |||
| 4 | EF45027 | + | + | + | + | + | + | - | + | w | + | + | - | |||
| 5 | EF45028 | + | + | + | + | + | + | - | + | + | + | + | - | |||
그리고 대다수의 배지 구성성분이 무기염인 marine agar 배지는 해양 유래 미생물들의 배양에 적합한 배지이기에 산업적으로 미생물 배양에 적용하기에는 단점을 가진 배지이며 산업적으로 미생물들의 대량 배양에 사용되는 복합 배지에서의 분리 균주들의 생육 가능성 검증을 통한 산업적 활용가능성을 확인하기 위하여 복합 배지(nutrient agar, R2A agar, tryptic soy agar)에서의 분리 균주들의 생육 가능성을 확인한 결과 분리된 5균주 모두 사용된 모든 복합 배지에서 생육이 가능한 것을 확인하였다.
또한 분리된 호염성 균주들이 고온균의 특성도 나타내는지 확인을 위하여 복합 배지 중 하나인 nutrient agar 배지에 획선 도말하여 45°C, 50°C와 55°C에서 정치배양한 결과, 5균주 모두 55°C에서 생육이 가능한 moderate thermophile인 것을 확인하였다(Fig. 1).
16S rDNA 염기서열 분석을 통한 분리 균주 동정
강원도 경원참숯가마에서 숯가마 주변의 토양 시료로부터 호기적으로 분리된 호염성 고온균 5균주의 16S rDNA 염기서열을 바탕으로 EzBioCloud의 16S-based ID 분석서비스를 사용하여 미생물 동정을 실시한 결과 5균주 모두 Bacillus sp. 인 것을 확인하였다(Table 2). Table 2에서 나타낸 것처럼 1균주의 Bacillus zanthoxyli와 Bacillus cereus, 3균주의 Bacillus licheniformis가 분리되었으며 상동성은 98.57-99.71%를 나타내었다.
Table 2.
Representative sequences of an aerobically cultured thermophilic bacteria isolated from the soil around charcoal kilns
| No |
Isolate number | Closed strain number | Similarity (%) | Extracellular enzyme activity | Au$ | Deposit number | ||
| Amy# | Lip& | Pro* | ||||||
| 1 | EF45022 | Bacillus zanthoxyli 1433 | 99.71 | +++ | -a | - | - | NMC4-B295 |
| 2 | EF45023 | Bacillus cereus ATCC 14579 | 99.17 | +++ | - | +++ | - | NMC4-B296 |
| 3 | EF45025 | Bacillus licheniformis ATCC 14580 | 98.57 | - | - | + | - | NMC4-B297 |
| 4 | EF45027 | Bacillus licheniformis ATCC 14580 | 98.92 | + | - | +++ | - | NMC4-B299 |
| 5 | EF45028 | Bacillus licheniformis ATCC 14580 | 98.59 | + | - | - | - | NMC4-B300 |
세포외 분해효소 및 옥신 생산 활성 분석
분리된 호염성 고온균 균주들의 amylase, lipase, protease와 같은 세포외 분해효소 활성 유무의 확인을 통한 식품 및 화장품 산업에서의 활용가능성의 검증과 함께 분리된 균주 배양액의 식물생장을 돕는 미생물비료와 같은 유기농자재로써의 활용 가능성의 확인을 위한 옥신 생산 활성을 분석한 결과 Table 2에서 나타낸 것처럼 분리된 다섯 균주 모두 amylase와 protease의 활성이 최소한 한 가지 이상은 나타낸다는 것을 확인하였으나 lipase 활성은 없는 것으로 나타났다. 이중 Bacillus cereus로 동정된 균주(Deposited number: NMC4-B296)와 Bacillus licheniformis로 동정된 균주(Deposited number: NMC4-B299)는 두 가지 효소에 대한 활성을 모두 나타낸 것을 확인하였다(Fig. 2).
그리고 분리된 균주들의 옥신 생산 활성을 확인한 결과, 모든 분리 균주는 생산 활성이 없는 것을 확인하였으며 이는 농업 분야에서의 분리된 균주들의 활용 가능성은 낮을 것으로 예상되었다.
일반적으로 호염성 미생물이나 호열성 미생물의 분리를 위해서 발효식품이나 염전에서 채취한 해양 시료, 화산 지역의 시료나 온천과 같은 고온 시료를 사용한 연구들은 많이 보고되고 있다(Gupta et al., 2014). 하지만 본 연구에서는 일반적인 참숯을 제조하기 위해선 숯가마가 반드시 필요하며 참숯 제조과정의 특수성으로 인하여 숯가마를 일정 기간 높은 온도로 유지해야만 하는 것에 착안하여 숯가마 주변의 토양을 사용하여 호염성의 특성을 가진 고온균을 분리하고자 시도하였으며 5균주를 분리하여 생리학적 특성과 함께 세포외 분해효소 활성 분석을 통하여 산업적 활용 가능성을 검증하였다.
본 연구를 통하여 확인된 결과들은 국내 극한미생물 자원의 다양성 확보 차원에서 큰 의미를 찾을 수 있을 것이며 국내 숯가마 주변 토양 시료에서 높은 염 농도에 내성을 가지며 고온에서의 내성도 가진 세포외 가수분해 효소 탐색을 위한 새로운 극한미생물 탐색 가능성과 분리된 균주들의 전장유전체 분석을 통한 열악한 산업 생물공정에서의 활용이 가능한 가수분해 효소군 확보 및 효소 개량을 위한 기본 미생물 소재로 활용이 가능할 것으로 예상된다. 또한 본 연구를 통하여 분리한 모든 균주들은 한국생명공학연구원 미생물가치제고사업단에 기탁하였다.