서 론
재료 및 방법
균주 분리 및 배양
16S rDNA 염기서열의 계통학적 분석
세포외 분해 효소 생산능 분석
탄소원 자화능 분석
결과 및 고찰
균주 분리 및 생육 특성 분석
분리 균주 동정
세포 외 분해효소 생산 활성 분석
탄소원 자화능 분석
요 약
서 론
단백질가수분해효소(Protease)는 펩타이드 결합의 가수분해를 통해 단백질을 분해하는 효소로 알려져 있으며 현재까지 생물 분류상 세균이 속해 있는 원핵생물로부터 생산되는 단백질가수분해효소들이 다양한 산업에서 기술적으로 많이 활용되고 있다(Harwood and Cranenburgh, 2008). 단백질가수분해효소들이 산업적으로 활용되기 위해선 대량으로 생산할 수 있는 시스템이 필요로 하기에 생산 가격이 중요하며 이를 해결하기 위해 동물 세포나 식물 세포를 활용하는 것보다 환경 변화나 윤리적인 문제로부터 영향을 덜 받는 미생물을 활용하는 경우가 많다. 또한, 미생물에 의해 발현되는 세포외효소는 후속 처리가 더 간단하고 비용이 저렴하기에 일반적으로 선호되고 있다(Tufvesson et al., 2010).
단백질가수분해효소의 미생물 생산자로는 박테리아가 가장 널리 사용되며, 그중 바실러스(Bacillus) 속이 가장 유명한 공급원이며 이는 단백질을 분비하는 특성으로 인해 배지 1 L당 20 g 이상의 단백질을 얻을 수 있기 때문이다(Harwood and Cranenburgh, 2008). 또한, 다양한 Bacillus 종이 생산하는 단백질가수분해효소는 다양한 산업 분야에 사용할 수 있는 독특한 특성을 가지며, 다양한 환경 조건에서 활성을 나타내는 단백질가수분해효소를 생산하며 이러한 우수한 활성과 안정성에 해당하는 광범위한 pH와 온도로 인해 세제 산업 등에 사용되고 있으며 결과적으로 전 세계 효소 판매의 약 60%를 담당하고 있다(Anandharaj et al., 2016; Porres et al., 2002; Rehman et al., 2017). 게다가, Bacillus 균주에서 분리된 단백질가수분해효소는 생물학적 활성 펩타이드의 제조와 다양한 식품 가공을 위한 식품 산업에 사용되고 있으며(Ke et al., 2018; Latiffi et al., 2013), 농업 분야에서 농산물 생산에 따라 발생하는 부산물의 고부가가치 자원화를 위해 이를 기질로 활용하기 위한 발효 균주로의 적용이 가능하기에 바실러스 균주를 이용한 단백질가수분해효소의 생산은 이러한 균주의 경제적 효율성으로 인해 많은 연구가 이루어지고 있다(Shikha and Darmwal, 2007; Shivasharana and Naik, 2012).
최근 일반적인 생육 조건이 아닌 극한의 환경 조건에서 생육이 가능한 극한 미생물이 주목을 받으면서 산업적으로 활용하기 위해 많은 연구가 이루어지고 있으며 온도 관련 극한 미생물, pH 관련 극한 미생물, 염 농도 관련 극한 미생물 등 다양한 극한의 환경 조건에서 극한 미생물을 분리하고 이들 균주에 대한 생리학적 특성을 분석한 연구가 많이 진행되고 있다(Baltaci et al., 2017; Gupta et al., 2014; Lee, 2021). 특히, 고온성 미생물(thermophile)들은 생육환경이 열악한 화산 지역이나 온천 등에서 자주 분리되고 있으며 산업적으로 높은 온도에서 공정이 이루어지는 식품 제조 분야나 화장품 제조 산업 등에서의 친환경적인 제조 공정에 이용될 수 있는 높은 온도에서도 활성을 유지할 수 있는 효소를 생산할 수 있는 보물 창고로 알려져 있기에 최근 고온성 미생물의 분리나 동정, 단백질가수분해효소 등과 같은 효소들의 특성이나 활성 검증 관련 연구가 많이 이루어지고 있다(Dettmer et al., 2013; Hmidet et al., 2009; Lee et al., 2022; Sen et al., 2010; Singh et al., 2016).
따라서 본 연구에서는 충청북도 지역의 능암 탄산 온천 온천수로부터 Bacillus 속 균주의 탐색을 시도하여 균주를 분리하고 동정하였으며 온도에 따른 생육과 복합배지 종류에 따른 세포외 가수분해효소의 생산 특성 탐색과 함께 대량 배양을 위한 배지 최적화를 수행하고자 탄소원 이용 능력을 확인하였다.
재료 및 방법
균주 분리 및 배양
국내 능암 탄산 온천의 온천수로부터 균주 분리를 위해 샘플 1 mL을 사용하여 10배와 100배로 희석하였다. 균주 분리용 배지로 해양미생물 배양용 전용 배지인 marine agar(BD, USA) 배지를 제작한 후 희석 샘플을 도말해 37°C에서 호기적으로 배양하였다. 배양 후 생성된 콜로니는 동일한 고체배지를 사용하여 단일 콜로니 분리을 수행하였다. 그리고 분리된 균주들의 생육 pH 조건을 확인하기 위하여 pH를 4, 7, 9로 각각 조절한 marine agar 배지에 분리 균주들의 생육을 확인하였다. 또한, 분리된 균주들이 복합 배지의 생육 가능성과 함께 생육 온도를 확인하기 위하여 nutrient agar(BD, USA), LB agar(BD, USA), 및 tryptic soy agar(BD, USA)에 평판 도말법을 이용하여 37°C, 45°C, 50°C에서 2일간 정치배양을 하였다.
16S rDNA 염기서열의 계통학적 분석
국내 능암 탄산 온천의 온천수로부터 분리된 균주들의 분자생물학적 동정을 위해 marine agar(BD, USA) 배지에 분리된 균주의 colony가 배양된 상태의 고체배지를 ㈜마크로젠에 보내 16S rDNA 염기서열의 분석을 의뢰하였다. ㈜마크로젠에서 제공한 분석 결과와 함께 제공된 염기서열을 사용하여 ㈜CJ 바이오사이언스의 데이터베이스인 EzBioCloud에 접속하여 16S-based ID 분석 앱(https://www.ezbiocloud.net/)을 사용하여 분리된 균주와 가장 유사한 근연 균주 확인을 위한 분석을 실시하였다.
세포외 분해 효소 생산능 분석
분리된 균주들이 생산하는 세포외 가수분해 효소 3종류(amylase, lipase, protease) 생산 능력을 확인하기 위해 각각의 가수분해 효소와 특이적으로 반응할 기질 성분이 함유된 고체배지를 사용하여 분석하였다. 먼저 amylase 생산 능력을 확인하기 위해 0.2% soluble starch(BD, USA)를 기질로 사용하였으며, lipase 생산 능력은 1% Tween 80(Sigma, USA)을 사용하였으며, 마지막으로 protease 생산 능력은 2% skim milk(BD, USA)를 기질로 선택하여 marine agar(BD, USA) 배지와 함께 앞서 언급한 3종류의 복합 배지에 각각 첨가하여 제조하였다. 분리된 균주를 액체 형태의 각각의 복합 배지에 접종하여 24 h 배양 후 1 mL의 배양액을 사용하여 원심분리 후 배양 상등액을 회수하였다. 회수 후 0.2 um syringe filter(Advantec, Japan)를 한 배양 상등액을 paper disc(Advantec, Japan)에 25 ul 점적한 후 같은 복합 배지로 제조한 가수분해 효소 활성 평가용 고체배지 표면에 올려 37°C에서 2일간 배양한 후 투명환(clear zone)의 직경으로 확인하였으며 투명환의 크기는 디지털 캘리퍼스(CAS, Korea)를 사용하여 측정하였다.
탄소원 자화능 분석
분리된 균주의 생화학적 특성 중 하나인 탄수화물 대사에 사용할 수 있는 탄소원을 확인하기 위하여 API 50 CH kit(Biomerieux, France)를 사용하였다. 제조업체에서 제공하는 표준적인 실험방법에 따라 실시하였으며 실험 결과는 37°C에서 2일간 배양 후 판독하였다.
결과 및 고찰
균주 분리 및 생육 특성 분석
국내 능암 탄산 온천의 온천수로부터 먼저 호기적인 조건에서 미생물을 분리하고자 균주 분리용 배지로 온천수에도 바닷물처럼 미네랄이 많이 포함돼 있을 것으로 생각하여 marine agar 배지에 희석된 시료를 도말하였다. 37°C에서 이틀간 정치 배양한 후 생성된 콜로니를 일회용 백금이를 이용해 다시 marine agar 배지에 접종하고 동일한 조건에서 배양하여 2차로 단일 콜로니 분리를 수행하였다. 그 결과 Table 1에서 나타낸 것처럼 호기적 정치배양을 통해 국내 능암 탄산 온천의 온천수로부터 3균주(분리번호: M510, M518, M578)가 순수분리 되었다. 순수분리된 균주를 5 mL의 marine broth 배지를 사용해 배양하고 균체를 회수한 후 25% glycerol 용액을 사용하여 현탁 후 균주 stock을 제조한 후 -80°C에 보관하며 각각의 실험에 사용하였다.
Table 1.
Isolation and characterization of aerobically cultured bacteria isolated from the Neungam Carbonate Hot Springs
| No |
Isolate number | MA* | Media | |||||||||||||
| pH | NA# | LA$ | TSA | |||||||||||||
| Temp. (°C) | Temp. (°C) | Temp. (°C) | ||||||||||||||
| 4 | 7 | 9 | 37 | 45 | 50 | 37 | 45 | 50 | 37 | 45 | 50 | |||||
| 1 | M510 | -a | +c | + | + | + | + | + | + | + | + | + | + | |||
| 2 | M518 | - | + | + | wb | w | w | + | + | w | + | + | + | |||
| 3 | M578 | - | + | + | + | + | + | + | + | + | + | + | + | |||
다음으로 분리된 균주의 생육 pH 조건의 확인을 위하여 pH를 4, 7, 9로 각각 조절한 marine agar 배지에 분리 균주들을 일회용 백금이를 이용하여 접종하고 37°C에서 2일간 정치 배양한 후 균주들의 성장을 확인한 결과 분리된 모든 균주가 pH7과 pH9에서는 생육이 가능한 것으로 확인되었으나 pH4에서는 균주의 성장이 확인되지 않았으며 이는 분리된 균주들이 중성 이성의 알칼리 조건에서 생육이 가능할 것으로 생각되었다(Table 1).
다음으로 분리된 균주들을 산업적으로 활용하기 위해선 대량 배양을 위한 복합 배지에서의 생육이 가능해야 하기에 이를 검증하기 위해 3종류의 복합 배지(nutrient agar, LB agar, tryptic soy agar)에서의 분리 균주들의 생육 가능성과 함께 생육 온도(37°C, 45°C, 50°C)의 특성을 확인한 결과 M510과 M578 균주는 사용된 모든 복합 배지와 온도 조건에서 생육이 가능한 고온균의 특성을 나타내는 것이 확인되었으나 M518 균주의 경우 nutrient agar 배지에서 모든 온도 조건에서 다른 2균주의 정상적인 성장 결과 대비 낮은 성장 결과를 보였으며 LB agar 배지에서는 37°C와 45°C에서는 정상적인 성장이 확인되었으나 50°C에서는 낮은 성장 결과를 보여 중온균의 특성을 나타내는 것으로 확인되었다. 이는 분리 균주의 산업적 활용을 위해선 균주별로 생리학적 특성 분석을 위한 연구와 대량 배양을 위한 배지 성분의 최적화와 같은 기초 연구가 추가적으로 필요할 것으로 생각되었다(Table 1, Fig. 1).
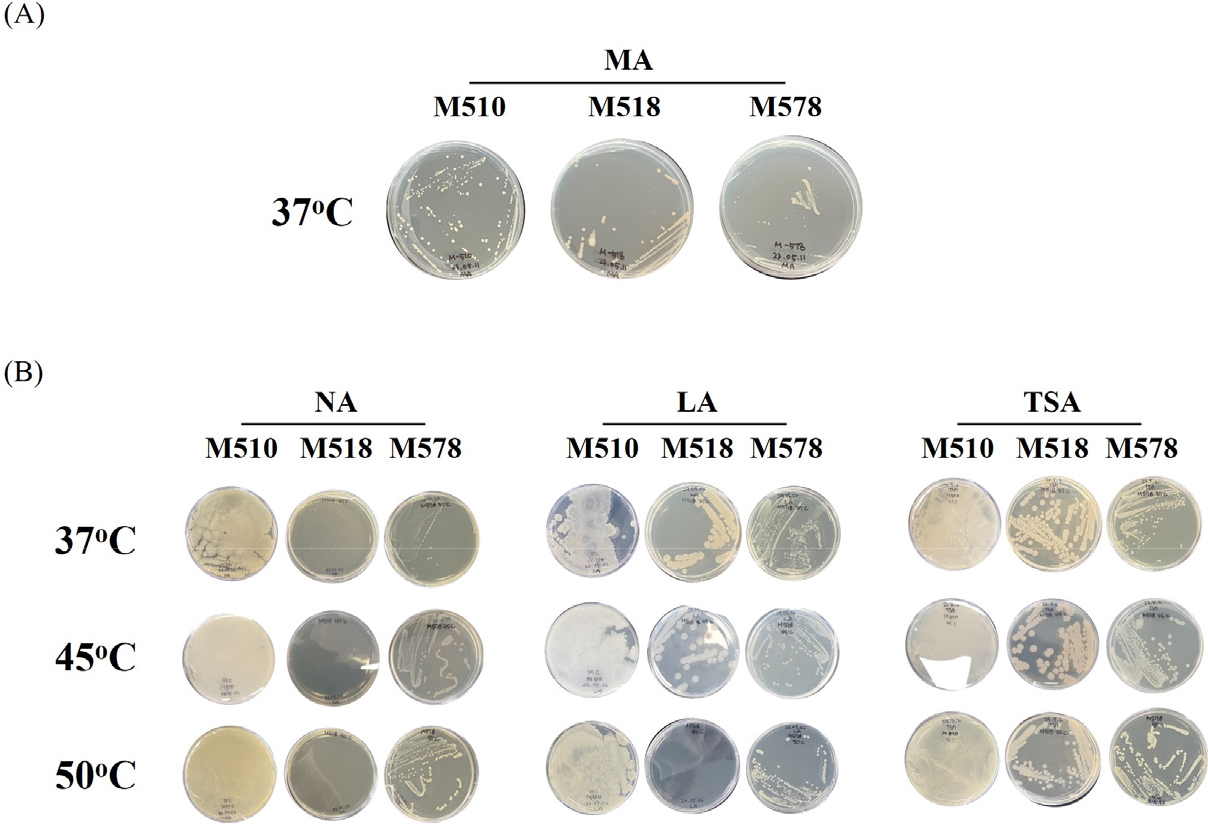
Fig. 1.
Cultivation results for the Bacillus strains isolated from the Neungam Carbonate Hot Springs on agar media. (A) Marine agar medium was used for strain isolation. (B) Isolated strains were cultivated to analyze the growth temperature by using three types of media. MA, NA, LA, and TSA indicate Marine agar, Nutrient agar, Luria–Bertani (LB) agar, and Tryptic soy agar, respectively.
분리 균주 동정
국내 능암 탄산 온천의 온천수로부터 호기적으로 분리된 고온균의 특성을 나타낸 2균주와 중온균 특성의 1균주의 16S rDNA 염기서열을 바탕으로 ㈜마크로젠에서 제공한 분석 결과와 함께 ㈜CJ바이오사이언스의 EzBioCloud 웹서버 16S-based ID 분석서비스를 사용하여 분리 균주들의 미생물 동정 결과 Table 2에서 나타낸 것처럼 M510 균주는 Bacillus tequilensis KCTC 13622와 99.93%의 유사도를 보였으며 M518 균주는 Cytobacillus oceanisediminis DSM 4와 100.0%, M578 균주는 Caldibacillus hisashii N-11과 99.79%의 유사도를 나타내었다. M518과 M578 균주와 유사도가 가장 높았던 Cytobacillus oceanisediminis와 Caldibacillus hisashii는 2020년에 Bacillus oceanisediminis와 Bacillus hisashii로부터 새로운 속으로 각각 분류(Gupta et al., 2020; Patel and Gupta, 2020)된 것으로 3균주 모두 간균 과(Bacillaceae)인 것을 확인하였으나 속(genus)이 다른 것이 확인되었다(Table 2).
Table 2.
Identification of aerobically cultured bacteria isolated from the Neungam Carbonate Hot Springs
세포 외 분해효소 생산 활성 분석
분리된 균주들의 세포 외 가수분해효소(amylase, lipase, protease)들의 활성 검증을 통해 화장품과 식품 산업에서 기능성 소재개발을 위한 발효 균주로의 활용 가능성을 확인하였다. 이를 위해 4종류의 액체 복합 배지를 사용하여 각각의 분리 균주를 배양하여 회수한 제균된 배양 상등액을 사용하여 3종류의 세포외 가수분해효소 활성을 평가한 결과를 Table 3에 나타내었다.
Table 3.
Activity of extracellular hydrolytic enzymes
|
Isolate number | Size of clear zone (mm) | ||||||||||||||
| Media | |||||||||||||||
| MB* | NB# | LB$ | TSB | ||||||||||||
| Ama | Lib | Prc | Ama | Lib | Prc | Ama | Lib | Prc | Ama | Lib | Prc | ||||
| M510 | -d | - | 16.69 | - | - | 15.75 | - | - | 22.62 | - | - | 16.65 | |||
| M518 | - | - | - | - | - | - | - | - | - | - | - | - | |||
| M578 | - | - | + | - | - | 15.37 | - | - | - | - | - | 17.49 | |||
먼저 M510 균주의 경우 사용한 모든 복합 배지에서는 세포외로 분비되는 amylase와 lipase 활성이 없었으나 protease 활성의 경우 이와 반대로 사용된 모든 복합 배지에서 paper disc 주변에 투명환이 관찰되어 protease 활성이 균주 배양액에 존재하는 것으로 확인되었으며 이 중 LB 배지를 사용하여 균주를 배양한 경우 22.62 mm의 투명환이 측정되어 가장 높은 protease 활성이 확인되었다. LB 배지는 질소원인 tryptone과 yeast extract, 무기염인 NaCl만이 배지 조성 성분으로 되어 있기에 향후 LB 배지의 성분을 기반으로 하여 균주의 대량 배양을 위한 배지 최적화를 시험해 볼 수 있을 것으로 생각되었다.
이와 반대로 M518 균주의 경우 시험한 모든 세포외 분해효소 활성이 사용한 모든 복합 배지의 제균된 배양 상등액에서 없는 것으로 확인되었다. 마지막으로 M578 균주의 경우 사용한 모든 복합 배지의 제균된 배양 상등액에서 amylase와 lipase 활성은 없는 것으로 나타났으나 NB 배지와 TSB 배지를 사용해 배양한 상등액에서 투명환 크기가 각각 15.37 mm, 17.49 mm가 확인되어 protease 활성이 존재하는 것으로 확인되었다.
본 연구결과를 바탕으로 향후 전장 유전체 분석과 배지별 균주의 전사체 분석을 통해 배지 성분에 따라 특이적으로 유도되는 protease 탐색을 통한 선택적인 펩타이드의 생산 관련 기초 연구의 진행이 가능할 것으로 판단된다.
탄소원 자화능 분석
국내 능암 탄산 온천의 온천수로부터 분리된 균주 중에서 M510 균주가 LB 액체 배지를 사용하여 배양한 조건에서 가장 높은 protease 활성을 나타내었기에 이를 바탕으로 protease 활성은 유지되거나 증가시키며 Bacillus 속 균주 특유의 발효 냄새를 저감시킬 수 있는 배지 성분의 최적화를 위해 탄소원 종류에 따른 대사 가능 유무를 분석하였다. Bacillus 속의 균주들의 경우, 배양액에서 Bacillus 속 균주들 특유의 발효 냄새를 나타내며 이는 질소원을 분해하여 대사에 사용하며 발생하는 경우가 많이 있기에 이러한 발효 냄새를 저감하기 위해 질소원 사용량을 줄이고 이를 탄소원으로 대체하여 Bacillus 속 균주 증식에 도움을 주고 특유의 발효 냄새를 저감시킬 수 있을 것으로 예상된다(Contesini et al., 2018; Yoo et al., 2021).
M510 균주의 탄수화물 대사에 사용할 수 있는 탄소원을 확인하기 위하여 API 50 CH kit(Biomerieux, France)를 사용하였으며 실험 과정은 제조사의 표준적인 실험 방법에 따랐으며 실험 결과는 탄소원이 포함돼 있는 각각의 strip을 37°C에서 2일간 배양 후 판독하였다. 그 결과, Table 4에서 나타낸 것처럼 실험에 사용된 49종류의 탄소원 중 glucose와 fructose 등 20종류의 탄소원을 대사에 사용할 수 있는 것을 확인하였다. 이러한 결과를 바탕으로 배지 최적화를 위해 LB 배지 조성 중 tryptone을 제외하고 대사가 가능한 탄소원으로 대체한 배지에서 M510 균주를 배양했을 경우의 protease 활성 검증과 같은 연구를 추가적으로 실시할 필요성이 있을 것으로 생각된다.
Table 4.
Carbohydrate source utilization of the isolate M510
따라서 본 연구를 통해 국내 능암 탄산 온천의 온천수를 사용하여 Bacillus 속의 균주를 분리하고자 시도하여 3균주를 분리하였으며 이는 국내 생명 자원의 다양성 확보 측면에서 의미가 있을 것으로 생각되며, 분리 균주들의 생육 특성, 세포 외 분해효소 활성과 탄소원에 따른 자화 능력의 분석을 통해 균주 배양액의 화장품이나 식품 소재로의 산업적 활용 가능성을 검증함과 동시에 대량 배양을 위한 배지 최적화 과정에 있어 기초적인 연구 데이터를 제공할 수 있을 것으로 예상된다.
요 약
본 연구는 국내 능암 탄산 온천의 온천수로부터 Bacillus 속(genus) 균주를 분리하기 위해 marine agar 배지를 사용하고 순수분리 과정을 통하여 3균주를 분리하였다. 분리 균주들의 생육 pH와 온도, 그리고 복합 배지에서의 생육 가능성을 확인하였으며 균주 동정 결과 3균주 모두 간균 과(Bacillaceae)인 것을 확인하였으나 Bacillus tequilensis, Cytobacillus oceanisediminis와 Caldibacillus hisashii로 속이 다른 것이 확인되었다. 그리고 분리한 균주들의 배양 상등액이 화장품과 식품 산업에 활용 가능한지를 확인하기 위해 세포 외 분해효소 생산 능력을 확인한 결과, 2균주에서 protease 활성을 나타내는 것을 확인하였다. 또한, M510 균주의 대량 배양을 위한 배지 최적화를 위해 다양한 탄소원의 이용 능력을 확인한 결과 20종류의 탄소원을 대사에 사용할 수 있는 것을 확인하였다. 이번 연구는 국내 유전자원 확보와 분리된 균주의 배지 최적화를 위해 기초적인 연구자료로 활용이 가능할 것으로 생각된다.




