서 론
재료 및 방법
토양 미생물 분리 및 상추 균핵병원균
상추 균핵병원균 생장 억제를 통한 유용미생물 선발
선발 유용미생물의 biochemical characterization
상추 포트 실험을 통한 균핵병 방제 및 식물생장촉진 효과 검정
결과 및 고찰
유용미생물 선발 및 길항력 검정
선발 유용미생물의 biochemical characterization
상추 포트 실험을 통한 길항균 방제 및 식물생장촉진 효과 검정
결 론
서 론
상추(Lactuca sativa L.)는 국화과 초본식물로 미국, 일본, 대한민국 등 세계적으로 생산되고 소비되는 엽채류 작물 중 하나로 사계절 내내 시설에서 재배되고 있다(Hwang et al., 2006; Kim et al., 2008a). 상추는 소득 증대, 서구화, 건강을 위한 웰빙 문화 등으로 인한 친환경 시장이 늘어난 원인으로 국내에서 현재까지 꾸준히 생산량 및 소비량이 증가하고 있는 추세이다(Yoon, 2014). 상추는 시설재배를 통하여 사계절 내내 재배가 가능하고 생육적온이 15-20°C 온도에서 생장 조건이 좋으며, 서늘한 기후에서 생장이 잘되는 호냉성 채소로 알려져 있다. 재배조건이 다습하기 때문에 병해 발생에 최적의 조건으로 매년 농가에서 경제적으로 큰 피해를 입고 있는 상황이다(Kim et al., 2004). 국내에서 상추를 기주로 하여 발생하는 병해는 총 17종으로 바이러스에 의해 발생하는 병은 2종, 세균에 의해 발생하는 병은 4종 그리고 곰팡이에 의해 발생하는 병은 11종으로 곰팡이에 의한 병해가 가장 많이 발생하는 것으로 알려져 있다(KSPP, 2009). 곰팡이 병원균 중에서 상추를 재배하는 과정에서 가장 빈번하게 나타나는 병해 중 하나는 바로 균핵병(Sclerotinia rot)이다. 균핵병원균에 감염된 식물은 매우 빠른 속도로 부패가 진행되어 상업적 가치가 떨어져 최대 75%까지 작물 손실을 야기한다(Chitrampalam et al., 2008; Young et al., 2004). 현재까지는 균핵병을 방제하기 위하여 벤레이트 수화제, 피리벤카브 액상수하제 등의 화학농약을 사용하여 사용하고 있으나 잔류농약에 대한 인체 및 환경오염 등의 문제로 유용미생물을 활용하는 친환경적인 생물학적 방제를 위한 개발이 진행되고 있다(Lee et al., 2014). 특히 외국에서는 화학농약의 문제점을 먼저 알고 생물적 방제를 위한 다양한 시도가 이루어지고 있으며, Trichoderma, Glicocladium, Coniothyrium, Bacillus 등의 길항균을 이용하여 균핵병을 방제한다고 보고된 사례가 있다(Chitrampalam et al., 2008). 국내에서도 Brevibacillus, Bacillus 등의 길항균을 이용한 다양한 생물적 방제가 진행되고 있다(Kim et al., 2008b; Park et al., 2006).
본 연구는 상추 재배지에서 균핵병을 야기하는 S. sclerotiorum, S. minor 균핵병원균 대상으로 토양에서 분리한 유용미생물을 이용한 미생물 방제제를 개발하고자 길항미생물 선발, 동정 및 생화학적 특성 그리고 포트 실험을 통하여 선발 유용미생물의 작물생장촉진 및 방제 효과를 확인하고자 연구를 수행하였다.
재료 및 방법
토양 미생물 분리 및 상추 균핵병원균
토양 미생물은 2021년 강원도 춘천, 원주, 홍천 그리고 경기도 여주, 이천 상추 재배 농가 여섯 지역에서, 지표면으로부터 15 cm 깊이의 상추 뿌리 근처 토양을 수집하였다. 수집한 토양은 4일간 음지에서 건조하였으며, 2 mm 크기의 채로 거른 후 균질화된 토양을 50 ml tube에 보관하였다. 균질화된 토양은 serial dilution 방법을 이용하여 미생물을 분리하였다. 멸균된 유리 튜브와 증류수를 사용하였으며, 측정된 1 g의 토양을 serial dilution 방법을 이용하여 10,000배 희석하였고 Tryptic Soy Agar(TSA) 고체배지에 희석된 용액을 30 µl씩 분주 및 도말하여 30°C 온도 조건에서 3일간 배양하였다. 고체배지에 자란 미생물의 colony를 색깔, 모양, 형태 등의 기준으로 하여 육안상으로 미생물을 순수분리하여 실험에 사용하였다. 상추 균핵병원균은 Sclerotinia sclerotiorum, Sclerotinia minor를 국립농업유전자원센터(Korean Agricultural Culture Collection, KACC)에서 분양받았으며, Potato Dextrose Agar(PDA) 배지에 25°C 온도 조건에서 배양하여 사용하였다.
상추 균핵병원균 생장 억제를 통한 유용미생물 선발
상추 재배지 토양에서 분리한 미생물 및 기존에 보유하고 있는 세균 2종(B18, B24)을 대상으로 상추 균핵병원균(S. sclerotiorum, S. minor)에 대한 길항 효과를 확인하기 위해 길항성 검정 실험을 진행하였다. 상추 균핵병원균 2종을 7일간 배양하여 4 mm 크기의 cork borer를 이용한 agar plug를 TSA 배지와 PDA 배지를 1:1 비율로 혼합한 배지에 치상하였으며, 동일 선상에 8 mm paperdisk를 위치시켜 Tryptic Soy Broth(TSB)에 30°C에 2일간 액체배양된 미생물을 20 µl씩 접종하였다. 접종한 plate를 25°C에서 배양하였으며, 무처리구의 상추 균핵병원균이 plate 전체로 생장하였을 때 접종한 미생물과의 거리를 측정하여 억제율(Inhibition rate)을 측정하여 유용미생물을 선발하였다. 각 실험은 처리구당 3반복 수행하여 실험을 진행하였으며, 선발한 유용미생물은 16S rRNA(Universal primer 27F; 5’-AGAGTTTGATCTGGCTCAG-3’, 1492R; 5’-TACGGYTACCTTGTTACGAC TT-3’)을 이용하여 염기서열을 분석하고 Genebank BLAST를 통하여 동정을 진행하였다.
*R: The miximum diameter of fungal pathogens away from the bacteria
r: The diameter of the fungal pathogens opposite the bacteria
선발 유용미생물의 biochemical characterization
Ammonia production 여부는 선발 유용미생물을 TSB 배지에 28°C, 130 rpm, 24시간 배양한 후 각각 30 ml의 peptone water broth(4%)에 50 µl씩 접종하여 6일 동안 28°C, 130 rpm으로 배양하면서 3일 간격으로 2회 조사하였다. 8.5 ml의 증류수에 2 ml의 세균 배양액, 1 ml의 Nessler’s reagent(SAM, KOREA)를 혼합하여 5분 동안 반응시켜 yellow color에서 orange/red color로 변화하는 것으로, ammonia 생성 여부를 확인하였다.
Phosphate solubilization 여부는 Pikovskaya’s agar(Dextrose 10.0 g, Calcium phosphate 5.0 g, Yeast extract 0.5 g, Ammonium sulphate 0.5 g, Photassium choloride 0.2 g, Magnesium sulphate 0.1 g, Manganese sulphate 0.0001 g, Ferrous sulphate 0.0001 g, Agar 15.0 g/L)에 cork borer(⦶ : 5 mm)를 이용하여 일정한 크기의 well을 생성하여, 선발 유용미생물을 각각 TSB 배지에 28°C, 130 rpm, 24시간 배양한 후 20 µl씩 well에 접종하였다. 28°C, 72 h 배양한 후 well 주변의 clear zone 생성 여부로 불용성 인산 가용화 능력을 확인하였다.
Starch hydrolysis 여부는 선발 유용미생물을 TSB 배지에 28°C, 130 rpm, 24시간 액체 배양하여 Starch agar (Soluble starch 10.0 g, Peptone 5.0 g, Beef extract 3.0 g, Agar 15.0 g/L)에 cork borer(⦶ : 5 mm)를 이용하여 일정한 크기의 well을 만들어 각각 20 µl씩 접종하여 28°C에서 72시간 배양하였다. 배양 후 3% iodine-potassium iodide를 이용해 plate를 염색하여 clear zone을 확인하여 전분 가수분해 효소의 생성 여부를 확인하였다.
Siderophore production 여부는 Chrome azurole S(CAS) 배지를 준비하였으며, CAS blue agar에 cork borer(⦶ : 5 mm)를 이용하여 일정한 크기의 well을 만들어 선발 유용미생물을 각각 20 µl씩 접종 후 28°C에서 7일간 배양하였다. 배지의 well 주변에 blue color가 yellow/orange color로 변한 것을 통하여 siderophore 생성 여부를 확인하였다.
Hydrogen cyanide(HCN) production 여부는 선발 유용미생물을 glycine(4.4 g/L)이 첨가된 TSA 배지에 각각 30 µl씩 도말하였으며, 동시에 0.5%(w/v) picric acid와 1% sodium carbonate를 혼합한 용액에 121°C에서 15분간 멸균한 90 mm filter paper(No. 20)를 침지시킨 후, petri-dish 뚜껑에 부착시켜 seeling 하였다. 그리고 28°C에서 72시간 배양하여 뚜껑에 부착된 filter paper가 yellow color에서 red/brown color로 변화하는 것으로 HCN 생성 여부를 확인하였다.
Protease production 여부는 선발 유용미생물을 각각 TSB 배지에 28°C, 130 rpm, 24시간 액체 배양하여 skim milk agar(skim milk powder 100.0 g, peptone 5.0 g, agar 15.0 g/L) 배지에 cork borer(⦶ : 5 mm)를 이용하여 일정한 크기의 well을 만들어 각각 20 µl씩 접종하였다. 28°C에서 72시간 배양한 후 well 주변의 clear zone을 확인하여, protease 생성 여부를 확인하였다.
상추 포트 실험을 통한 균핵병 방제 및 식물생장촉진 효과 검정
상추 균핵병원균 S. sclerotiorum, S. minor는 PDA 배지에 접종하여 25°C에서 90 mm peatri dish에 전체로 자랄 때까지 배양한 후 균사가 자랄 때까지 25°C 배양기에서 배양하였으며, 4 mm cork borer를 이용하여 4개의 agar plug를 상추에 접종하였다. 선발 유용미생물을 30 ml TSB 배지에 28°C, 24시간 배양한 후 1.5 L TSB 배지에 다시 접종하여 48시간 동안 28°C, 130 rpm 조건으로 추가 배양 후 처리구당 10 ml씩 처리하였다. 유용미생물의 농도는 1 × 107 cfu/ml 농도로 준비하였고 상추는 동오시드의 적치마(꽃상추) 품종을 사용하였으며, 일반 흙과 원예용 상토(바로커)를 2:1 비율로 혼합하여 포트에 2 kg씩 담아 사용하였다.
실험 조건은 control, positive control, negative control, 길항균 처리, 길항균 선처리, 길항균 후처리로 나누어 실험을 진행하였다. Control 처리구는 물만 처리한 무처리구와 S. sclerotiorum, S. minor, S. sclerotiorum+S. minor 상추 균핵병원균이 처리된 negative control 그리고 S. sclerotiorum, S. minor, S. sclerotiorum+S. minor 상추 균핵병원균을 접종하고 24시간 후에 시중에서 판매하고 있는 생물농약(Acadian29, Canada) 및 화학농약(선두주자, 성보화학)을 처리하는 positive control로 구분되어 실험을 진행하였다. 길항균 접종은 WJR-6B, HCS-1B 그리고 WJR-6B+ HCS-1B 접종 처리구로 분류하였다. 길항균 선처리는 길항균을 접종하고 24시간 후에 병원균을 접종하여 실험을 진행하였으며, 길항균 후처리는 병원균을 접종하고 24시간 후에 길항균을 처리하였다. 처리 10일 후에 상추의 발병율 그리고 생체중, 건조중, 엽면적, 엽록소 함량을 측정하여 균핵병 방제 및 식물생장촉진 효과를 확인하였다.
결과 및 고찰
유용미생물 선발 및 길항력 검정
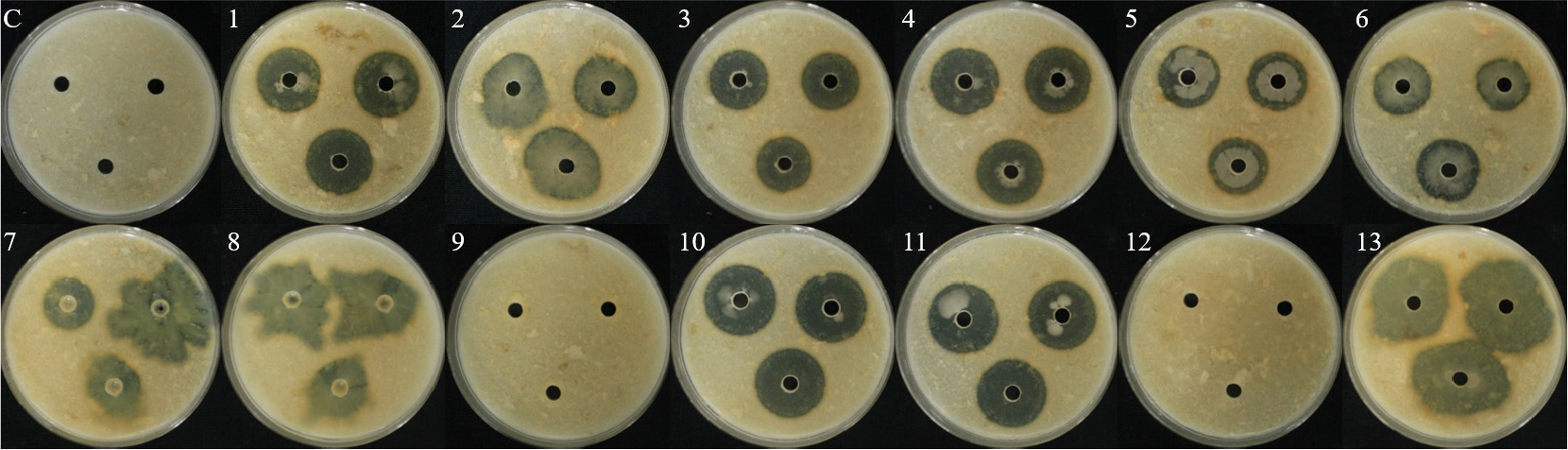
토양에서 순수분리한 총 123개의 세균 및 기존에 보유하고 있는 2개(B18, B24)의 세균을 대상으로 상추 균핵병원균 2종에 대한 1차 길항 효과를 확인하여 총 13개의 세균을 선발하였으며, Bacillus, Pseudomonas, Pantoea, Lysinibacillus, Burkholderia 속으로 동정되었다(Table 1).
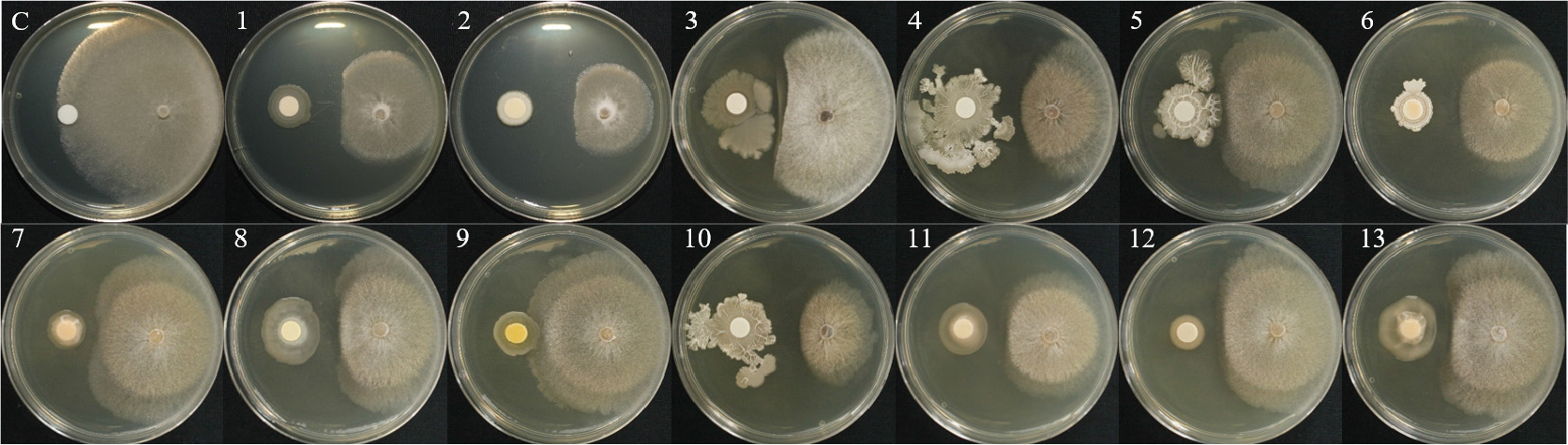
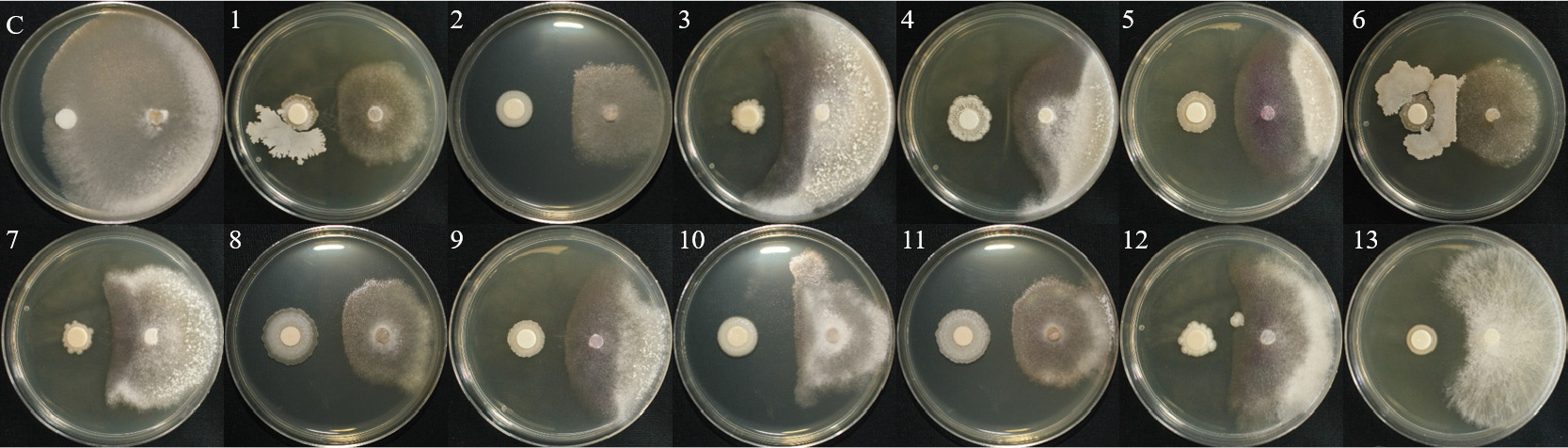
1차 길항 실험을 통하여 선발한 13개의 세균을 1:1 대치배양을 통하여 길항력을 검정한 결과, S. sclerotiorum에서 WJR-6B 균주가 81.1%의 가장 높은 균사 억제율을 나타내었으며, HCS-4B 균주가 63.3%로 가장 낮은 균사 억제율을 보였다(Table 2, Fig. 1). S. minor의 억제율은 B24 균주가 80.5%로 가장 높았으며, L3-3S-2B 균주가 65.4%로 가장 낮은 균사 억제율은 나타냈다(Table 2, Fig. 2). 이전 실험에서 상추 균핵병에 대하여 B. subtilis가 88% 방제 효과가 있는 것으로 보고된바 있으며(Lee et al., 2014), 이는 본 실험 결과와 유사한 경향으로 토양에서 분리한 유용미생물의 생물적 방제 가능성을 보여준다.
Table 1.
List of antagonistic bacterial isolates used in this study
Table 2.
In vitro antagonistic effects of 13 bacterial isolates against Sclerotinia sclerotiorum and S. minor
| Isolates | Inhibition rate (%) | |
| S. sclerotiorum | S. minor | |
| B18 | 73.8abc* | 79.5a |
| B24 | 75.0acb | 80.5a |
| ICS-2B | 77.2ab | 77.8ab |
| HCS-1B | 80.0a | 78.2a |
| HCS-4B | 63.3d | 71.7abc |
| WJS-5B | 71.1bcd | 72.2abc |
| WJR-2B | 71.1bcd | 75.8ab |
| WJR-4B | 74.4abc | 73.8abc |
| WJR-5B | 76.6abc | 74.2abc |
| WJR-6B | 81.1a | 75.1ab |
| CCR-3B | 71.5bc | 73.2abc |
| YJS-4B | 69.4bcd | 68.3bc |
| L3-3S-2B | 68.3cd | 65.4c |
선발 유용미생물의 biochemical characterization
선발 유용미생물의 효소 활성 및 가용화 여부를 암모니아 생성, 인산 가용화, 전분 가수분해, siderophore, HCN, protease 생성 여부를 통하여 확인하였다.
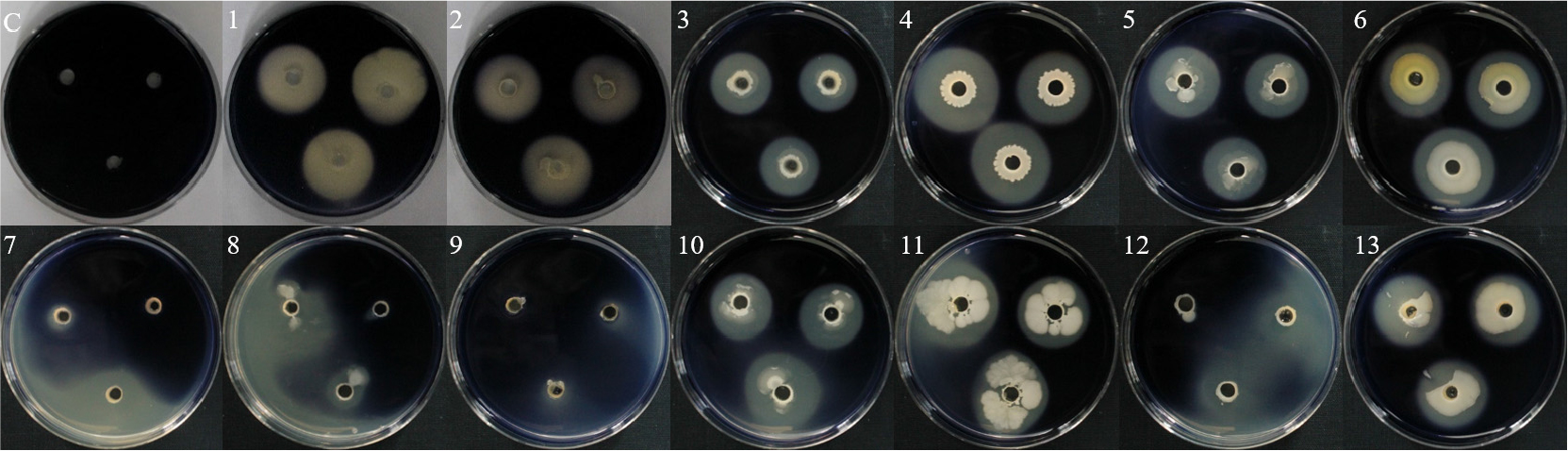
암모니아 생성은 13개 균주 모두 노란색에서 주황색 및 붉은색으로 변한 것을 통하여 효소 활성이 있는 것을 확인하였으며, B18 및 B24 균주가 진한 붉은색의 색변화로 암모니아가 가장 많이 생성된 것을 확인하였다(Fig. 3). 토양에서 질소는 미생물에 의해 분해되어 암모니아태 질소로 변화되어 존재하며, 식물 생육에 있어서 필요한 원소 중 하나로, 식물의 신장, 엽면적 확장 및 분얼 촉진에 영향을 주는 것으로 알려져 있다(Kundu, 1987).
인산 가용화는 13개 균주 중에서 10개 균주를 제외한 3개 균주(WJR-2B, WJR-5B, CCR-3B)가 활성이 있는 것을 확인하였다(Fig. 4). 3개 균주 중에서 WJR-2B 및 WJR-5B 균주는 각각 1.4 cm 및 2.2 cm의 clean zone으로 가장 높은 인산 가용화 능력을 나타내었다. 인은 식물 생장에서 질소의 흡수를 도와주며, 식물의 영양분 흡수 및 종자 성숙도, 수확량에 영향을 미친다고 알려져 있다(Arora et al., 2008).
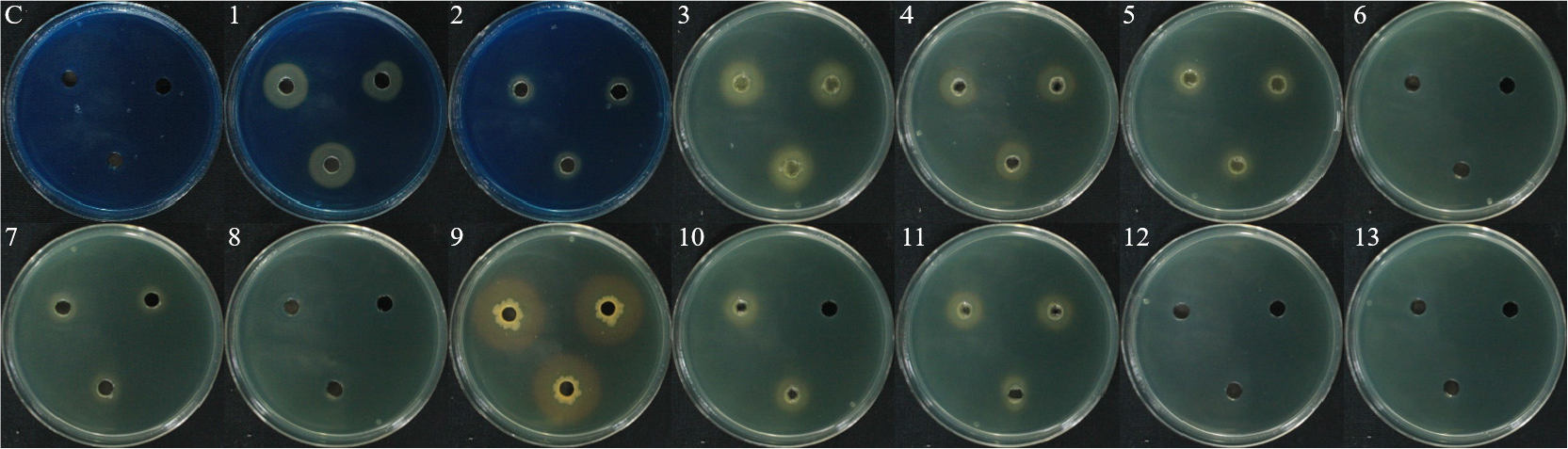
전분 가수분해는 13개 균주 중에서 4개 균주를 제외한 9개 균주(B18, B24, ICS-2B, HCS-1B, HCS-4B, WJS-5B, WJR-6B, CCR-3B, L3-3S-2B)에서 clean zone을 통하여 α-amylase 생성을 하는 것을 확인하였으며, WJS-5B 균주가 3.4 cm로 가장 높은 활성을 나타내었다(Fig. 5). 전분은 식물의 에너지 대사를 위해 엽록체, 줄기, 뿌리 및 종자에서 합성되며 생장 과정에서 중요한 역할을 하는 것으로 알려져 있다(Malhotra et al., 2018).
Siderophore 생성은 13개 균주 중에서 9개 균주(B18, B24, ICS-2B, HCS-4B, WJR-2B, WJS-5B, WJR-6B, CCR-3B)에서 yellow/orange color로 색이 변한 것을 통하여 활성을 확인하였다(Fig. 6). 그중에서 WJR-5B 균주가 2.9cm의 가장 큰 clear zone을 형성하여 가장 많은 siderophore를 생성하는 것을 확인하였다.
HCN 생성은 WJS-5B, WJR-2B 두 균주에서만 filter paper의 색이 노란색에서 적갈색으로 변한 것을 통하여 활성을 확인하였다(Fig. 7). HCN은 친수성의 특성을 지니며, 식물병 억제 및 생장촉진효과도 있는 것으로 알려져 있다(Chandra et al., 2007; Kumar et al., 2009; Moore and Willaman, 1917).
Protease 생성은 13개 균주 중에서 WJR-5B와 YJS-4B를 제외한 11개의 균주(B18, B24, ICS-2B, HCS-1B, HCS-4B, WJS-5B, WJR-2B, WJR-4B, WJR-6B, CCR-3B, L3-3S-2B)에서 clear zone을 통해 단백질 분해효소를 생성하는 것을 확인하였다(Fig. 8). Protease는 고분자 단백질을 가수분해하는 효소로 알려져 있으며, 식물병 억제제로서 식물을 보호하기 위한 메커니즘으로 알려져 있다(Gupta et al., 2002; Habib and Fazili, 2007).
상추 포트 실험을 통한 길항균 방제 및 식물생장촉진 효과 검정
길항 검정에서 균핵병원균 S. sclerotiroum 및 S. minor에 대하여 75-80%의 억제율을 나타내는 2개의 유용미생물 WJR-6B, HCS-1B 균주를 사용하여 상추 포트 실험을 진행하였다. 그 결과, S. sclerotiorum 병원균을 접종한 처리구가 91.7%로 가장 많이 병이 발생한 것을 확인하였고 S. minor 및 S. sclerotiorum+S. minor 처리구가 동일하게 83.3%로 병이 발생하여 높은 발병율을 보여주었다(Fig. 9). 화학농약 및 생물농약을 사용한 positive control은 S. sclerotiorum+생물농약, S. sclerotiorum+S. minor+생물농약 처리구가 58.3%로 동일하게 높게 병이 발생하였으며, S. sclerotiorum+S. minor+화학농약 처리구가 16.7%로 생물농약과 비교하였을 때 낮은 발병율을 확인하였다(Fig. 9). 화학농약 처리구의 발병율이 평균 25%로 생물농약 처리구의 평균값 55.5%보다 병 발생율이 작게 측정되었다.
길항균 후처리는 S. minor+WJR-6B+HCS-1B 혼합 처리구가 58.3%의 발병율을 보여주었으며, S. sclerotiorum+ WJR-6B 처리구에서 병징이 0%로 발견되지 않았다(Fig. 9, Fig. 10). 상추 균핵병원균 중 하나인 S. sclerotiorum를 선접종하고 WJR-6B, HCS-1B 및 혼합처리구를 처리하였을 때, 평균적으로 11.1%의 발병율로 S. minor 선접종 처리구의 발병율 47.2%보다 낮아 S. sclerotiorum 균주에 의한 상추균핵병은 WJR-6B 균주의 방제 효과가 우수하다고 판단된다. 상추균핵병에 대하여 포트실험을 통해 방제효과를 조사하여 대조구 80%의 발병율에 비해 B. megaterium의 발병율이 20%로 나타나 생물적 방제 효과가 있다는 기존의 연구와 유사하였다(Chon et al., 2013).
길항균 선처리는 WJR-6B+HCS-1B+S. sclerotiorum 혼합 처리구가 33.3% 발병율을 나타내었으며, HCS-1B+S. sclerotiorum 처리구가 0%로 병징을 보이지 않았다(Fig. 9, Fig. 10). B. megaterium은 ochratoxinA 독소를 제거할 수 있을만한 항진균 활성을 가진 균주로 최근 연구된 사례가 있는데(Shang et al., 2019), 본 연구의 WJR-6B, HCS-1B 두 개의 균주도 항진균 활성을 보여 상추균핵병이 억제된 것으로 추정된다. Zhang & Xue(2010)은 균행병원균에 접종 24시간 전 B. subtilis SB24를 처리하였을 때, 병 발생의 중증도를 줄이는데 효과적이라고 연구된바 있다. 이와 같은 이유로 본 연구에서 실험 방법에서 사용한 길항균 선접종 후 병원균 처리가 균핵병의 병 발생을 예방하여 병징을 억제하는 것으로 판단된다.

Fig. 10.
Post- and pretreatment of antagonistic bacterial isolates in lettuce crop pre- and post-inoculated with S. sclerotiorum (SS) and S. minor (SM). (C: control, 1: SS+CF, 2: SM+CF, 3: SS+SM+CF, 4: SS+BF, 5: SM+BF, 6: SS+SM+BF, 7: SS, 8: SM, 9: SS+SM, 10: WJR-6B, 11: HCS-1B, 12: WJR-6B_HCS-1B, 13: SS+WJR-6B, 14: SS+HCS-1B, 15: SS+WJR-6B+HCS-1B, 16: SM+WJR-6B, 17: SM+HCS-1B, 18: SM+WJR-6B+HCS-1B, 19: SS+SM+WJR-6B, 20: SS+SM+ HCS-1B, 21: SS+SM+WJR-6B+HCS-1B, 22: WJR-6B+SS, 23: HCS-1B+SS, 24: WJR-6B+HCS-1B+SS, 25: WJR-6B+SM, 26: HCS-1B+SM, 27: WJR-6B+HCS-1B+SM, 28: WJR-6B+SS+SM, 29: HCS-1B+SS+SM, 30: WJR-6B+HCS-1B+SS+SM).
선발한 길항 세균 HCS-1B 및 WJR-6B의 식물생장촉진을 추가적으로 확인하였다. 10일 후 측정한 상추의 생체중은 물만 처리한 control의 자상부가 4.6 g, 지하부가 1.2 g으로 측정되었으며, 화학농약 및 생물농약을 처리한 positive control은 S. sclerotiorum, S. minor, S. sclerotiorum+S. minor 병원균 처리에 대하여 각각 4.3 g, 4.6 g, 10.8 g 그리고 5.4 g, 4.2 g, 7.1 g으로 측정되었다(Fig. 10, Table 3). Negative control은 S. sclerotiorum, S. minor, S. sclerotiorum+S. minor 병원균 처리에 대하여 1.7 g, 3 g, 7.1 g으로 S. sclerotiorum 처리구가 S. minor 처리구가 생체중이 더 낮게 측정되었다(Fig. 10, Table 3). 길항균 처리구에서 WJR-6B+HCS-1B 혼합처리구가 생체중이 20.9g으로 가장 높게 측정되었으며, 엽면적은 218.4 cm2로 무처리 대비 약 3배 높게 측정되었다(Fig. 10, Table 3). 또한 길항균 선처리에서 HCS-1B+S. sclerotiorum 처리구가 22.3 g로 생체중이 가장 높게 측정되었으며 건조중, 엽록소 함량, 엽면적 각각 1.2 g, 29.5, 192 cm2으로 다른 처리구보다 높은 측정값을 나타냈다(Fig. 10, Table 3). B. megaterium은 질소를 고정하고 옥신을 생상하며 인산염을 가용화하여 상추의 생장을 26.7% 향상시킨다는 연구 결과가 보고된바 있으며(Acurio Vásconez et al., 2020), 본 연구에 사용한 HCS-1B, WJR-6B 두 개의 균주 모두 상추의 생장을 향상시키는 연구 결과를 보여주었다.
Table 3.
Growth promotion of lettuce under greenhouse conditions
| Treatment | Fresh weight (g) | Dry weight (g) |
Chlorophyll contents (SPAD value) |
Leaf area (cm2) | |||
| Shoot | Root | Shoot | Root | ||||
| Control | 4.6d-f* | 1.2a-g | 0.32ef | 0.11b-g | 20.6a-f | 75d-h | |
|
Positive control | SS+CF | 4.3d-f | 0.8d-g | 0.4d-f | 0.06c-g | 17.1c-h | 72.9d-h |
| SM+CF | 4.6d-f | 0.8d-g | 0.3ef | 0.08b-g | 19.4a-g | 74d-h | |
| SS+SM+CF | 10.8c-f | 2a-g | 0.62b-f | 0.15a-g | 21.7a-f | 126.9a-g | |
| SS+BF | 5.4d-f | 0.7d-g | 0.34ef | 0.07c-g | 15.2d-h | 69.9d-h | |
| SM+BF | 4.2d-f | 1c-g | 0.25f | 0.06c-g | 12.2e-h | 65.1e-h | |
| SS+SM+BF | 7.1c-f | 1.7a-g | 0.63b-f | 0.1b-g | 16.3c-h | 79.2c-h | |
|
Negative control | SS | 1.7f | 0.2g | 0.28ef | 0.02g | 6.1gh | 20.8h |
| SM | 3ef | 0.3fg | 0.4d-f | 0.02g | 5.7h | 29.9gh | |
| SS+SM | 7.1c-f | 0.8d-g | 0.93a-f | 0.05e-g | 9f-h | 63.1f-h | |
|
Antagonistic bacteria | WJR-6B | 14a-d | 2.9ab | 1.05a-e | 0.17a-f | 32.5a | 170a-d |
| HCS-1B | 9.1c-f | 0.6d-g | 0.8b-f | 0.08b-g | 30.1a-c | 122.6a-h | |
| WJR-6B+HCS-1B | 20.9ab | 2.3a-e | 1.49a | 0.2a-c | 29.8a-c | 218.4a | |
|
Post- treatment using antagonistic bacteria | SS+WJR-6B | 16.4a-c | 2.2a-f | 1.49a | 0.2a-c | 31.7ab | 167.6a-e |
| SS+HCS-1B | 12.1b-e | 1b-g | 0.86a-f | 0.09b-g | 28a-d | 158.4a-f | |
| SS+WJR-6B+HCS-1B | 13.3a-d | 1.4a-g | 0.91a-f | 0.11b-g | 28.3a-d | 141.8a-f | |
| SM+WJR-6B | 8.1c-f | 0.7d-g | 0.83a-f | 0.07c-g | 28.2a-d | 102.9b-h | |
| SM+HCS-1B | 11.2b-f | 1.2a-g | 0.95a-e | 0.14a-g | 19.3a-g | 101.6b-h | |
| SM+WJ-6B+HCS-1B | 5.8d-f | 0.4e-g | 0.54b-f | 0.05e-g | 18.1b-g | 70.2d-h | |
| SS+SM+WJR-6B | 7.3c-f | 0.6d-g | 0.46c-f | 0.07c-g | 24.9a-e | 90.3b-h | |
| SS+SM+HCS-1B | 4.9d-f | 0.6d-g | 0.33ef | 0.03fg | 25a-e | 66.8d-h | |
| SS+SM+WJR-6B+HCS-1B | 12.5a-e | 1.7a-g | 0.87a-f | 0.11b-g | 33.2a-c | 134.3a-f | |
|
Pre- treatment using antagonistic bacteria | WJR-6B+SS | 16.1a-c | 2.9a | 1.1a-c | 0.2a-d | 28.4a-d | 168.1a-e |
| HCS-1B+SS | 22.3a | 2.8a-c | 1.2ab | 0.27a | 29.5a-c | 192.0ab | |
| WJR-6B+HCS-1B+SS | 6.7c-f | 0.9c-g | 0.49c-f | 0.05d-g | 26a-d | 131.8a-h | |
| WJR-6B+SM | 12.2a-d | 2.3a-e | 0.74b-f | 0.18a-e | 28.3a-d | 137.3a-f | |
| HCS-1B+SM | 7.4a-e | 0.7d-g | 0.52b-f | 0.06c-g | 25.5a-e | 125.4a-g | |
| WJR-6B+HCS-1B+SM | 14.3a-d | 2.8a-c | 0.97a-e | 0.22ab | 30a-c | 180.7a-c | |
| WJR-6B+SS+SM | 13.1a-e | 1.2a-g | 0.89a-f | 0.13a-g | 26.8a-d | 143.1a-f | |
| HCS-1B+SS+SM | 16.7a-c | 2.4a-d | 1.1a-c | 0.17a-f | 23.3a-e | 147.2a-f | |
| WJR-6B+HCS-1B+SS+SM | 11.9b-e | 2.2a-f | 0.83a-f | 0.16a-f | 29.1a-d | 148.2a-f | |
결 론
토양에서 분리한 미생물을 이용하여 균핵병원균에 대한 대치배양을 통하여 13종의 길항균을 선발하였고 bio- chemical test를 통하여 HCS-1B, WJR-6B 2개의 균주를 최종 선발하였다. 선발한 2종의 유용미생물은 B. megaterium으로 동정되었으며, 상추 포트 실험에서 길항균 후처리 S. sclerotiorum+WJR-6B 처리구의 균핵병 발병율이 0%로 가장 낮게 측정되었으며, 길항균 선처리 HCS-1B+S. sclerotiorum 처리구 또한 0%의 발병율로 균행병 발생이 가장 낮은 것을 확인하였다. 또한 선발한 길항균을 혼합 처리하였을 때, 무처리와 비교하여 엽면적 수치가 약 3배나 높았으며, 선발 길항균의 생장촉진 효과를 확인하였다. 본 실험 결과를 통하여 WJR-6B 균주는 상추 균핵병 방제에 효과적이며, HCS-1B 균주는 상추 균행병 예방에 유용할 것으로 생각된다. 하지만 HCS-1B, WJR-6B 균주 생물적 방제제에 대한 추가적인 연구가 필요할 것으로 사료된다.