서 론
재료 및 방법
추출물
DSS-유도 동물 모델 제작
질병활성지수(Disease Activity Index, DAI) 측정
혈중 사이토카인 및 Myeloperoxidase(MPO) 측정
대장 조직의 병리학적 분석
세포배양
세포생존율
세포에서 분비된 활성산소 분석
세포에서 분비된 Cytokine 분석
통계처리
결과 및 고찰
질병활성지수
대장 및 비장 변화
혈중 사이토카인 및 MPO 분비량 비교
조직병리학적 분석
세포주(HT-29)에서 산복사나무의 염증 완화 검증
요약 및 결론
서 론
산복사나무(Prunus Davidiana(Carrière) Franch.)는 장미과에 속하는 관속식물로서 우리나라 전역의 산지에서 자라는 낙엽활엽나무이다. 열매는 3 cm 정도의 둥근 모양으로 잔털이 있고, 7월에 성숙한다. 산복사나무가 속한 prunus 속에는 주석산, 사과산, 시트르산 등의 유기산이 함유되어 있으며(Lee et al., 1972a), 에스테르류인 말산과 개미산, 초산, 타르타르산 뿐만 아니라 알코올류, 알데히드류 및 펙틴 등이 풍부한 것으로 알려져 있다(Lee et al., 1972b). 산복사나무의 신경통이나 관절염 개선(Joe, 2012)이나 항산화 활성과 지질 과산화 억제능, 항염증(Cha and Lee, 2004), 고지혈증 완화(Choi et al., 1991) 등에 대해 보고되었고, 그 밖에 항산화 및 미백에 대한 효능(Kim et al., 2012)에 대한 연구도 진행되었다. 또한, 선천성 고혈압 마우스 모델을 이용하여 혈청 내 지질개선 및 순환기계 질환, 고혈압 개선 등의 연구(Kim, 2006)가 보고되었다.
염증성 장 질환(inflammatory bowel disease)은 궤양성 대장염(ulcerative colitis)과 크론병(Crohn’s disease)으로 분류되는 만성적 염증 유발 질환이다(Xavier and Podolsky, 2007). 염증성 장 질환은 유럽이나 미국 등 육식 위주의 식습관을 가진 나라 등에서 흔히 나타나지만 최근 들어 한국에서도 식습관 변화에 따라 증가 추세에 있다(Chang et al., 2005). 염증성 장질환은 유전적인 요인과 면역학적인 요인에 의해 발병하기도 하지만, 스트레스나 약물 등과 같은 환경적 요인과도 관련이 있으며, 이러한 다양한 원인이 복합적으로 작용하는 것으로 알려져 있다(Ferenczi et al., 2016; Kim et al., 2019). 대장의 점막층에 염증 혹은 궤양이 생기는 질환으로 만성 재발성 질환인 궤양성 대장염증에 대한 연구가 최근 들어 활발해 지면서 다양한 치료제 개발 등에 노력을 기울이고 있지만 약물 내성 등을 고려하여 천연물 소재에 대한 연구의 필요성이 높아지고 있다(Currò et al., 2017). Dextran sulfate sodium(DSS)-유도 대장염 마우스는 궤양성 대장염 연구에 널리 활용되고 있는 동물 모델로서 궤양성 대장염증이 유발되면 체중감소, 혈변, 설사, 대장길이 위축 등이 나타나 대장염 환자와 유사한 임상 증상이 나타나게 된다(Valatas et al., 2015). 산복사나무에는 ROS 활성에 영향을 미치는 kaemperol 류의 플라보노이드가 다수 함유되어 있고(Jung et al., 2003), 산복사나무를 활용하여 피부 개선이나 순환기계 개선 연구 뿐만 아니라, 산복사나무의 항산화 물질에 기인한 염증 개선 연구는 진행되었으나(Jung et al., 2003), 특정 염증 질환 중 하나인 염증성 장 질환에 대한 선행 연구는 미비하기 때문에 DSS-유도 대장염증 모델을 이용한 산복사나무의 궤양성 대장염 개선의 효과를 확인해 보고자 본 연구를 진행하였다.
재료 및 방법
추출물
산복사나무(Prunus Davidiana(Carrière) Franch.) 가지-수피(채집지역: 울릉도)의 추출물(wild peach extract, WPE)은 한국생명공학연구원 생물소재은행에서 분양받아 사용하였다(분양번호: KPM031-092). 세포실험에 사용된 추출물은 dimethyl sulfoxide(DMSO; Sigma-Aldrich, USA)를 이용하여 100 mg/mL의 농도로 녹인 후, Phosphate-Buffered Saline(PBS)로 10 mg/mL의 농도로 희석하여 사용하였다. 동물실험에 사용된 추출물은 한국생명공학연구원 생물소재은행에서 산복사나무 줄기-수피의 원물(채집지역: 울릉도)을 분양받아 에탄올을 용매로 1.5시간 동안 Sonication한 후 여과하여 상등액을 동결건조 하였다. 추출수율은 20.3%였으며, 실험 시 PBS로 투여 농도에 맞게 현탁하여 사용하였다.
DSS-유도 동물 모델 제작
실험동물은 대한바이오링크(Eumseong, Korea)에서 생산된 6-7주령의 수컷, 20-22 g의 C57BL/6N 마우스를 사용하였다. 입고된 마우스는 7일간의 순화기간을 거쳐 실험에 적절한 마우스를 선별하여 사용하였다. 사육환경은 12시간 간격으로 낮과 밤을 유지하였고, 실내 온도(23 ± 2°C) 및 습도(40-60%)를 적정수준으로 유지하였다. 대장염증 동물 모델 제작을 위하여 DSS를 멸균한 수돗물(음용수)에 2.0% 농도로 섞어 자유급수 형태로 제공하였다(Fig. 1). 5일간 2.0% DSS를 제공한 이후 DSS 공급을 중단하고, 시험 종료 시까지 일반 음용수로 교체하여 제공하였다. PBS와 산복사나무 추출물은 25 g의 마우스를 기준으로 0.2 mL 용량으로 feeding needle catheter(Zonde)를 구강 내로 삽입하여 위장관 내에 투여하였다. 본 실험은 재단법인 홍천메디칼허브연구소 실험동물운영위원회(Institutional Animal Care and Use Committee, IACUC)의 승인(승인번호: HIMH A23-02)을 받아 규정에 따라 진행하였다.
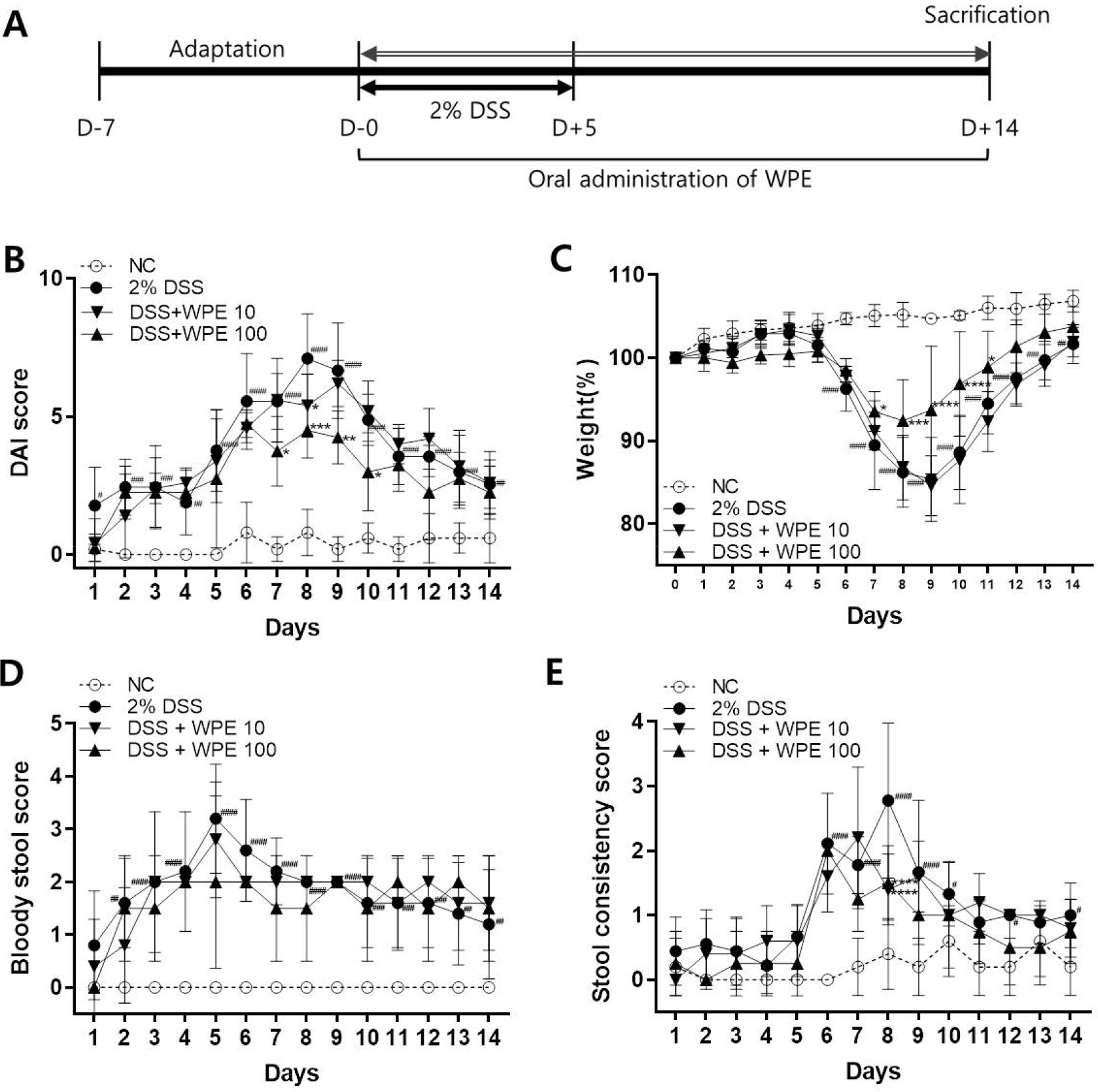
Fig. 1.
Effect of wild peach extract (WPE) on disease activity index (DAI) considering body weight loss, bloody stool, and stool consistency. The mice were administered 2.0% DSS with drinking water for 5 days. (A) Schematic diagram illustrating the study design. (B) DAI score, (C) Weight loss, (D) Bloody stool score, and (E) Stool consistency score were measured daily. #P < 0.05, ##P < 0.01, ###P < 0.001, ####P < 0.0001 vs NC; *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001 vs 2.0% DSS.
질병활성지수(Disease Activity Index, DAI) 측정
질병활성지수는 몸무게 변화, 혈변 정도, 설사 정도를 Table 1의 기준에 따라 점수화하여 각 항목의 점수를 합산한 점수로 계산하였다(Berberat et al., 2005). 몸무게의 변화는 시험 개시 전 측정한 몸무게를 기준으로 매일 오전에 같은 시간에 측정한 몸무게의 비율을 기준으로 점수화하였다. 혈변 확인을 위해, 매일 오전 같은 시간에 마우스를 깨끗한 개별 케이지로 이동하여 변을 수거하였고, Coloscreen III(Helena Laboratories, USA)을 이용하여 잠혈 유무를 확인하여 점수화하였다. 또한 설사 정도는 수거한 변의 경도를 확인하여 기준에 따라 점수화하였다.
Table 1.
Disease Activity Index (DAI) for colitis
| Score | Weight Loss (%) | Bloody Stool | Stool Consistency |
| 0 | None | None | Normal |
| 1 | 0-10% | - | Watery but still formed |
| 2 | 10-15% | Hemoccult (+) | Loose stools |
| 3 | 15-20% | - | - |
| 4 | > 20% | Gross bleeding | Diarrhea |
혈중 사이토카인 및 Myeloperoxidase(MPO) 측정
실험 개시 후 14일째, 마우스를 심마취 한 후, 안와에서 채취한 혈액을 2,500 rpm에서 10분간 원심분리하여 혈장을 분리하여 분석하였다. 혈중 IL-6 및 IL-22의 분비량은 ELISA Kit(R&D systems, USA)를 이용하여 분석하였다. 또한 혈중 Myeloperoxidase(MPO)는 Mouse MPO ELISA Kit(Invitrogen, USA)을 이용하여 분석하였다.
대장 조직의 병리학적 분석
실험 종료 시 대장 및 비장을 적출하여 맹장부터 직장까지의 길이를 측정하고, 맹장을 제거한 대장 조직을 PBS로 잔변을 세척한 후 대장과 비장의 무게를 측정하였다. 이후 대장은 10% formalin 용액으로 대장 내부를 고정해 주고, Swiss rolling법으로 대장을 말아 조직 고정용 카세트에 담고 10% formalin 용액으로 고정하였다. 대장의 염증 정도는 Hematoxylin & Eosin(H&E) 염색법으로 확인하였다. 대장의 염증 정도는 Table 2의 기준에 따라 면역세포 침윤 정도(0-3점)와 장 점막의 형태학적 손상 정도(0-3점)를 합산한 결과로 비교하였다(Urben et al., 2014). 또한 장 점막의 손상 정도는 장샘의 소실이 전체 점막층의 2/3 이상인 부위의 길이를 측정하여 장 전체 길이에 대한 비율로 계산하여 군간 비교하였다.
Table 2.
Histological scores for colitis
세포배양
인간 대장암 세포주인 HT-29 세포주는 한국세포주은행(Korean Cell Line Bank, KCLB; Korea)에서 분양받아 배양하였다. HT-29 세포는 300 mg/L L-glutamine, 25 mM HEPES, 25 mM NaHCO3가 함유된 Rosewell Park Memorial institute(RPMI) 1640(Corning, USA)에 10% FBS와 penicillin-streptomycin을 첨가한 배양액을 사용하여 37°C, 5% CO2 세포배양기(Thermo Fisher Scientific, USA)에서 배양하였다.
세포생존율
계대 배양한 HT-29 세포주를 48 well plate에서 24시간 배양한 후, WPE를 농도별(0-1600 µg/mL)로 처리 후 24시간을 더 배양하였다. 이후 EZ-CYTOX(Dogen, Korea)를 첨가한 후 1시간 배양하였다. Microplate reader(Bio-rad, USA)를 이용하여 450 nm에서의 흡광도를 측정하였다. 이후, WPE를 0 µg/mL의 농도로 처리한 well의 OD 값을 기준으로 흡광도를 비교하여 세포생존율을 계산하였다.
세포에서 분비된 활성산소 분석
48 well plate에 HT-29 세포주를 전배양한 후, WPE를 농도별로 처리하여 1시간 배양하고, 2.0% DSS와 WPE를 처리하여 24시간 배양한 후 100 µM의 DCFH-DA(Sigma aldrich, USA)를 처리하여 37°C에서 30분간 반응시켰다. 이후 PBS로 세포 표면을 세척한 후 형광플레이트리더(Molecular Devices, USA)를 이용하여 485 nm(Excitation)와 525 nm(emission)에서 형광값을 측정하여 분석하였다.
세포에서 분비된 Cytokine 분석
6 well plate에 HT-29 세포주를 전배양한 후, WPE를 농도별로 처리하여 1시간 배양하고, Tumor necrosis factor-α(TNF-α; PeproTech, USA)를 10 ng/mL의 농도로 처리하여 3시간을 더 배양한 후 세포배양액을 이용하여 분석을 진행하였다. 세포의 Interleukin-8(IL-8)의 분비량은 Human IL-8 ELISA kit(R&D systems, USA)를 이용하여 분비량을 분석하였다.
통계처리
모든 통계 분석은 Graphpad prism 8 version 8.3.4(Graphpad software, USA)를 이용하여 분석하였다. 실험의 모든 결과는 평균(means) ± 표준편차(standard deviation, SD)로 나타내였다. 군간의 비교는 ANOVA로 하였으며, 사후 검증은 Dunnett’s multiple comparisons test로 하였다. p값이 0.05 미만일 때 통계적인 유의성이 있는 것으로 간주하였다.
결과 및 고찰
질병활성지수
동물모델에서 DSS에 의한 대장염증 유발 정도를 확인하기 위하여 몸무게 변화, 혈변의 유무, 변의 설사 지수 등을 확인하였다. 대장염증이 유발됨에 따라 마우스의 몸무게는 감소하고 혈변이 증가하며 설사 지수가 높아지는 양상을 보이게 된다(Valatas et al., 2015). 본 실험을 위하여 2.0%의 DSS를 5일간 투여하여 대장염증을 유발하였고, DSS가 투여되는 기간에는 몸무게의 변화가 크지 않았다. 하지만 DSS 투여가 종료되는 시점인 5일째부터 몸무게는 감소하기 시작하여 9일째(85.38 ± 5.05%)에 가장 낮은 몸무게가 확인되었다. 추출물 처리에 따른 몸무게 변화를 살펴보면, WPE를 10 mg/kg(저농도)으로 투여하였을 때에는 몸무게 감소의 차이가 DSS군과 차이를 보이지 않았으나, 100 mg/kg(고농도)으로 투여하였을 때에는 시험 개시 후 8일째(92.43 ± 4.96%) 가장 낮은 몸무게가 확인되었고, 9일째에는 오히려 증가한 93.70 ± 7.70%로 DSS군과 비교하였을 때 유의한 차이를 보였다(Fig. 1C).
혈변의 경우에는 DSS 투여와 동시에 잠혈이 보이기 시작하여 5일째에는 혈변이 3.20 ± 1.03으로 가장 높게 관찰되었으나 고농도 투여군의 경우에는 2.00 ± 1.63으로 혈변이 줄어든 것을 확인할 수 있었다. 반면에 저농도로 처리한 경우에는 2.80 ± 1.10으로 저농도보다 고농도에서 혈변이 다소 적게 관찰되었다(Fig. 1D).
대장염증을 유발한 마우스에서 설사의 정도를 살펴본 결과, DSS 투여 후 8일째에 가장 높은 설사 점수가 관찰된 것에 반해 WPE 투여군은 저농도의 경우에 1.40 ± 0.55, 고농도를 투여한 경우에는 1.50 ± 0.58로 모두 유의하게 감소되었다. 이후에도 DSS군에 비해 감소된 양상을 확인할 수 있었다(Fig. 1E).
몸무게의 변화, 혈변, 설사 정도를 모두 합산하여 대장염증 유발 정도를 예측할 수 있는 질병활성지수로 분석하여 본 결과, DSS 유발 8일째에 7.11 ± 1.62로 가장 높게 확인된 반면에, WPE를 투여한 경우에는 저농도에서는 5.40 ± 1.14, 고농도에서는 4.50 ± 1.00으로 농도 의존적으로 감소한 것을 확인하였다(Fig. 1B). 이를 통해 DSS에 의해 유도된 대장염증이 산복사나무 추출물에 의해 회복되는 것을 임상적 지표로 확인할 수 있었으며, 저농도보다는 고농도에서 효과적이었다.
대장 및 비장 변화
DSS를 투여하여 대장염증이 유발된 경우에는 염증세포 침윤에 의해 대장의 길이는 짧아지고, 비장의 무게는 증가하게 되며, 이러한 증상은 대장염증의 유발 정도를 평가하는 지표가 된다(Chassaing et al., 2014). 시험 종료 시 대장과 비장을 적출하여 길이와 무게를 측정하였을 때, 대장길이는 건강군(7.90 ± 0.61 cm)에 비해 DSS군이 7.22 ± 0.28 cm로 다소 짧아진 것을 확인하였다. 반면에 저농도 투여군은 7.39 ± 0.44 cm, 고농도 투여군은 7.90 ± 0.35 cm로 회복되었다(Fig. 2A, 2B). 비장은 DSS군에서 110.5 ± 14.68 mg으로 건강군에 비해 1.84배 정도 증가하였으나, WPE 투여에 의해 유의하게 감소하였다. 특히 고농도 투여군에서는 72.45 ± 16.1 mg으로 현저히 감소한 것을 확인할 수 있었다(Fig. 2D).
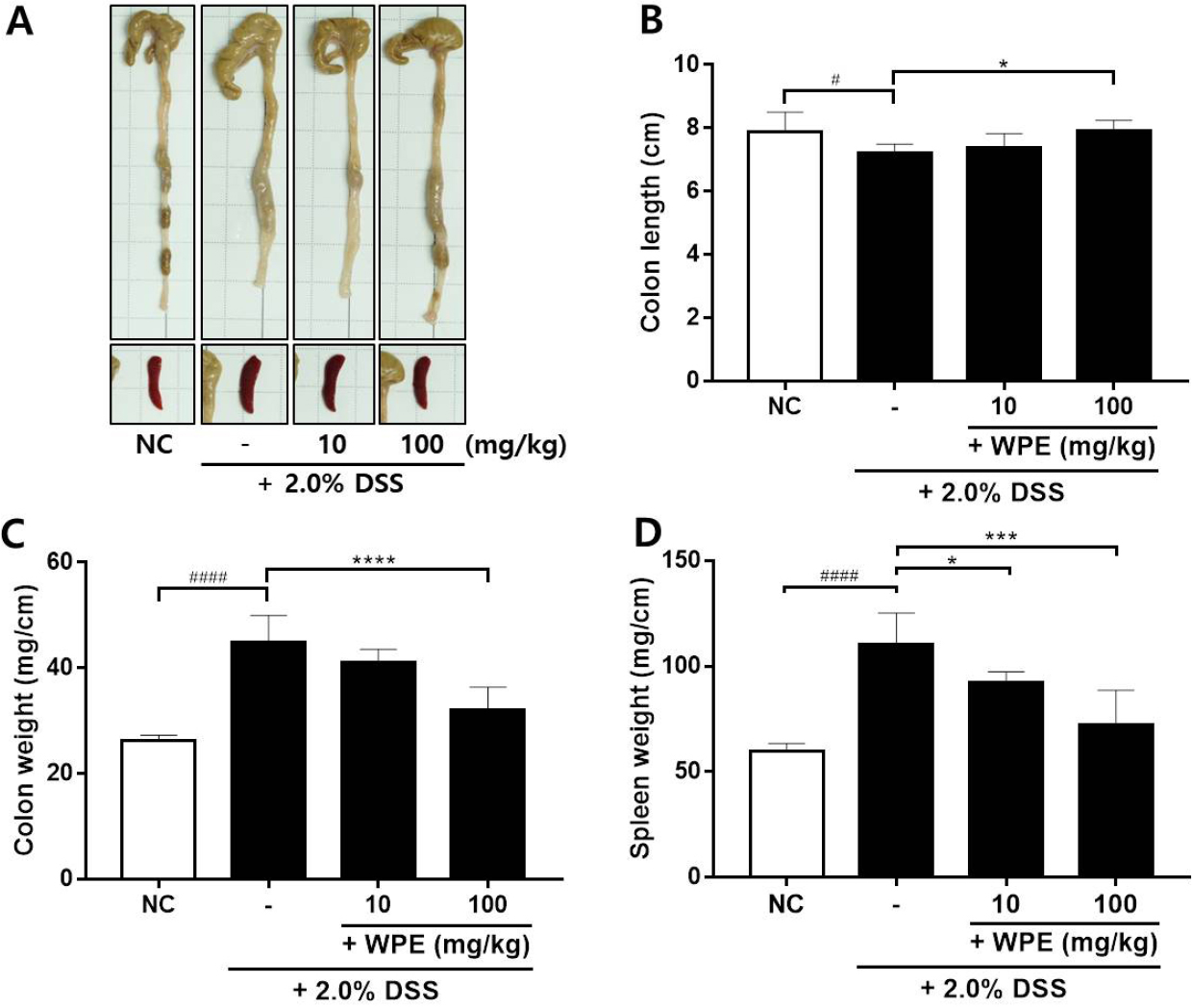
Fig. 2.
Effect of WPE on colon shortening and spleen enlargement. (A) The colon and spleen morphology. (B) Colon length increased with WPE (10 or 100 mg/kg) treatment. (C) Colon weight (per body weight), and (D) Spleen weight per body weight increased with 2.0% DSS administration but decreased with WPE treatment. #P < 0.05, ####P < 0.0001 vs NC; *P < 0.05, ***P < 0.001, ****P < 0.0001 vs 2.0% DSS.
대장염증이 유발되고 손상이 회복되는 과정에서 대장의 내벽이 두꺼워지고 무게가 증가하게 되는데(Chassaing et al., 2014), 이를 바탕으로 건강군(26.2 ± 1.09 mg/cm)에 비해 DSS군은 44.98 ± 4.98 mg/cm로 현저히 증가한 것을 확인하였다. 하지만 WPE를 저농도로 투여하였을 때에는 41.13 ± 2.39 mg/cm으로, 고농도로 투여하였을 때에는 32.08 ± 4.29 mg/cm로 감소되었다(Fig. 2C). 이를 통해 대장염증에 의한 대장의 손상이 산복사나무 추출물의 투여 농도에 의존적으로 감소 되었다고 예측할 수 있다.
혈중 사이토카인 및 MPO 분비량 비교
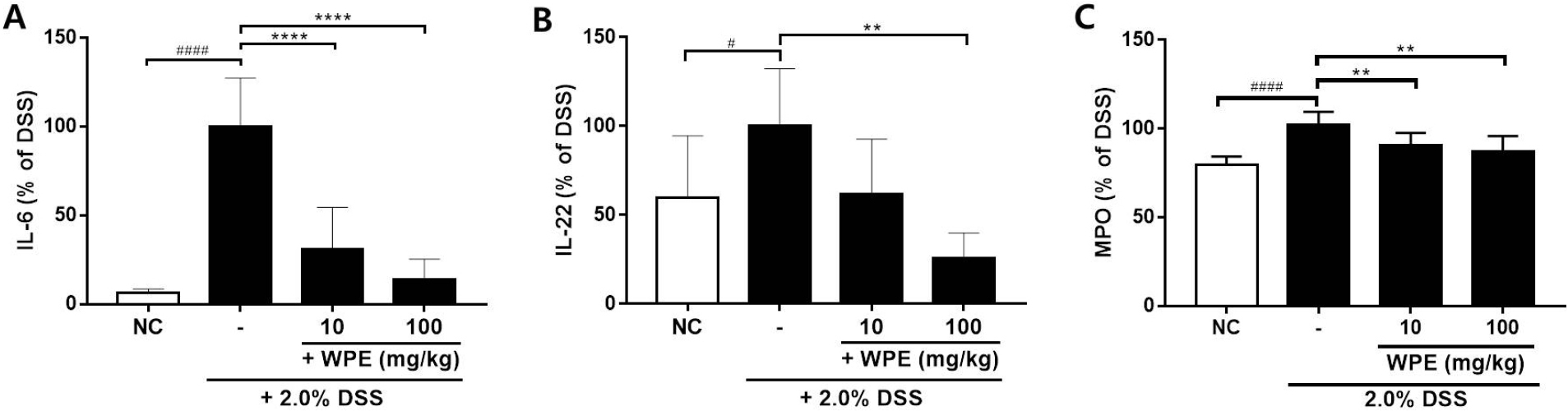
호염증 사이토카인인 IL-6은 여러 염증 반응을 유발하는 사이토카인으로 장의 상피 세포 장벽에 필수적인 역할을 하는 것으로 알려져 있다(Suzuki et al., 2011). 또한 IL-22는 손상된 장 점막의 재생에 영향을 미치는 사이토카인(Ouyang and O’Garra, 2019)으로 대장염증이 유발되어 장이 손상됨에 따라 혈중 IL-22 양이 증가하게 된다. DSS로 대장염증을 유발하였을 때, DSS군(100.00 ± 27.33%)의 혈중 IL-6는 정상군에 비해 15배 이상 증가하였으나 WPE를 투여함에 따라 저농도에서는 30.86 ± 23.59%, 고농도에서는 13.73 ± 11.57%로 농도의존적으로 현저히 감소하였다(Fig. 3A). IL-22 역시 정상군(59.75 ± 34.75%)에 비해 DSS군(100.00 ± 32.25%)이 두 배 가까이 증가하였으나, WPE를 투여하였을 때는 감소하여 고농도로 투여한 경우에는 25.89 ± 14.10%로 유의한 차이를 보였다(Fig. 3B).
호염증 마커인 MPO 역시 DSS에 의해 장 점막으로 염증세포가 침윤되면서 증가하게 되는데 이로 인해 혈중 MPO 역시 증가하게 된다(Chassaing et al., 2015). 이에 따라 혈중 MPO 분비량을 확인해 본 결과, 정상군(81.18 ± 6.28%)에 비해 DSS군(99.99 ± 8.75%)에서 유의하게 증가되었으나, WPE를 저농도로 투여하였을 때 88.34 ± 4.91%로 감소하였고, 고농도로 투여하였을 때에는 85.19 ± 7.71%로 농도 의존적으로 유의하게 감소하여 산복사나무의 사이토카인 및 MPO 활성 억제에 도움을 줄 수 있는 것을 확인하였다(Fig. 3C). 대장염증의 유발 정도를 예측할 수 있는 중요한 사이토카인인 IL-6 및 IL-22, 혈중 염증 마커인 MPO 모두 산복사나무 추출물에 의해 감소되었고, 이는 대장염증 완화 정도를 평가하는데 중요한 기준이 될 수 있다.
조직병리학적 분석
DSS 투여에 의한 장 점막의 손상 정도를 평가하기 위하여 대장 조직에서의 염증 세포 침윤 정도와 장 점막 구조의 손상 정도 등을 H&E 염색법을 이용하여 평가하였다(Urben et al., 2014). 적출한 대장 전체를 swiss rolling법으로 고정한 후 대장 전체 길이 대비 손상부분의 길이를 측정하여 손상의 정도를 비교하였다.
손상 정도는 Table 2에 표시된 평가 기준에 따라 점수화되었으며, 염증세포 침윤 정도와 구조 손상 정도를 합산하여 조직병리학적 분석에 따른 염증 정도를 비교 분석하였다. 염증세포 침윤 정도는 대조군에서 모두 3인데 반해, 고농도로 투여하였을 때 2.00 ± 1.00로 유의하게 감소하였으며, 구조 손상 정도 역시 3인 DSS군에 비해 1.67 ± 1.16으로 감소하였다(Fig. 4). 이에 따라 DSS군은 염증 지수가 6.00 ± 0.00으로 장 점막 손상 정도가 전형적으로 심하게 나타나고 있는 반면, 저농도군은 3.67 ± 2.08로 유의하게 감소하여 손상이 다소 완화되었다. 장 길이 대비 손상 정도 역시 DSS군(15.68 ± 4.70%)에 비해 저농도에서는 10.41 ± 3.42%로, 고농도에서는 8.77 ± 13.9%로 농도 의존적으로 감소되는 경향을 확인하였다. 이를 통해 산복사나무 추출물에 의해 대장의 염증 세포 침윤과 장 점막 구조의 손상이 DSS군에 비해 줄어든 것을 확인하였고, 대장 염증이 완화될 수 있음을 알 수 있었다.
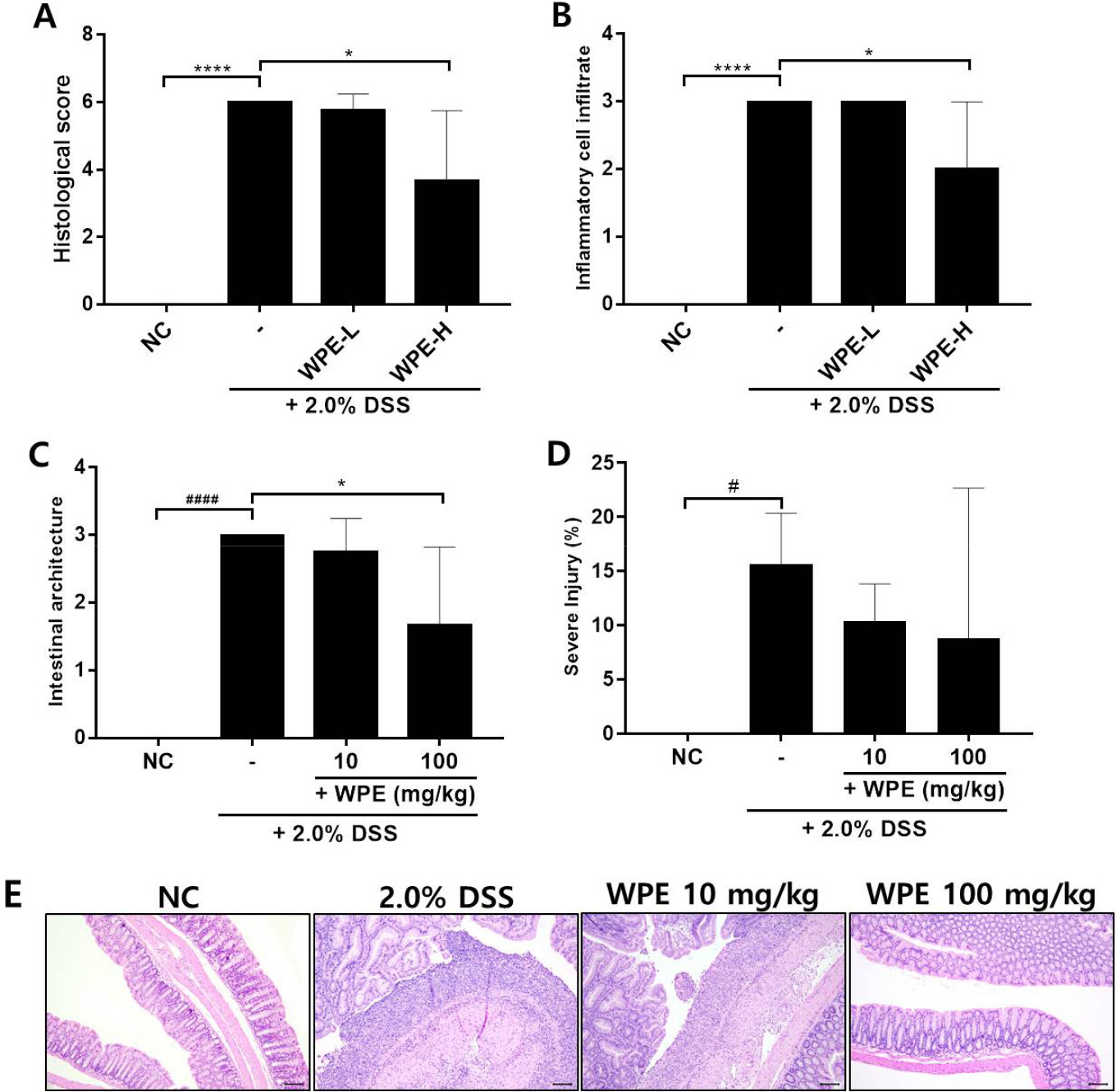
Fig. 4.
Effect of WPE on colon histological analysis in DSS-induced colitis mice. (A) Histological scores, (B) Inflammatory cell infiltration scores, and (C) Intestinal architecture scores of the colon in colitis mice. (D) Severe injury of the colon. (E) Representative images of the colon stained with H&E. Scale bar: 100 µm. #P < 0.05, ####P < 0.0001 vs NC; *P < 0.05 vs 2.0% DSS.
세포주(HT-29)에서 산복사나무의 염증 완화 검증
산복사나무 추출물(WPE)을 0-1600 µg/mL의 농도로 HT-29 세포주에 처리하여 WST1을 이용하여 세포생존율을 확인하였다. WPE를 800 µg/mL를 처리하여도 97.24 ± 1.28%로 세포독성은 보이지 않았으나, 1600 µg/mL에서는 46.82 ± 1.10%로 급감하였다(Fig. 5A). 이 결과를 바탕으로 이후의 실험에서는 200 µg/mL 이하의 농도로 처리하여 세포에서의 염증 완화를 검증하였다.
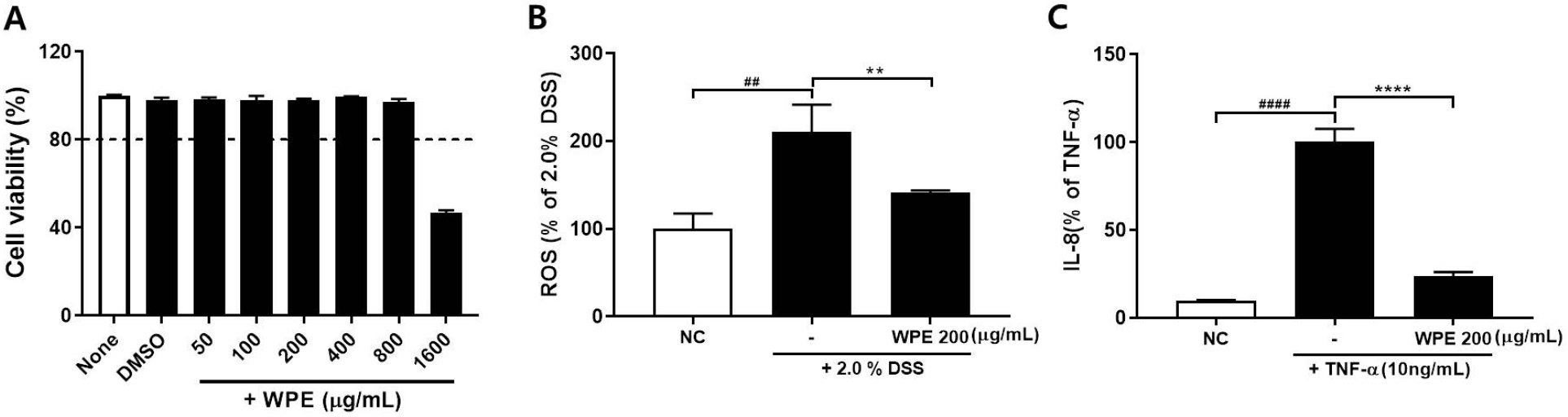
Fig. 5.
Effect of WPE on reactive oxygen species (ROS) and pro-inflammatory cytokine interleukin-8 (IL-8) with WPE. (A) Cell viability evaluated by WST1 assay in HT-29 cell with WPE. (B) Intracellular ROS generation and (C) IL-8 expression were reduced by WPE treatment in HT-29 cells. ##P < 0.01, ####P < 0.0001 vs NC; **P < 0.01 vs 2.0% DSS, ****P < 0.0001 vs TNF-α.
동물모델에서 사용된 대장염증 유발 물질인 2.0% DSS를 HT-29 세포주에 처리하여 활성화시켰을 때, 세포에서 분비되는 활성산소(Reactive Oxygen Species, ROS)의 양을 DCFH-DA를 이용해 확인하였다. 2.0% DSS에 의해 활성화 되었을 때, ROS는 대조군에 비해 2배 이상 증가하였으나, WPE로 인해 DSS군 대비 66.98 ± 1.02%로 유의하게 감소하였다(Fig. 5B).
염증성 사이토카인인 TNF-α(10 ng/mL)를 인간 대장암 세포인 HT-29 세포주에 처리하여 활성화시켰을 때, 세포에 의해 합성되는 주요 호중구 활성화 사이토카인으로 알려진 IL-8(Gross et al, 1995)의 분비량을 ELISA법으로 확인하였다. TNF-α 처리에 의해 증가된 IL-8(DSS군: 100.21 ± 7.37 %)은 WPE를 200 µg/mL 농도로 처리하였을 때에는 23.88 ± 2.25%로 현저히 감소된 것을 확인하였다(Fig. 5C). 이를 통해 마우스 뿐만 아니라 인간의 대장암 유래 세포주에서도 산복사나무 추출물의 항염증 효과를 확인하였고, 이와 같은 결과를 바탕으로 산복사나무의 대장염증을 완화시킬 수 있는 소재로서의 개발 가능성을 확인할 수 있었다.
요약 및 결론
본 연구는 산복사나무의 DSS로 유도된 대장염증의 완화 효능을 검증하기 위하여 세포주와 동물모델을 이용하여 진행되었다. 메탄올을 용매로 하여 추출한 산복사나무의 추출물은 인간의 대장암 유래 세포주인 HT-29에서 세포독성을 나타내지 않았으며, 2.0% DSS로 대장염증 반응을 유도하였을 때, 산복사추출물에 의해 활성산소 증가를 억제하였고, TNF-α로 염증 반응을 유도하였을 때 IL-8의 증가를 현저히 억제하였다. 2.0% DSS를 투여한 대장염증 마우스 모델에 산복사나무 추출물을 농도별로 투여하였을 때 질병활성지수(몸무게, 혈변, 설사)가 감소되었음을 확인하였으며, DSS에 의해 증가된 염증성 사이토카인인 IL-6과 장 점막 손상에 밀접한 IL-22의 혈중 농도 역시 감소시켰다. 장 손상 마커인 MPO 역시 대조군에 비해 유의하게 감소하였다. 대장염증의 임상적인 증상인 대장 길이 역시 산복사나무 추출물에 의해 회복되었고, 비장의 무게 증가 역시 유의하게 감소시켜 대장염증을 개선하였음을 알 수 있었다. 또한, 산복사나무 추출물의 처리로 인해 대장조직의 염증세포침윤 정도와 형태학적 손상 정도 및 장의 손상 정도 역시 개선되었음을 알 수 있었다. 이러한 결과들을 종합해 볼 때, 산복사나무는 대장염증 완화에 도움을 줄 수 있을 것으로 기대할 수 있다.
본 연구를 통해, 선행되었던 항산화 및 항염증 검증에서 더 나아가 특정 기능성에 대한 검증을 통해 산복사나무의 기능성 소재로서 개발 가능성을 확인할 수 있었다. 이와 더불어 임상적인 개선 결과를 뒷받침해 줄 수 있는 기전 연구와 산복사나무 추출물에서 분리 동정한 단일 물질을 이용한 검증 등의 지속적인 연구가 필요하다고 생각된다. 이를 통해 산복사나무의 건강기능식품 및 의약품의 소재로서의 개발 가능성을 높일 수 있을 것으로 기대한다.