서 론
재료 및 방법
실험재료
시료 제조
HPLC 분석
생리활성 분석
통계처리
결과 및 고찰
기능성 물질 함량
총 폴리페놀 및 플라보노이드 함량
DPPH 및 ABTS 라디칼 소거능
요 약
서 론
더덕(Codonopsis lanceolata)은 Campanulaceae에 속하는 다년생 식물이며 중앙아시아, 동아시아 및 남아시아에 주로 분포한다(He et al., 2015). 더덕은 약용작물로써 자양강장제로 불리는 인삼의 대용으로 사용되어 왔다(Kim and Chung, 1975). 더덕은 항산화 효과 및 항균 효과도 우수하며(Lee and Ryu, 2019), 생뿌리 또는 말린 뿌리를 약재로 사용하기도 한다. 더덕 뿌리의 경우 정신 신경증과 경련, 암을 치료하는 데 사용하고 있다(Hossen et al., 2016).
Tangshenoside와 lobetyolin은 Codonopsis 속 식물의 주요 화합물이자 지표성분으로, phenylpropanoid 배당체인 tangshenosides I는 더덕에서 처음 보고되었으며(Mizutani et al., 1988) 근위축을 예방하고(Kim et al., 2022), 생식 기능 장애를 회복하는 데 효과적임이 보고된 바 있다(Ushijima et al., 2008). Polyacetylene계열인 lobetyolin은 요산 생성과 관련 있는 xanthine oxidase를 억제하여 통풍을 치료하고 신장 결석의 형성을 예방하며(Yoon and Cho, 2021), 위 점막 손상을 보호하는 역할을 한다(Song et al., 2008).
더덕의 페놀성 화합물은 더덕의 섭취에 따른 잠재적인 건강상 이점과 관련하여 가장 중요한 물질이다. 최근 연구에서 더덕의 뿌리로부터 페놀성 화합물이 다량 검출되었으며, 항암제 및 항염증제의 재료로써 더덕의 가치가 입증되고 있다(Du et al., 2018). 특히 더덕 껍질(skin)의 경우, 육질(flesh)보다 많은 양의 기능성물질들이 검출되기도 하였다(Jung and Ryu, 2018). 이상의 연구 결과를 토대로 기능성 소재가 풍부하게 함유된 더덕의 껍질을 포함한 식품으로의 활용 방안 및 기능성 물질의 증대와 관련한 연구가 기대된다.
본 연구는 국내산 더덕 6종과 중국산 더덕 6종을 육질과 껍질로 나누어 tangshenoside I과 lobetyolin 및 5종의 2차대사산물 함량을 측정하고 총 폴리페놀 함량, 총 플라보노이드 함량 및 DPPH, ABTS 라디칼 소거능을 측정하여 더덕 껍질을 활용한 기능성식품 개발에 기초자료로 이용하고자 한다.
재료 및 방법
실험재료
국내산 더덕은 3년생이며 홍천, 횡성, 정선, 나주, 제주에서 재배된 것과 홍더덕을 이용하였다. 중국산 더덕은 6년생이며 재배지 및 수입상에 따라 아산, 정원, 지안, 신선 더덕으로 통칭하고 여기에 청더덕과 홍더덕을 추가하여 사용하였다. 채취한 시료는 흙을 털어내고, 가볍게 물로 세척하였다. 세척된 시료는 페이퍼타올로 물기를 제거한 후 육질과 껍질을 분리하여 -70°C에서 48시간 동안 보관하였다. 이후 동결건조 및 분말화 하여 실험에 사용하였다.
High-performance liquid chromatography(HPLC)를 통한 기능성물질의 분석에 사용된 acetonitrile, water, ethanol은 대정화금(Siheung, Korea)으로부터 구입하였으며, 2차대사산물의 함량 측정을 위한 표준물질로 p-coumaric acid, caffeic acid, chlorogenic acid, gallic acid, vanillic acid가 사용되었다. 표준물질들은 Chemface(Wuhan, China)로부터 구입하여 사용하였다. 생리활성 분석에 사용된 모든 용매와 시료들은 대정화금(Siheung, Korea)과 Sigma Aldrich(St. Louis, MO, USA) 제품들을 사용하였다.
시료 제조
분말화하여 준비된 총 12종의 더덕은 시료 0.1 g당 70% 에탄올 1 ml을 가하여 24시간 실온에서 추출하였다. 추출물은 10분간 원심분리한 후, 상층액만을 0.22 µm syringe filter로 여과하여 사용하였다. Tangshenoside I과 Lobetyolin 및 5종의 기능성 물질 함량, 총 폴리페놀 함량, 총 플라보노이드 함량 측정을 위해 사용되는 추출물은 원액 그대로를 사용하였다. DPPH 라디칼 소거능과 ABTS 라디칼 소거능 측정에 사용된 추출물은 5,000 mg/L로 희석하여 사용하였다.
HPLC 분석
지표물질 분석에 사용된 표준물질은 tangshenoside I와 lobetytiolin을 사용하여 분석하였으며, 5종의 2차대사산물은 gallic acid와 vanillic acid, caffeic acid, p-coumaric acid, chlorogenic acid를 표준물질로 사용하여 분석하였다.
분석조건은 Diode array UV-vis 검출기가 장착된 Prominence HPLC system(Shimadzu, Kyoto, Japan)을 사용하여 C18 column(250”-4.6 mm, 5 µm, Shimadzu, Kyoto, Japan)을 통해 분석하였다. 이동상A는 water(formic acid 0.1%), 이동상B는 acetonitrile(formic acid 0.1%)을 사용하였고, 유속은 0.7 ml/min, 주입량은 10 µL, column 온도는 40°C를 유지하였다. 용매의 조성변화는 다음과 같다. 0분, 10% B; 5분, 10% B; 15분, 80% B; 20분, 80% B; 25분, 10% B; 30분, 10% B. 분석파장은 280 nm에서 분석하였다. 검량선은 표준물질 50-1000 mg/L 사이의 5 농도를 사용하여 작성하였으며, 각 성분의 면적은 표준물질의 검량선을 이용하여 정량 분석하였다.
생리활성 분석
총 폴리페놀 화합물 함량은 Anesini et al.(2008)의 방법을 변형하여 수행하였다. 추출물 100 µL에 Folin-Ciocalteu reagent 50 µL를 가하여 3분간 방치한 후 20% Na2CO3 용액 300 µL를 가하여 15분간 반응시켰다. 반응액에 DW 1,000 µL를 첨가하여 원심분리 한 후 상등액만을 취하여 96 well plate로 200 µL씩 분주하였다. 반응액은 분광광도계(Multiskan FC Microplate Photometer, Thermo Fisher Scientific Inc., Waltham, MA, USA)를 사용하여 측정하였으며, 흡광도 값은 738 nm에서 측정하였다. 표준물질은 gallic acid를 이용하여 검량선을 작성하였다. 회귀식은 y = 0.0043x + 0.0562 (R2 = 0.998)로 나타났으며, mg GAE(gallic acid equivalent)/g(dry basis)로 나타내었다.
총 플라보노이드 함량은 Re et al.(1999)의 방법을 일부 변형하여 수행하였다. 추출물 500 µL에 10% aluminium nitrate 100 µL와 1 M potassiumacetate 100 µL를 가한 후 40분간 반응시켰다. 반응액은 96 well plate로 옮겨 흡광도 값 405 nm에서 측정하였다. 표준물질은 quercetin을 사용하여 검량선을 작성하였다. 회귀식은 y = 0.0128x + 0.0571 (R2 = 1)로 나타났으며, mg QE(quercetin equivalent)/g(dry basis)으로 나타내었다.
DPPH 라디칼의 소거활성은 Blois(1958)의 방법을 변형하여 수행하였다. 희석된 추출물 100 µL에 0.15 mM DPPH 100 µL을 가한 후 30분간 암실에서 반응시켰다. 반응액은 흡광도 값 519 nm에서 측정하였다. 표준물질은 ascorbic acid를 사용하였다. 측정된 시료의 라디칼 소거능은 전자공여능(Electron donating ability, EDA)으로 나타냈다.
ABTS 라디칼 소거활성 측정을 위하여 ABTS는 7.4 mM로 제조하여 2.6 mM Potassium persulfate와 1:1 비율로 24시간 반응시킨 뒤, 1X PBS buffer에 희석하여 사용하였다(O.D = 0.7 ± 0.03). 희석된 추출물 20 µL에 ABTS 반응액 180 µL를 가하여 10분간 반응시켰다. 반응액은 흡광도 값 738 nm에서 측정하였다. 표준물질은 ascorbic acid를 사용하였다. 측정된 시료의 라디칼 소거능은 전자공여능으로 나타냈다.
통계처리
통계분석은 SPSS 28(SPSS Inc., Chicago, IL, USA)를 이용하여 각 실험의 평균과 표준편차를 계산하였고, ANOVA를 통한 Duncan 다중검정법(duncan’s multiple range test, p < 0.05)으로 사후 검정하였다.
결과 및 고찰
기능성 물질 함량
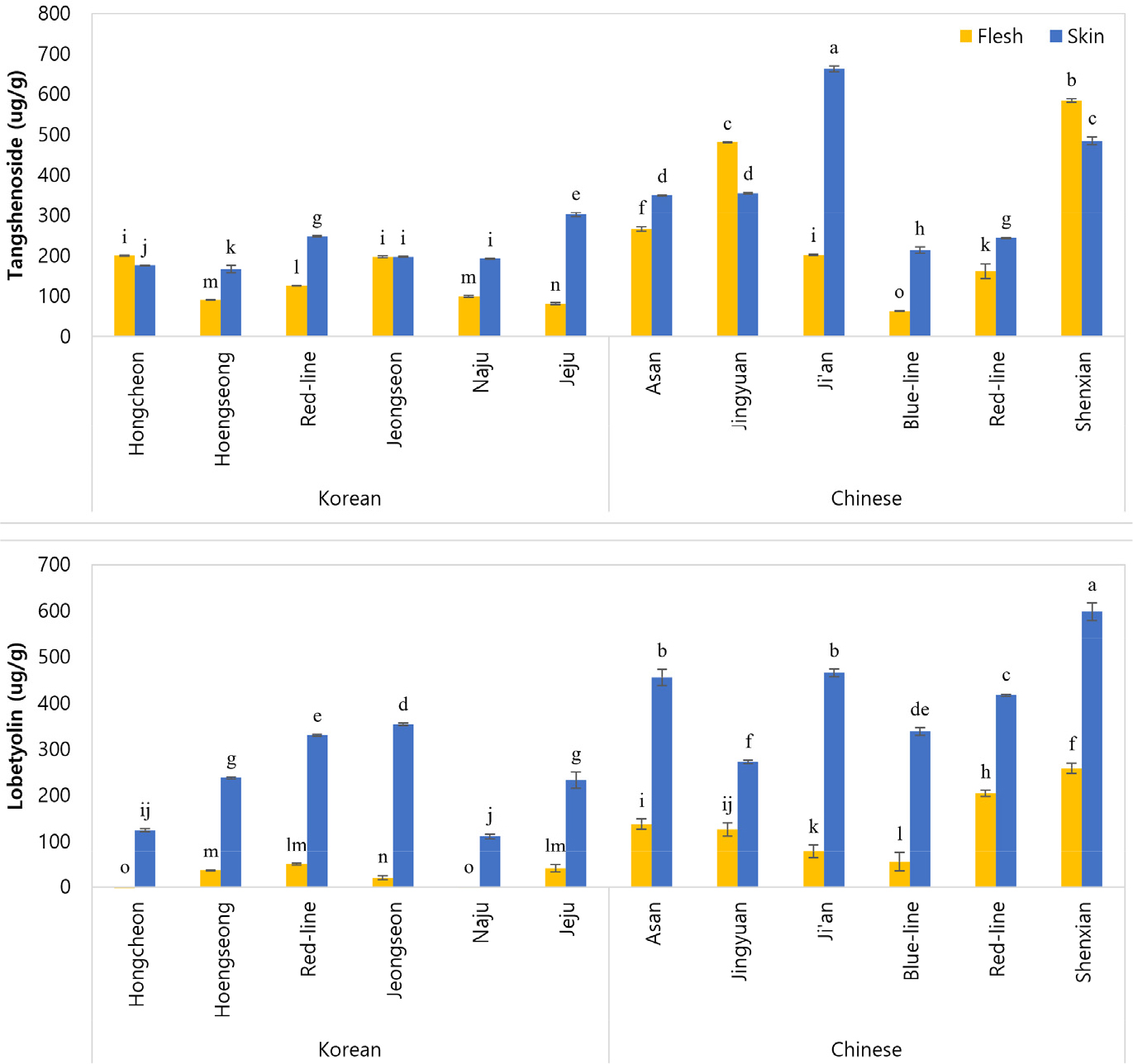
Tangshenoside I과 lobetyolin은 더덕의 지표성분으로, 인삼과 같이 더덕과 비슷한 향취를 가진 식물체와 혼합 가공되었을 경우 더덕의 혼입 여부를 확인하는데 사용된다. Tangshenoside I과 lobetyolin에 대한 효능은 아직 광범위하게 연구되지 않았지만, 더덕 내 대표성분으로 다량 함유 되어있어, 물질의 활용 방안이 점차 연구되고 있다. 이에 재배지 및 부위에 따른 기초 자료의 수집이 매우 중요하다. 더덕의 재배지 및 부위에 따른 tangshenoside I과 lobetyolin의 햠량을 분석하여 Fig. 1에 나타냈다. 국내산 더덕의 tangshenoside I 함량은 주로 껍질이 육질보다 높게 나타났으며, 제주 더덕의 껍질이 302.07 µg/g으로 가장 높은 tangshenoside I 함량을 나타냈다. 그 뒤로는 홍더덕 껍질(247.94 µg/g), 홍천 더덕 육질(200.46 µg/g), 정선 더덕 껍질(197.76 µg/g) 순서로 높은 tangshenoside I 함량을 보였다. 중국산 더덕 또한 대부분 껍질이 육질보다 높은 함량을 나타냈으며, 지안 더덕 껍질에서 662.97 µg/g으로 가장 높은 tangshenoside I 함량을 나타냈다. 그 뒤로는 신선 더덕 육질(584.39 µg/g), 신선 더덕 껍질(484.57 µg/g), 정원 더덕 육질(481.4 µg/g) 순서로 높은 tangshenoside I 함량을 보였다. lobetyolin 함량에서도 국내산과 중국산 더덕 모두 껍질이 육질보다 높게 나타났으며 국내산에서는 정선 더덕 껍질이 354.11 µg/g, 중국산에서는 신선 더덕 껍질이 598.2 µg/g으로 가장 높은 lobetyolin 함량을 보였다.
2차 대사산물은 식물체가 주위 환경으로부터 생존하기 위해 생성하는 방어 물질이다. 식물로부터 생산된 2차 대사산물은 다양한 생리활성들을 나타내며 약리성분으로 사용된다. 2차 대사산물 중 5종의 주요 페놀성 화합물을 분석하였다(Table 1). p-coumaric acid는 5종의 페놀성 화합물 중 가장 많은 양을 보였다. 국내산 중 제주 더덕 껍질에서 418.78 µg/g으로 가장 높은 p-coumaric acid 함량을 나타냈으며, 중국산 중 지안 더덕 껍질에서 720.02 µg/g으로 가장 높았다. Caffeic acid는 저밀도 지질단백질(low-density lipoprotein, LDL)의 산화를 억제하며 라디칼을 억제하는 등 우수한 항산화제의 역할을 한다(Gülçin, 2006). 국내산 더덕 중 횡성 더덕 껍질에서 52.65 µg/g으로 가장 높은 함량을 보였으며, 중국산 더덕 중 청더덕 껍질이 60.64 µg/g으로 가장 높게 나타났다. Chlorogenic acid는 간 보호 및 항 비만에 도움을 주는 물질로 높은 기능성을 가지고 있는 화합물이다(Yi et al., 2019). 국내산에서는 횡성 더덕 껍질에서 296.09 µg/g으로 가장 높았으며, 중국산에서는 홍더덕 껍질에서 392.5 µg/g으로 가장 높은 함량을 보였다. 국내산과 중국산 더덕에서 vanillic acid 함량은 제주 더덕 껍질(89.25 µg/g)과 지안 더덕 껍질(195.94 µg/g)이 가장 높은 함량을 보였다. Gallic acid 함량은 국내산 나주 더덕 껍질(74.81)과 중국산 홍더덕 껍질(87.57 µg/g)이 가장 높은 함량을 보였다. 5종의 페놀성 화합물 모두에서 껍질이 육질보다 높은 함량을 나타냈다. 이는 껍질이 더덕의 뿌리 중 외부와 직접적으로 맞닿아 있는 부분이자 1차 방어 체계로써 병해충 또는 환경적 변화로부터 보호하기 위하여 다량의 2차대사산물을 축적했을 것으로 보인다. 그러나 더덕의 특성 상 재배 기간이 길어 짐에 따라 껍질 부분은 섭취하기 어려울 정도로 질겨 지는데, 껍질에 풍부한 기능성 물질들을 효과적으로 섭취하기 위해서는 생육 1년 이내의 새싹 더덕을 활용하는 방안이 유리할 것으로 보인다. 새싹 더덕은 주로 수경재배를 통해 생산되는데, 새싹 더덕과 동일한 재배 방식을 가진 새싹 인삼의 수경재배 시 사용되는 인공 광원의 종류에 따라 2차 대사산물의 생합성에 영향을 주어, 기능성 물질 함량의 증대가 가능하다(Sadiq et al., 2023). 또한 caffeic acid와 gallic acid 같은 페놀성 물질들은 고온 처리에 따라 그 함량이 크게 감소하기 때문에 생으로 섭취하는 방법을 고려해야 할 것이다(Hong et al., 2007).
Table 1.
Concentrations of tested phenolic compounds in different parts of Korean and Chinese deodeok revealed by the HPLC analysis
| Place of collection | Plant parts | p-Coumaric acid | Caffeic acid | Chlorogenic acid | Vanillic acid | Gallic acid | |
| Korean | Hongcheon | Flesh | 411.7 ± 2.2g1) | 37.5 ± 0.8l | 105.48 ± 2.3m | ND | 43.98 ± 8.2gh |
| Skin | 377.24 ± 2.5h | 39.73 ± 0.4k | 66.88 ± 0.7op | 52.48 ± 2.5de | 71.91 ± 0.6bc | ||
| Hoengseong | Flesh | 147.82 ± 1.6h | 43.62 ± 0.5i | 185.02 ± 2.8i | 8.82 ± 2gh | 46.16 ± 4.2gh | |
| Skin | 282.45 ± 2.1j | 52.65 ± 0.5d | 296.09 ± 2.3d | 23.01 ± 5.9fg | 60.58 ± 0.9def | ||
| Red-line | Flesh | 209.02 ± 1.1m | 41.96 ± 0.4j | 107.52 ± 1.8m | ND | 42.06 ± 2.1gh | |
| Skin | 335.3 ± 10.8i | 45.58 ± 1.3gh | 62.43 ± 1p | 55.37 ± 16.4d | 67.11 ± 12cde | ||
| Jeongseon | Flesh | 417.11 ± 4.7g | 37.02 ± 0.4l | 47.61 ± 1.7q | ND | 37.26 ± 1.6h | |
| Skin | 343.18 ± 3.2i | 41.86 ± 0.2j | 68.34 ± 0.1o | 22.99 ± 1.9fg | 50.78 ± 0.9fg | ||
| Naju | Flesh | 230.31 ± 3l | 37.09 ± 0.4l | 63.59 ± 1.7p | ND | 44.5 ± 8.2gh | |
| Skin | 386.19 ± 8.4h | 42.18 ± 0.6j | 65.72 ± 0.5op | 29.99 ± 8.1f | 74.81 ± 2bc | ||
| Jeju | Flesh | 115.2 ± 1.5p | 39.58 ± 0.2k | 31.44 ± 1r | 3.9 ± 8.1gh | 45.27 ± 3.8gh | |
| Skin | 418.78 ± 4.8g | 46.08 ± 0.2g | 45.49 ± 0.5q | 89.25 ± 1.4c | 74.45 ± 1.4bc | ||
| Chinese | Asan | Flesh | 272.3 ± 6.2k | 44.07 ± 0.3i | 171.17 ± 1.7j | 77.83 ± 14.8c | 58.4 ± 13.3ef |
| Skin | 490.33 ± 16.9f | 53.27 ± 0.2cd | 271.1 ± 3.5e | 140.08 ± 5.3b | 87.06 ± 14.7a | ||
| Jingyuan | Flesh | 685.81 ± 6.4b | 59.95 ± 0.8a | 85.45 ± 1.9n | 28.99 ± 15.3f | 51.31 ± 4.1fg | |
| Skin | 521.28 ± 8.5e | 55.01 ± 0.4b | 197.28 ± 0.5i | 89.19 ± 24.5c | 85.67 ± 12.3a | ||
| Ji'an | Flesh | 285.27 ± 4.5j | 44.54 ± 0.5hi | 161.79 ± 3.8k | 57.59 ± 1.1d | 45.18 ± 0.4gh | |
| Skin | 720.02 ± 3.6a | 48.15 ± 1.4f | 195.33 ± 0.6i | 195.94 ± 1.4a | 70.16 ± 1.6cd | ||
| Blue-line | Flesh | 103.66 ± 2.2q | 45.91 ± 0.3g | 156.14 ± 3.8l | 36.6 ± 1.9ef | 47.52 ± 0.6gh | |
| Skin | 344.1 ± 1.1i | 60.64 ± 0.3a | 435.72 ± 1a | 148.75 ± 2.7b | 85.94 ± 0.9a | ||
| Red-line | Flesh | 128.37 ± 1.1o | 47.95 ± 0.5f | 308.68 ± 5.6c | 10.23 ± 2.1gh | 58.82 ± 0.8ef | |
| Skin | 341.14 ± 3i | 53.36 ± 0.1cd | 392.5 ± 3.8b | 29.32 ± 1.7f | 87.57 ± 1.1a | ||
| Shenxian | Flesh | 675.56 ± 5.3c | 49.83 ± 0.4e | 265.86 ± 2.4f | 35.61 ± 31.2ef | 59.04 ± 0.5ef | |
| Skin | 622.93 ± 7.3d | 54.15 ± 2.5bc | 210.38 ± 5.9g | 134.8 ± 9.7b | 81.29 ± 2.9ab | ||
총 폴리페놀 및 플라보노이드 함량
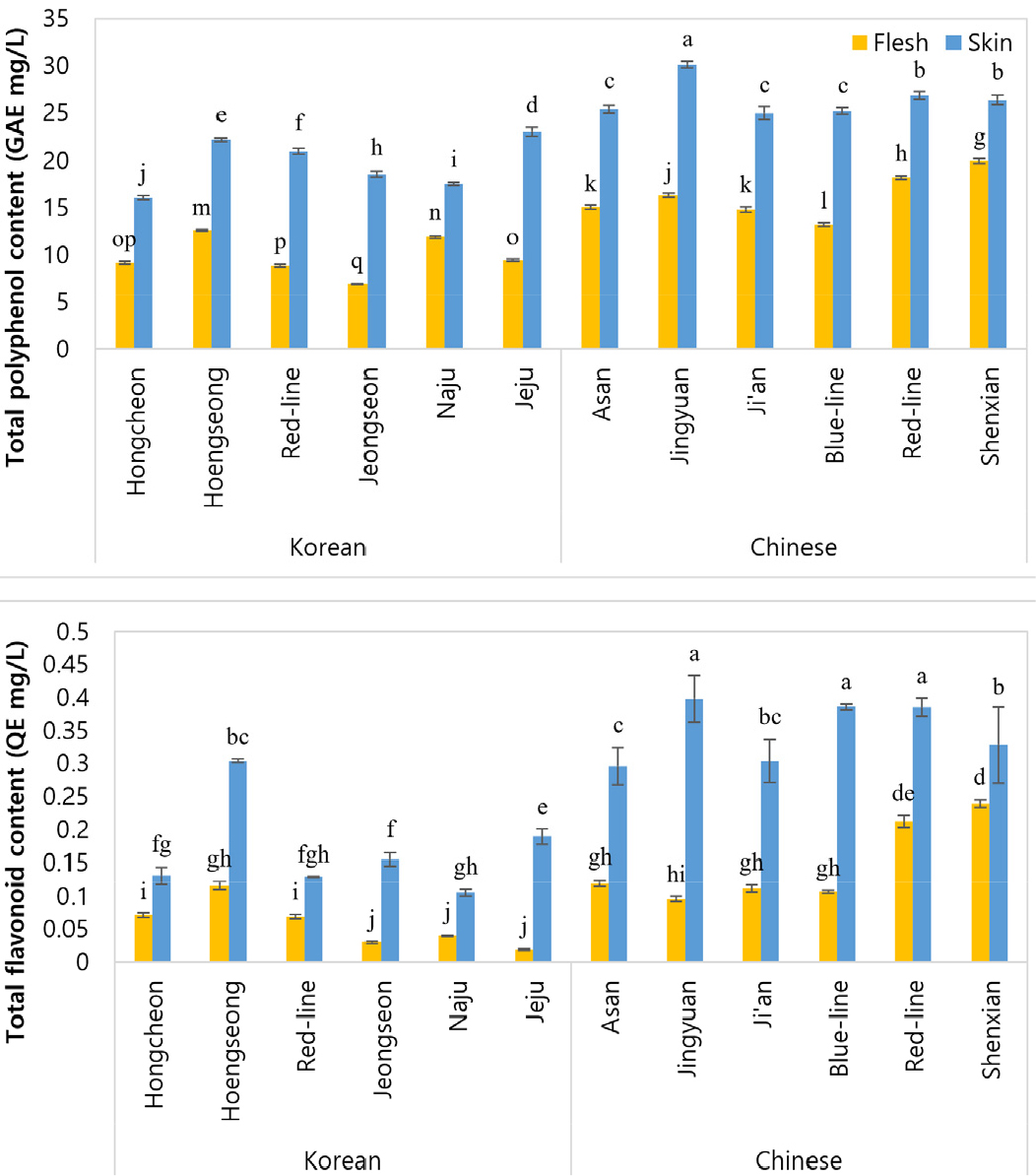
폴리페놀은 항산화, 항균 등 다양한 활성이 나타나며 항산화활성과의 상호작용에 대한 많은 연구가 이루어지고 있다(Choi et al., 2003; Fernandez-Panchon et al., 2008; Karakaya et al., 2001). 더덕의 총 폴리페놀 함량을 조사함으로써 다양한 지역과 부위에 따른 항산화 활성을 탐색하는 정보가 될 수 있을 것이다. 플라보노이드는 노랗다는 뜻을 가진 flavus에서 유래한 말로, 페놀 화합물이자 항산화, 항염증, 항균 작용을 한다(Lee and Park, 2022).
총 폴리페놀은 국내산 및 중국산 모두에서 육질보다 껍질이 더 높은 함량을 보였다(Fig. 2). 국내산에서는 제주 더덕 껍질이 23.01 µg/g으로 가장 높은 함량을 보였으며 그 다음으로 횡성 더덕 껍질(22.22 µg/g), 홍더덕 껍질(20.99 µg/g), 나주 더덕 껍질(17.52 µg/g) 순서로 높은 함량을 나타냈다. 중국산에서는 정원 더덕 껍질이 30.12 µg/g으로 가장 높은 함량을 보였으며 그 다음으로 홍더덕 껍질(26.82 µg/g), 신선 더덕 껍질(26.36 µg/g), 지안 더덕 껍질(24.96 µg/g) 순으로 높은 함량을 나타냈다.
총 플라보노이드 함량은 국내산과 중국산 모두 껍질에서 높은 함량을 나타냈다(Fig. 2). 국내산에서는 횡성 더덕 껍질이 0.3 µg/g으로 가장 높게 나타났으며 그 다음으로 제주 더덕 껍질(0.19 µg/g), 정선 더덕 껍질(0.15 µg/g), 홍천 더덕 껍질(0.13 µg/g) 순으로 높은 함량을 보였다. 중국산 더덕에서는 정원 더덕 껍질에서 0.4 µg/g으로 가장 높은 함량을 보였으며 그 다음으로 청더덕과 홍더덕 껍질(0.39 µg/g), 신선 더덕 껍질(0.33 µg/g) 순으로 높은 함량을 나타냈다.
DPPH 및 ABTS 라디칼 소거능
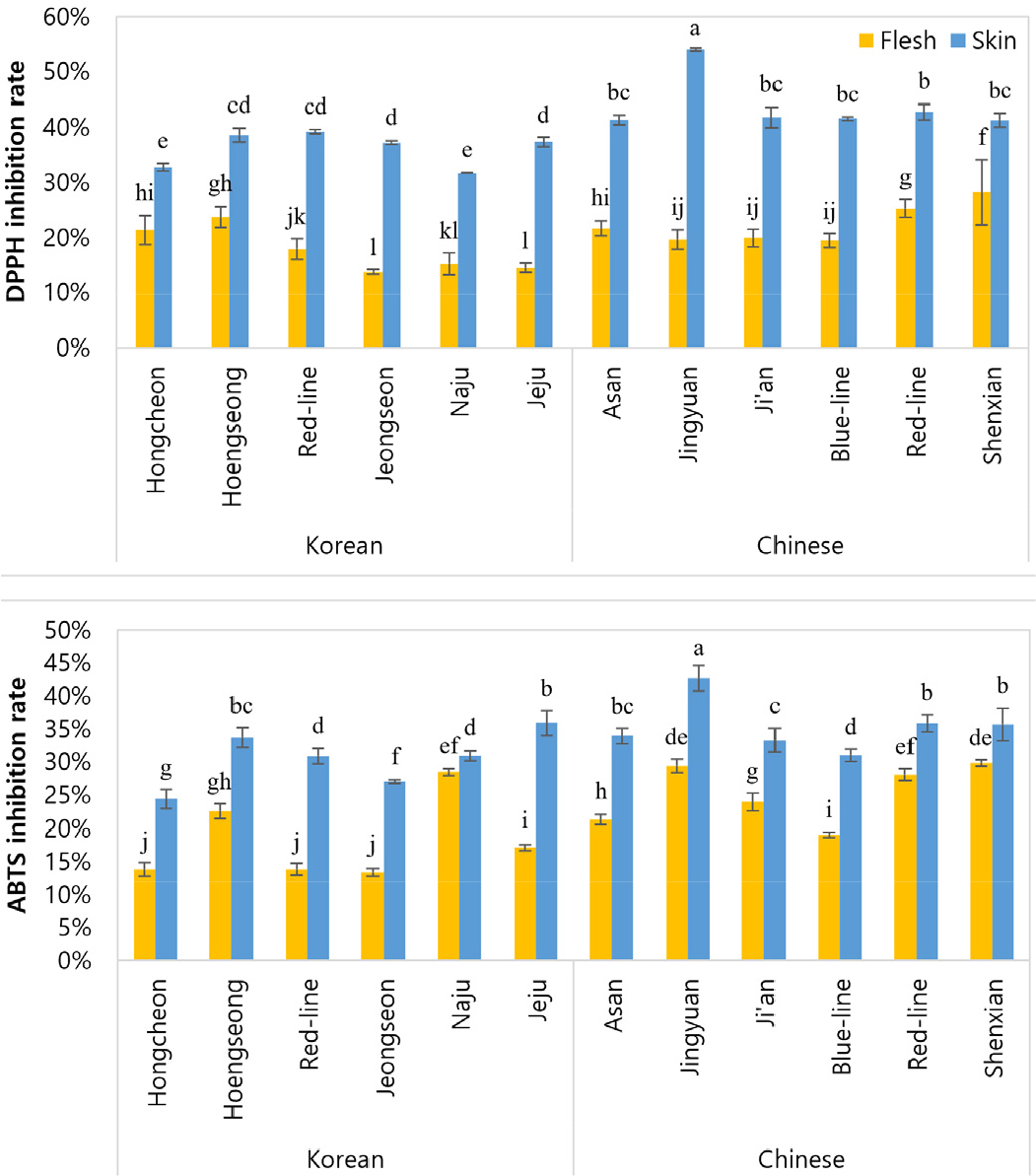
더덕의 DPPH 및 ABTS 라디칼 소거능 측정 결과는 Fig. 3와 같다. DPPH 라디칼 소거능에서 육질보다 껍질이 더 높은 소거능을 나타냈으며, 국내산에서는 홍더덕과 횡성 더덕 껍질이 39%로 가장 높은 소거능을 보였다. 중국산에서는 정원 더덕 껍질이 54%로 가장 높은 소거능을 보였다. 국내산 홍더덕과 횡성 더덕 껍질 및 중국산 정원 더덕 껍질은 총 폴리페놀 함량도 가장 높게 나타났는데, Kang(2009)과 마찬가지로 더덕 껍질 부위의 총 폴리페놀 함량이 증가할수록 항산화 활성도 증가하는 것으로 나타났다.
ABTS 라디칼 소거능 또한 육질보다 껍질에서 더 높은 소거능을 나타냈으며, 국내산에서는 제주 더덕 껍질이 36%, 중국산에서는 정원 더덕 껍질이 43%로 높은 소거능을 보였다. DPPH와 ABTS 라디칼 소거능은 서로 다른 항산화 작용 기작을 가지고 있어 일부 결과에서 차이가 있으나, 육질과 껍질 간의 항산화 활성에는 동일하게 높은 차이를 보였다.
요 약
본 연구에서는 국내산과 중국산 더덕의 부위별 기능성성분 및 생리활성을 분석하고자 하였다. 수집된 더덕은 껍질과 육질로 나누어 준 후 동결 건조하여 분말화하였고, 분석 조건에 맞추어 추출물을 제조하였다. 국내산 및 중국산 더덕의 부위별 기능성물질과 생리활성을 측정한 결과 지표물질인 tangshenoside I과 lobetyolin 함량이 육질보다 껍질에서 높게 나타났다. 국내산과 중국산 간에 기능성 물질 함량의 차이가 있었으나 이는 서로 다른 재배기간에 인한 것으로 보인다. 국내산 및 중국산 더덕을 수집지에 따라 각각을 비교해 보았을 때, tangshenoside I은 제주 더덕 껍질(302.07 µg/g)과 지안 더덕 껍질(662.97 µg/g)이 가장 높은 함량을 보였으며, lobetyolin에서는 정선 더덕 껍질(354.11 µg/g)과 신선 더덕 껍질(598.20 µg/g)이 가장 높은 함량을 보였다. p-coumaric acid를 포함한 5종의 페놀성 화합물 함량에서도 껍질이 육질보다 높은 함량을 나타냈다. 총 폴리페놀 및 플라보노이드에서 제주(23.01 µg/g)와 횡성 더덕 껍질(22.22 µg/g), 정원 더덕 껍질(30.12 µg/g)이 가장 높은 함량을 보였다. 항산화 활성 측정에 따라 껍질이 육질보다 높은 활성을 보였고, 시료 내 페놀 화합물의 함량이 증가할수록 항산화 활성 또한 증가하는 것으로 나타났다. 이와 같이 더덕의 껍질에 풍부한 기능성 물질들을 쉽고 효과적으로 섭취하기 위해서는 껍질이 비교적 연한 1년생 새싹 더덕을 활용하는 방안이 유리할 것으로 본다. 또한 고온 처리에 따라 손실되는 페놀성 화합물이 존재하므로 생으로 섭취하는 방안도 고려해야 할 것이다.