서 론
재료 및 방법
원산지 및 제조 공정 별 헤이즐넛
헤이즐넛 내 함유된 지방산 추출
표준 및 시험 용액의 유도체화
기체크로마토그래피(GC-FID)조건
통계분석
결과 및 고찰
원산지별 헤이즐넛의 지방산 분석
제조공정에 따른 헤이즐넛의 지방산 분석
요약 및 결론
서 론
헤이즐넛은 자작나무과에 속하는 개암나무의 열매로 전 세계적으로 분포 되어있으며 대표적인 생산 국가는 터키로 알려져 있다(Alasalvar et al., 2009). 국내의 경우에는 개암나무를 병개암, 난티잎개암, 물개암 등으로 분류하고 있으며 전국적으로 분포되어 있다(Hong et al., 1978). 헤이즐넛은 지방산, 단백질, 탄수화물, 식이섬유와 마그네슘, 칼슘 등의 미네랄과 항산화 물질인 폴리페놀 등 다양한 성분으로 구성되어 있다(Seyhan et al., 2007). 고 콜레스테롤 혈증 환자와 건강한 사람을 대상으로 헤이즐넛 섭취 시 심혈관 질환에 미치는 영향을 분석한 결과, 생체 지표(biomarker)인 총 콜레스테롤(total cholesterol)과 트리아실글리세롤(triacylglycerol)뿐 아니라 체내 염증 질환 생체 지표(biomarker)의 감소에 대한 다양한 임상학적 연구들이 보고 되어 있다(Santi et al., 2017; Orem et al., 2013). 헤이즐넛의 지방 조성 확인을 위한 다양한 선행 연구가 보고되어 있으며, 주요 지방산은 올레산(oleic acid, C18:1n-9, cis), 리놀레산(linoleic acid, C18:2n-6, cis), 알파-리놀렌산(α-linoelic acid, C18:3n-3)이 보고 되었다(Seyhan et al., 2007; Tufekci et al., 2018; Maguire et al, 2004; Koksal et al., 2006). 올레산(oleic acid, C18:1n-9, cis)의 경우 심혈관 질환과 관련 있는 저밀도 콜레스테롤(low-density lipoproteins) 감소에 영향을 주는 대표적인 불포화지방산으로 보고되어 있다(Oliveira et al., 2008).
다양한 영양소 공급이 가능한 헤이즐넛을 초콜릿, 커피, 디저트 류에 첨가하여 식품에 활용하고 있다. 헤이즐넛은 재배 지역의 기후와 토양의 조건 등에 따라 불포화지방산과 미네랄과 같은 유효 성분의 조성 차이가 확인되었다(Tufekci et al., 2018; Bonvehi et al., 1997; Koksal et al., 2006; Parcerisa et al., 1995). 국외산 헤이즐넛의 경우 재배지역의 따른 유효 성분의 조성 차이를 확인하는 선행연구들이 보고되었지만 국내산 헤이즐넛은 재배 지역에 따른 품질 특성에 대한 연구가 미미한 실정이다. 또한, 국내산 헤이즐넛 생산량이 증가함에 따라 각 재배 지역에 따른 헤이즐넛의 정확한 유효성분 확인을 통한 원재료의 표준화가 필요할 것으로 판단된다. 본 연구에서는 국내 각 지방에서 수확한 헤이즐넛(고창, 봉화, 홍천, 철원)과 대표적인 생산 국가인 터키산 헤이즐넛의 포화지방산(saturated fatty acid, SFA), 다가불포화지방산(polyunsaturated fatty acid, PUFA), 단일불포화지방산(monounsaturated fatty acid, MUFA) 성분의 조성 차이를 확인하였다. 더불어 홍천산 헤이즐넛을 견과류의 일반적인 제조 공정인 탈각 → 로스팅 → 착유 → 부산물(유박)의 제조 공정 단계별 지방산 조성을 확인하였다. 전처리 방법은 블라이-다이어(Bligh-Dyer)법을 이용하여 지방 추출을 진행하였고 메탄올성 수산화나트륨용액과 트리플루오르보란메탄올(boron trifluoride-methanol)용액으로 메틸에스테르(fatty acid methyl ester, FAME)로 유도체화 시켰다. 지방산 분석은 식품 공전 내 지방산 분석법을 기준으로 내부표준물이 첨가된 37종의 지방산 메틸에스테르(fatty acid methyl ester, FAME)을 표준용액으로 시료 내 함유된 유도체화 된 메틸에스테르(methyl ester)를 기체크로마토그래피-불꽃이온화장비(GC-FID) 장비를 이용하여 확인하였다. 본 연구에서 진행한 헤이즐넛의 원산지별과 착유를 통한 헤이즐넛 공정 단계별 유효성분 조성 확인은 국내산 헤이즐넛의 품질특성 확인과 헤이즐넛의 가공제품 개발을 위한 기초 자료로 활용 가능할 것으로 판단된다.
재료 및 방법
원산지 및 제조 공정 별 헤이즐넛
본 실험에 사용한 개암나무 열매인 헤이즐넛은 강원도 홍천군 기업인 농업회사법인 헤이즐넛 주식회사에서 제공받았다. 원산지 별 헤이즐넛 비교 분석을 위해 대표적 헤이즐넛 생산 국가인 터키와 국내산 지역은 전라북도 고창군, 강원도 홍천군, 강원도 철원군, 경상북도 봉화군의 헤이즐넛을 제공받았고 각 재배지에 따른 기후조건은 Table 1과 같다. 국내에서 재배된 헤이즐넛은 2020년도 09월에 수확된 헤이즐넛이며 제조 공정 별 시료는 강원도 홍천 지역의 헤이즐넛으로 비교 하였다.
Table 1.
The annual climatic conditions of hazelnut cultivation regions
| Condition | Turkey | Gochang | Bonghwa | Hongcheon | Cheorwon |
| Temperature (°C) | 23.0 | 13.2 | 10.0 | 10.8 | 10.3 |
| Precipitation (mm) | 367 | 1,225.5 | 1,175.6 | 1,338.9 | 1,354.4 |
| Humidity (%) | 60 | 79.0 | 69.5 | 67.0 | 69.9 |
헤이즐넛 내 함유된 지방산 추출
헤이즐넛 내 함유된 지방 추출은 블라이-다이어(Bligh-Dyer)법을 이용하였다. 헤이즐넛 검체 50 mg 을 2.5 mL 메탄올(methanol) 과 1.25 mL 클로로포름(chloroform) 첨가 하여 혼합하였다. 상온에서 방치 후 다시 동일한 양의 클로로포름(chloroform)첨가 후 진탕 추출 하였다. 1-2% 염화포타슘(potassium chloride) 1.25 mL을 첨가하고 1811 × g조건에서 5분간 원심분리 하였다. 원심 분리 후 유리 튜브의 클로로포름(chloroform) 층을 분액하여 질소농축기로 농축하였다.
표준 및 시험 용액의 유도체화
GC-FID를 이용한 지방산 분석을 위해 36종 지방산 메틸에스테르(fatty acid methyl ester, FAME)과 내부 표준 물질 에스테르(ester)가 포함된 표준 용액인 지방산 메틸에스테르(FAME mixture 37종)을 표준 용액으로 하였다. 내부 표준 물질은 지방산 표준 용액 보다 감응도가 높아야 한다. 식품 내 지방산의 확인을 위해 시료를 메틸에스테르화(FAME) 후 GC-FID로 분석하는 것이 지방산 분석의 시험 방법이다. 이소옥탄(iso-octane)에 녹인 지방산 메틸에스테르(undecanoic acid methyl ester)를 내부표준용액으로 하였다. 지방 추출 된 용액에 내부표준용액 1 mL을 첨가하였다. 시험 용액의 경우 내부 표준물 간섭 확인을 위해 클로로포름(chloroform)으로 대체하였다. 표준 및 시험 용액에 0.5 N 메탄올성 수산화나트륨 용액 1.5 mL를 가하고 질소 가스를 주입 하여 혼합 후 heating block을 이용해 100°C에서 5분간 가온 하였다. 30-40°C로 냉각된 용액에 이소옥탄(iso-octane)용액 1 mL을 첨가한 뒤 질소가스를 주입하여 뚜껑을 덮고 균질화 시키며 진탕하였다. 진탕 후 염화나트륨(sodium chloride)용액 5 mL를 가하고 질소가스를 주입 후 뚜껑을 덮고 다시 진탕하였다. 상온의 조건에서 냉각된 시험 용액의 수층에서 분리된 이소옥탄(iso-octane)층을 무수황산나트륨(sodium sulfate)으로 탈수 후 시험용액으로 사용하였다.
기체크로마토그래피(GC-FID)조건
원산지 별 헤이즐넛과 착유 공정 단계 별 시료 내 함유된 지방산 분석은 식품공전 내 지방산 분석법을 이용하였다. 지방 추출된 시험 용액을 메탄올성 수산화나트륨으로 알칼리염화 하여 트리플루오르보란메탄올(boron trifluoride- methanol) 가한 후 가열하여 메틸에스테르화(fatty acid methyl ester, FAME)로 유도체화 시킨 뒤 이소옥탄(iso-octane)으로 녹인 용액을 GC-FID를 이용하여 분석하였다. GC-FID 분석 조건은 SP-2560(100 m × 0.25 mm, 0.2 um) 컬럼(column)을 이용하여 100°C에서 4분간 유지 후 3°C/min의 비율로 240°C까지 온도를 상승시킨 뒤 15분 이상 유지하는 조건으로 분석하였다. 그 외의 주입부 온도: 220°C, 검출기 온도: 285°C, 유량: 헬륨(He) 0.75mL/min 로 split ratio 200:1, 주입량 1 uL로 분석하였다. 분석에서 확인된 지방산은 메틸 에스테르(methyl ester)이므로 각 지방산 별 전환 계수를 이용하여 개별지방산으로 전환하여 조성을 확인하였다. 이성질체의 지방산인 트랜스(trans)형의 지방산은 동일한 분자량의 시스(cis)형 지방산과 동일한 전환 계수를 적용하여 전환하였다.
통계분석
분석된 지방산의 조성 결과는 3회 반복하여 얻은 결과로 평균 ± 표준편차(mean ± S.D)로 표시하였다. 통계 분석은 SPSS statistics 27.01 버전을 이용하였으며 원산지 별 제조 공정 단계 별 헤이즐넛의 지방산 유의성을 확인하였다. 일원분산분석(One-way ANOVA)을 이용하여 p < 0.05 수준으로 유의성을 확인하였고 Tukey HSD와 Games-Howell를 이용하여 사후 검정하였다.
결과 및 고찰
원산지별 헤이즐넛의 지방산 분석
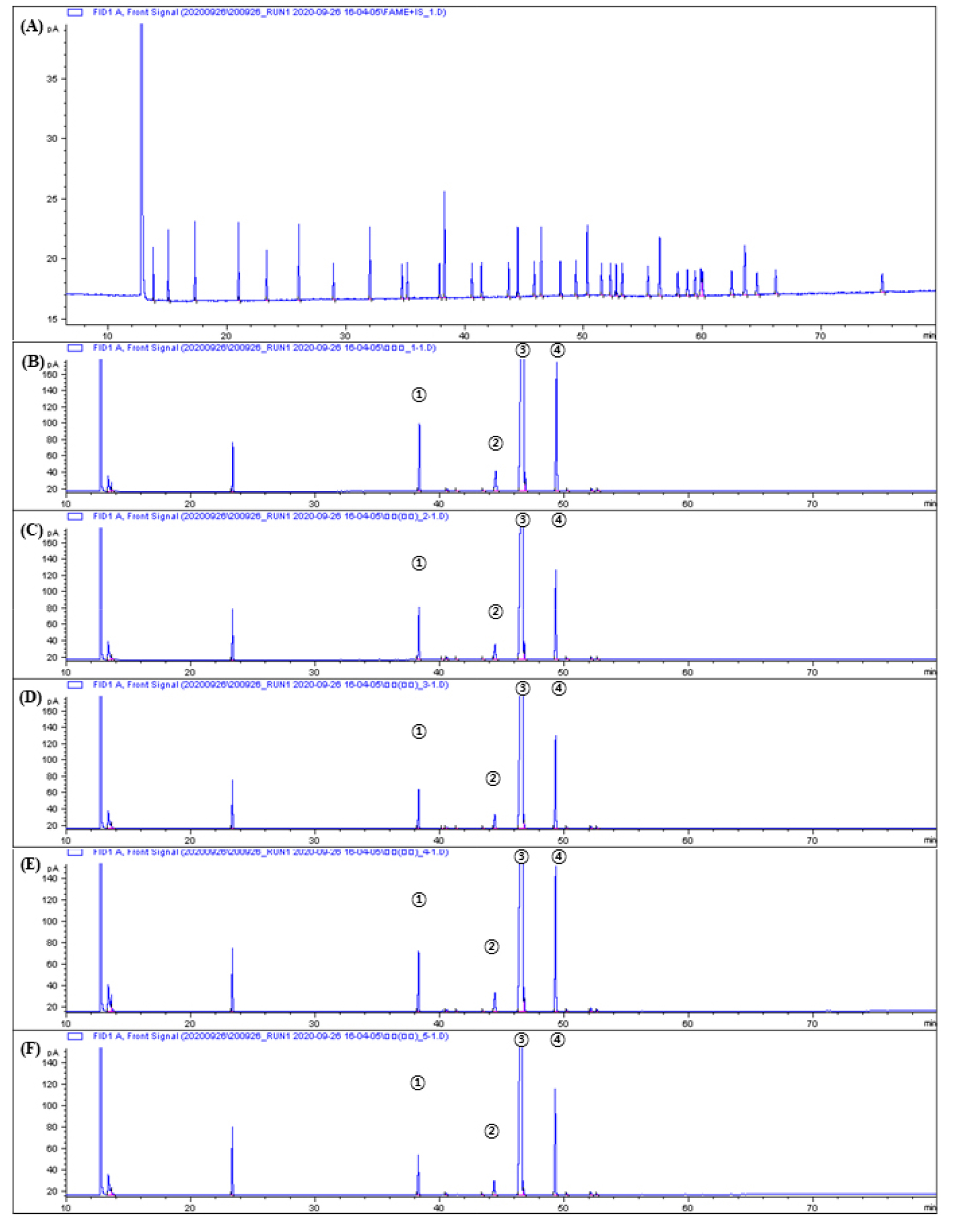
유지 함유량이 많은 헤이즐넛의 원산지별 유효성분인 지방산 조성을 기체크로마토그래피-불꽃이온화검출기(GC-FID)장비를 이용하여 분석을 하였다. 대표적인 재배 국가인 터키산과 국내산(전북 고창, 경북 봉화, 강원 홍천, 강원 철원) 헤이즐넛의 GC 크로마토그램과 지방산 조성의 결과는 Fig. 1과 Table 2와 같다. 선행연구에서와 같이 헤이즐넛의 지방산 70-80%의 단불포화지방산을 포함하고 있으며 본 연구에서도 동일한 결과를 확인할 수 있었다. 터키(79.3%), 고창(80.5%), 봉화(81.2%), 홍천(81.4%), 철원(77.9%)의 불포화지방산의 함유량을 확인하였다. 국내외 5곳 원산지의 헤이즐넛에서 ω-9계열 지방산인 올레산(oleic acid, C18:1n-9, cis)의 조성이 가장 높음을 확인하였고 터키(79.09%) 헤이즐넛 대비 고창(80.24%, p < 0.001), 봉화(80.93%, p < 0.01), 홍천(81.13%, p < 0.01)의 순으로 유의적으로 조성이 높았고, 철원(77.55%, p < 0.01)은 유의적으로 낮게 나타났다. 유지 함유가 많은 식물 종자의 기후와 지방산 조성의 연관성 확인 결과 기온과 강수량이 올레산(oleic acid, C18:1n-9, cis) 조성에 영향을 주는 것으로 보고 되어져 있다(Pritchard et al., 2000) Table 1에 제시한 것 과 같이 터키산과 국내 각 재배지역의 기후 조건 차이가 올레산(oleic acid, C18:1n-9, cis) 조성의 차이에 영향을 주었을 것으로 판단된다. 헤이즐넛의 가장 높은 조성을 가지는 올레산(oleic acid, C18:1n-9, cis)은 항염증효과와 인슐린 저항성을 증가에 영향을 주며(Orsavova et al., 2015), 동물 실험을 통해 올레산(oleic acid, C18:1n-9, cis) 주입 시 포도당 생성을 억제에 관여하는 인슐린 저항성의 대사에 대한 연구 결과가 보고되어 있다(Obici et al., 2002). ω-6 계열 지방산인 리놀레산(linoleic acid, C18:2n-6, cis)는 터키(10.33%), 고창(9.17%, p < 0.01), 봉화(9.78%), 홍천(9.98%), 철원(11.64%, p < 0.01)의 조성으로 터키산 대비 철원 지역의 헤이즐넛이 유의적으로 높게 나타났고, 고창 지역의 헤이즐넛이 유의적으로 낮게 나타났다. ω-3 계열 지방산인 알파-리놀렌산(α-linoelic acid, C18:3n-3)은 터키(0.10%) 대비 홍천(0.13%, p < 0.05)과 철원(0.14%, p < 0.01)의 헤이즐넛이 유의적으로 높게 나타났다. 팔미톨레산(palmitoleic acid, C16:1)은 터키(0.14%)대비 고창(0.16%, p < 0.0001), 봉화(0.11%, p < 0.0001), 홍천(0.11%, p < 0.0001), 철원(0.11% p < 0.0001) 유의적으로 낮게 확인되었다. 포화지방산의 경우에는, 팔미트산(palmitic acid, C16:0)과 스테아르산(stearic acid, C18:0)이 주요 지방산으로 확인되었다. 팔미트산(palmitic acid, C16:0) 은 터키(5.13%) 대비 봉화(3.79%, p < 0.0001), 홍천(3.71%, p < 0.0001), 철원(3.92%, p < 0.0001)의 헤이즐넛에서 유의적으로 낮게 나타났고, 스테아르산(stearic acid, C18:0)은 터키(2.59%), 고창(2.23%, p < 0.001), 봉화(1.98%, p < 0.0001), 홍천(1.87%, p < 0.0001), 철원(1.73%, p < 0.0001)으로 국내 지역 모두 유의적으로 낮게 확인되었다. 각 재배 지역별 헤이즐넛의 지방산 조성 확인 결과 77.9-81.4%의 단불포화지방산을 함유하는 것으로 확인되었고 다불포화지방산의 조성이 9.2-11.8%로 확인되었고, 포화지방산은 5.7-7.9%의 함유량을 확인하였다.
Table 2.
The composition of fatty acids in hazelnut from different regions (unit %)
| Fatty acid (unsaturation) | Turkey | Gochang | Bonghwa | Hongcheon | Cheorwon |
| Palmitic acid (C16:0) | 5.13 ± 0.081) | 4.93 ± 0.12 | 3.79 ± 0.01****2) | 3.71 ± 0.07**** | 3.92 ± 0.03**** |
| Palmitoleic acid (C16:1) | 0.14 ± 0.00 | 0.16 ± 0.00**** | 0.11 ± 0.00**** | 0.11 ± 0.00**** | 0.11 ± 0.01**** |
| Heptadecanoic acid (C17:0) | 0.05 ± 0.00 | 0.05 ± 0.01 | 0.04 ± 0.00** | 0.04 ± 0.00*** | ND3) |
| Stearic acid (C18:0) | 2.59 ± 0.02 | 2.23 ± 0.10*** | 1.98 ± 0.05**** | 1.87 ± 0.05**** | 1.73 ± 0.09**** |
| Oleic acid (C18:1n-9, Cis) | 79.09 ± 0.38 | 80.24 ± 0.45*** | 80.93 ± 0.47** | 81.13 ± 0.05** | 77.55 ± 0.46** |
| Linoleic acid (C18:2n-6, Cis) | 10.33 ± 0.31 | 9.17 ± 0.48** | 9.78 ± 0.31 | 9.98 ± 0.10 | 11.64 ± 0.27** |
| Arachidic acid (C20:0) | 0.11 ± 0.00 | 0.14 ± 0.00* | 0.08 ± 0.07 | 0.04 ± 0.06 | 0.13 ± 0.00** |
| Eicosenic acid (C20:1) | 0.10 ± 0.09 | 0.13 ± 0.11 | 0.15 ± 0.13 | 0.21 ± 0.01 | 0.23 ± 0.01 |
| α-Linolenic acid (C18:3n-3) | 0.10 ± 0.00 | 0.07 ± 0.06 | 0.13 ± 0.01 | 0.13 ± 0.00* | 0.14 ± 0.00** |
| SF (Saturated fatty acids) | 7.9 ± 0.06 | 7.4 ± 0.14 | 5.9 ± 0.11 | 5.7 ± 0.16 | 5.8 ± 0.12 |
| MuSF (Monounsaturated fatty acids) | 79.3 ± 0.39 | 80.5 ± 0.49 | 81.2 ± 0.38 | 81.4 ± 0.05 | 77.9 ± 0.46 |
| PuSF (Polyunsaturated fatty acids) | 10.4 ± 0.31 | 9.2 ± 0.47 | 9.9 ± 0.31 | 10.1 ± 0.10 | 11.8 ± 0.27 |
제조공정에 따른 헤이즐넛의 지방산 분석
견과류의 가장 일반적인 제조 공정인 착유 공정 단계별 시료의 지방산 조성을 확인하여 유효성분의 변화를 확인하였다. 공정 단계별 시료 분석을 통해 원재료의 함유된 유효성분이 공정에 따른 함량 변화를 확인함으로서 유효성분의 함량 범위 설정에 기초 자료로 활용할 수 있다. 공정 단계별 지방산 조성 확인 결과는 Table 3과 같다. 헤이즐넛의 주요 불포화지방산인 올레산(oleic acid, C18:1n-9, cis)는 공정에 따라 감소하는 경향을 나타냈으며 원재료(81.13%) 대비 로스팅(76.53%, p < 0.001), 착유된 헤이즐넛유(78.82%, p < 0.05), 유박(부산물, 62.13%, p < 0.001)의 조성을 나타내었고, 원재료 대비 로스팅, 착유, 유박 시료는 유의적으로 감소하였다. ω-6계열 지방산인 리놀레산(linoleic acid, C18:2n-6, Cis)은 원재료(9.98%) 대비 로스팅(12.61%, p < 0.05), 착유(11.44%), 유박(18.97%, p < 0.01)에서 증가하는 경향을 보였으며, 특히, 로스팅 및 유박은 유의적인 차이를 보였다. ω-3 계열 지방산인 알파-리놀렌산(α-linoelic acid, C18:3n-3)은 원재료 대비 로스팅(0.16%, p < 0.01), 착유(0.21%, p < 0.01), 유박(4.85%, p < 0.01) 유의적으로 증가하였다. 팔미트산(palmitic acid, C16:0), 팔미톨레산(palmitoleic acid, C16:1), 스테아르산(stearic acid, C18:0)은 원재료 대비 공정 단계별로 비슷한 수준으로 확인되었다. 포화도에 따른 지방산의 전체 조성은 포화지방산은 유사한 수준을 유지하였고 단불포화지방산은 원재료(81.4%)보다 로스팅(76.9%), 착유(79.17%), 유박(62.5%)에서 모두 감소하였고 다불포화지방산은 원재료(10.1%), 로스팅(12.8%), 착유(11.65%)대비 유박(23.8%)에서 가장 높은 다불포화지방산이 확인되었다.
Table 3.
The composition of fatty acids in hazelnut based on the manufacturing process (unit %)
| Fatty acid (unsaturation) | Raw-materials | Roasting | Hazel nut oil | by-product |
| Palmitic acid (C16:0) | 3.71 ± 0.071) | 4.04 ± 0.15*2) | 4.18 ± 0.00** | 4.61 ± 0.03* |
| Palmitoleic acid (C16:1) | 0.11 ± 0.00 | 0.13 ± 0.00* | 0.14 ± 0.00**** | 0.13 ± 0.00* |
| Heptadecanoic acid (C17:0) | 0.04 ± 0.00 | ND3) | 0.04 ± 0.00 | ND |
| Stearic acid (C18:0) | 1.87 ± 0.05 | 2.23 ± 0.26 | 1.95 ± 0.00 | 1.88 ± 0.02 |
| Oleic acid (C18:1n-9, Cis) | 81.13 ± 0.05 | 76.53 ± 1.13*** | 78.82 ± 0.06* | 62.13 ± 0.31*** |
| Linoleic acid (C18:2n-6, Cis) | 9.98 ± 0.10 | 12.61 ± 0.92* | 11.44 ± 0.02 | 18.97 ± 0.06** |
| Arachidic acid (C20:0) | 0.04 ± 0.06 | 0.15 ± 0.01 | 0.13 ± 0.00 | 0.16 ± 0.00 |
| Eicosenic acid (C20:1) | 0.21 ± 0.01 | 0.21 ± 0.01 | 0.21 ± 0.01 | 0.26 ± 0.00 |
| α-Linolenic acid (C18:3n-3) | 0.13 ± 0.00 | 0.16 ± 0.01** | 0.21 ± 0.00** | 4.85 ± 0.16** |
| SF (Saturated fatty acids) | 5.7 ± 0.16 | 6.4 ± 0.36 | 6.31 ± 0.00 | 6.6 ± 0.05 |
| MuSF (Monounsaturated fatty acids) | 81.4 ± 0.05 | 76.9 ± 1.12 | 79.17 ± 0.06 | 62.5 ± 0.31 |
| PuSF (Polyunsaturated fatty acids) | 10.1 ± 0.10 | 12.8 ± 0.92 | 11.65 ± 0.02 | 23.8 ± 0.10 |
요약 및 결론
본 연구는 홍천군에서 재배되는 헤이즐넛의 품질 특성을 확인하고자 대표적 생산 국가인 터키산과 국내 4 지역의 재배지에 따른 헤이즐넛의 지방산 조성을 확인하였다. 더불어 헤이즐넛을 활용한 가공제품 개발을 위하여, 헤이즐넛의 착유 공정에 따른 지방산의 변화를 확인하였다. 재배 지역별 지방산 조성을 비교한 결과 헤이즐넛의 주요 지방산인 ω-9계열 지방산인 올레산(oleic acid, C18:1n-9, cis)이 77.55-81.13%로 가장 높은 조성을 나타냈으며 터키산 헤이즐넛 대비 국내산 헤이즐넛에서 높은 올레산(oleic acid, C18:1n-9, cis)의 함유를 확인하였다. 국내 4곳 재배 지역의 헤이즐넛을 비교 분석한 결과 70-80%가 단불포화지방산으로 나타났으며 이는 기존에 보고된 선행연구와 일치하는 결과를 얻었다. 홍천산 헤이즐넛의 제조 공정 단계의 지방산 조성 변화로는 올레산(oleic acid, C18:1n-9, cis)이 원재료 81.13%에서 유박 62.13%로 감소하였다. 전체 단불포화지방산은 원재료 81.4%에서 유박 62.5%로 감소하였고 다불포화지방산은 원재료 10.1%에서 유박 23.8%로 증가하였다. 본 연구 결과를 바탕으로 국내산 헤이즐넛이 대표적 생산 국가인 터키산 헤이즐넛과 유사하거나 더 높은 수준의 불포화지방산을 함유하는 것으로 나타났다. 본 연구결과는 홍천산 헤이즐넛의 품질 특성 확인과 가공제품 개발을 위한 기초 자료로서의 활용이 가능할 것으로 판단된다.